MiR-214靶向线粒体相关凋亡诱导因子2对T细胞淋巴母细胞性淋巴瘤Jurkat细胞增殖、凋亡和侵袭的调控作用①
2018-10-12李海龙符才波
胡 敏 李海龙 符才波 陈 瑜 陈 军
(海南医学院第一附属医院血液内科,海口570102)
淋巴母细胞性淋巴瘤(Lymphoblastic lympho-ma,LBL)是一种少见的具有高度侵袭性的恶性淋巴瘤,常见于儿童和青少年,是儿童和青少年中第二常见的非霍奇金淋巴瘤(Non-hodgkin lymphoma,NHL)亚型[1]。90%的LBL都为T细胞淋巴母细胞性淋巴瘤(T cell lymphoblastic lymphoma,T-LBL)[2]。T-LBL严重威胁着人们的身体健康。加深对T-LBL的研究对人类抗癌事业具有重要意义。大量研究表明恶性淋巴瘤中存在许多表达异常的小RNAs(microRNAs,miRs)[3,4]。这些microRNAs在淋巴瘤中具有重要的调控作用[5-7]。据报道miR-214在骨髓瘤、黑色素瘤及神经胶质瘤等多种癌症中,通过靶向下游基因调控癌细胞增殖、凋亡、血管新生,侵袭及转移等,具有成为多种癌症治疗靶点的潜能[8,9]。有数据表明miR-214在T-LBL中高表达,miR-214过表达可作为T-LBL诊断和预后的生物标记分子[10]。但miR-214在T-LBL中的具体功能的报道还十分罕见,还有待进一步研究。本研究主要目的是探索miR-214对T-LBL细胞Jurkat增殖、凋亡和侵袭的调控作用及其分子机制。
1 材料与方法
1.1细胞及主要试剂 T细胞淋巴母细胞性淋巴瘤细胞系Jurkat来源于美国典型培养物保藏中心(American Type Culture Collection,ATCC)。RPMI1640培养基,胎牛血清及转染试剂TurboFect Transfection Regent购自赛默飞世尔科技公司。RNA提取试剂盒RNAiso Plus reagent和SYBR Premix Ex TaqTM试剂盒购自大连TaKaRa公司。荧光素酶报告载体pGL3来源于Promega公司。CCK-8试剂盒来源于日本同仁化学公司。细胞凋亡检测试剂盒Annexin V Apoptosis Detection Kit,Transwell小室及人工基底膜来源于美国BD公司。Jurkat细胞于含10%胎牛血清的RPMI1640培养液中置于37℃,5%CO2的恒温培养箱中培养。Jurkat细胞分为4组:Jurkat(对照组);miR-214 inhibitor组;sh-AIFM2组;miR-214 inhibitor+sh-AIFM2组。
1.2方法
1.2.1实时定量PCR(Quantitative real-time reverse transcription PCR,qRT-PCR) 按照试剂盒说明书提取Jurkat细胞中的总RNA,并反转录成cDNA,根据SYBR Premix Ex TaqTM说明书进行qRT-PCR。MiR-214上游引物:5′-GGACAGGACGCACAGTCA-3′,miR-214下游引物:5′-CAGACGAGGCTCCGTGGT-3′;AIFM2上游引物:5′-GGCCAGTGTCTGTC-TGTGAG-3′;AIFM2下游引物:5′CGTGTATGGCA-GAGATTTG-3′。用公式2-ΔΔCt计算相对表达量。
1.2.2荧光素酶分析 在Jurkat细胞中转入miR-214对照和pGL3空载体作为对照组;转入miR-214对照和含野生型或者突变型AIFM2序列的重组载体;转入miR-214和pGL3空载体或者含野生型或者突变型AIFM2序列的重组载体。培养48 h后移去培养液,用PBS洗涤细胞后加入1×的细胞裂解液将细胞裂解。振荡器上室温振荡5~10 min,移入离心管中离心,3 000 r/min,5 min。取上清进行发光测定。
1.2.3CCK-8检测细胞增殖 单独或同时将miR-214 inhibitor和sh-AIFM2转入Jurkat细胞中,连续培养4 d,每天检测细胞增殖。首先用稀释到10%的CCK-8溶液,再用上述稀释液将待测细胞悬浮,然后在37 ℃恒温培养箱中培养4 h,最后在450 nm处检测吸光值,计算细胞增殖倍数。
1.2.4流式细胞术分析细胞凋亡 首先用1×的Binding buffer将4组待测的细胞制成1×106个/ml的悬液。然后用Annexin V-fluorescein isothiocyanate(FITC),碘化丙啶(Propidium Iodide,PI)染色15 min,最后利用流式细胞仪对染色的细胞进行检测。
1.2.5Transwell检测细胞侵袭 首先用含1%胎牛血清的培养液将4组待测的细胞制成1×106个/ml的悬液。然后将上述细胞悬液加入已铺有人工基底膜的Transwell的上室中,并在下室中加入含20%胎牛血清的培养液。37℃培养24 h,用0.5%的结晶紫对上室底部细胞进行染色,并用棉签将上室内侧的细胞除去。显微镜下观察细胞形态并统计细胞数量。
1.3统计学分析 用SPSS17.0软件对实验数据进行统计学分析,两两比较用独立的t检验。P<0.05认为存在统计学差异。每个试验重复3次。
2 结果
2.1Jurkat细胞中miR-214负向调控AIFM2表达 利用qRT-PCR检测miR-214和AIFM2表达。图1显示,miR-214 mimic增强miR-214表达的同时会抑制AIFM2表达(P<0.05)。反之,miR-214 inhi-bitor抑制miR-214表达的同时会提高AIFM2表达(P<0.05)。上述结果表明,在Jurkat细胞中miR-214负向调控AIFM2表达。
2.2MiR-214与AIFM2存在直接靶向关系 生物信息学分析发现miR-214可靶向AIFM2,利用荧光素酶进一步验证miR-214与AIFM2的靶向关系。如图2所示,转染miR-214,或者含野生型AIFM2序列的重组载体,或者含突变型AIFM2序列的重组载体及同时转染miR-214和含突变型AIFM2序列的重组载体都不会影响荧光素酶活性。但同时转染miR-214和含野生型AIFM2序列的重组载体后,荧光素酶活性明显降低(P<0.05)。由此可见,miR-214确实与AIFM2存在直接靶向关系。
2.3沉默Jurkat细胞AIFM2表达 利用shRNA干扰Jurkat细胞AIFM2表达,通过qRT-PCR检测AIFM2表达分析干扰效果。由图3可知,在Jurkat细胞中转入sh-AIFM2后AIFM2相对表达量明显降低(P<0.05)。以上结果说明,sh-AIFM2已成功沉默Jurkat细胞的AIFM2。
2.4MiR-214靶向AIFM2对Jurkat细胞增殖的影响 通过CCK-8检测miR-214 inhibitor结合sh-AIFM2对Jurkat细胞增殖的影响。图4显示,miR-214 inhibitor可降低细胞增殖;sh-AIFM2会增强细胞增殖(P<0.05)。而且,sh-AIFM2会减弱miR-214 inhibitor对细胞增殖的抑制作用(P<0.05)。上述结果表明,抑制Jurkat细胞miR-214可通过AIFM2降低细胞增殖。
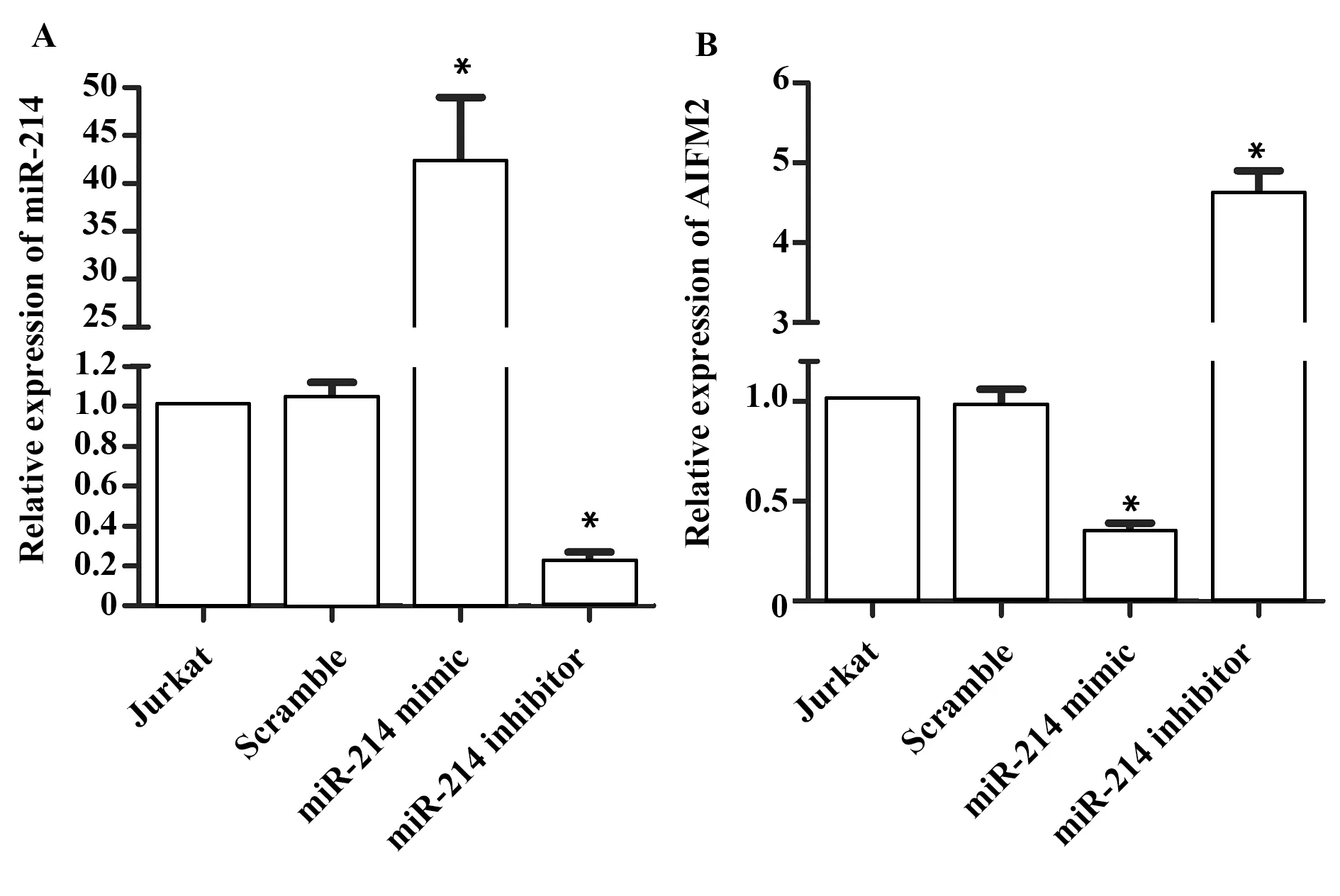
图1 qRT-PCR检测miR-214(A)和AIFM2(B)表达Fig.1 Expression of miR-214(A)and AIFM2(B)was tested by qRT-PCRNote: *.P<0.05 vs.Jurkat(control group).
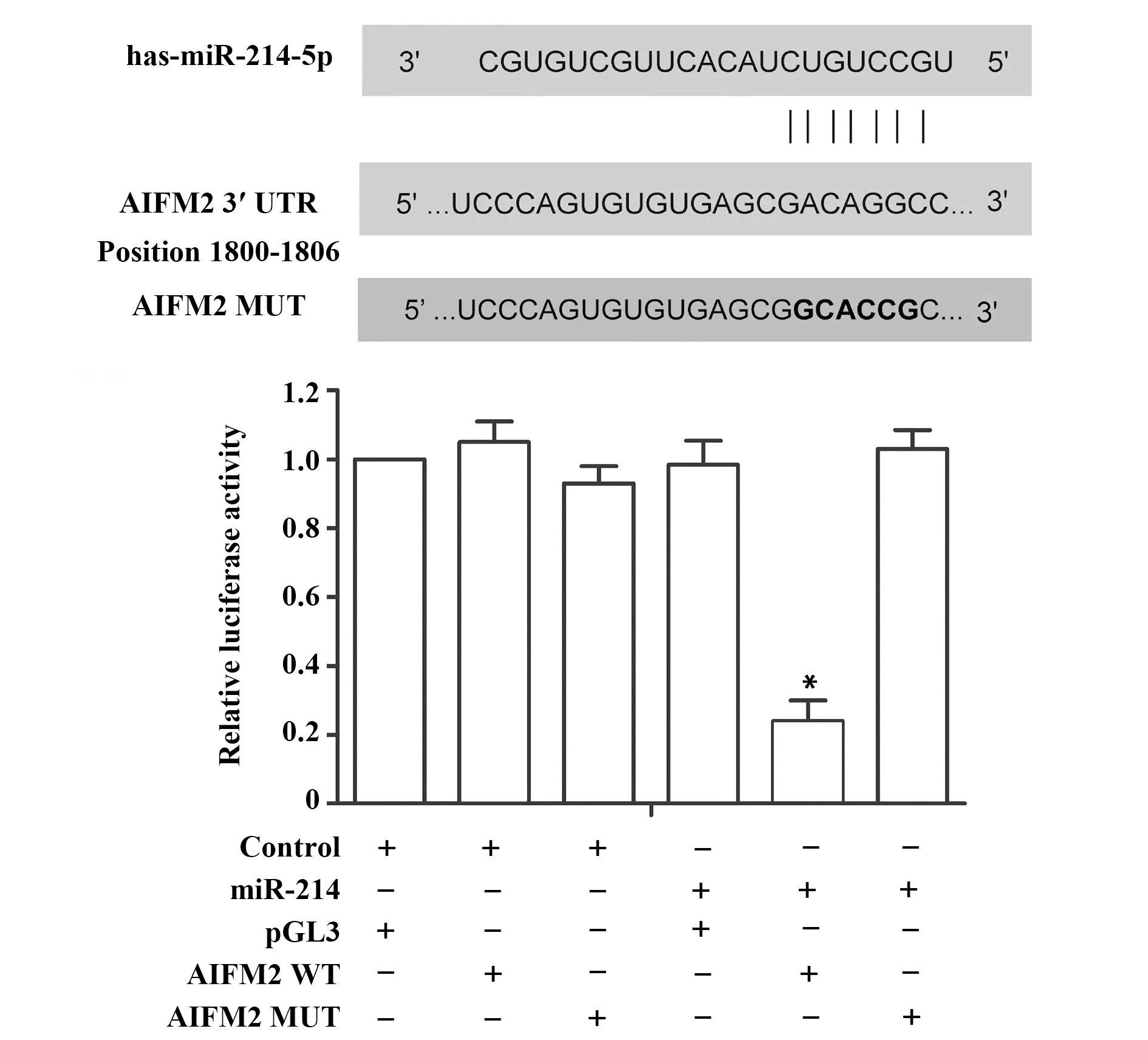
图2 荧光素酶分析Fig.2 Luciferase assayNote: *.P<0.05 vs.control group.
2.5MiR-214靶向AIFM2对Jurkat细胞凋亡的影响 为分析miR-214对Jurkat细胞凋亡的影响,流式细胞术检测细胞凋亡率。如图5所示,miR-214 inhibitor组细胞凋亡率明显高于对照组;sh-AIFM2组细胞凋亡率明显低于对照组(P<0.05)。与miR-214 inhibitor组相比,miR-214 inhibitor+ sh-AIFM2组细胞凋亡率明显下降(P<0.05)。由此可见,抑制Jurkat细胞miR-214可通过AIFM2促进细胞凋亡。
2.6MiR-214靶向AIFM2对Jurkat细胞侵袭的影响 利用Transwell检测Jurkat细胞侵袭,分析miR-214对Jurkat细胞侵袭的影响。由图6 可知,miR-214 inhibitor组细胞侵袭明显低于对照组;sh-AIFM2组细胞侵袭明显高于对照组(P<0.05)。而且,sh-AIFM2会减弱miR-214 inhibitor导致的细胞侵袭的下降(P<0.05)。以上结果说明,抑制Jurkat细胞miR-214可通过AIFM2降低细胞侵袭。
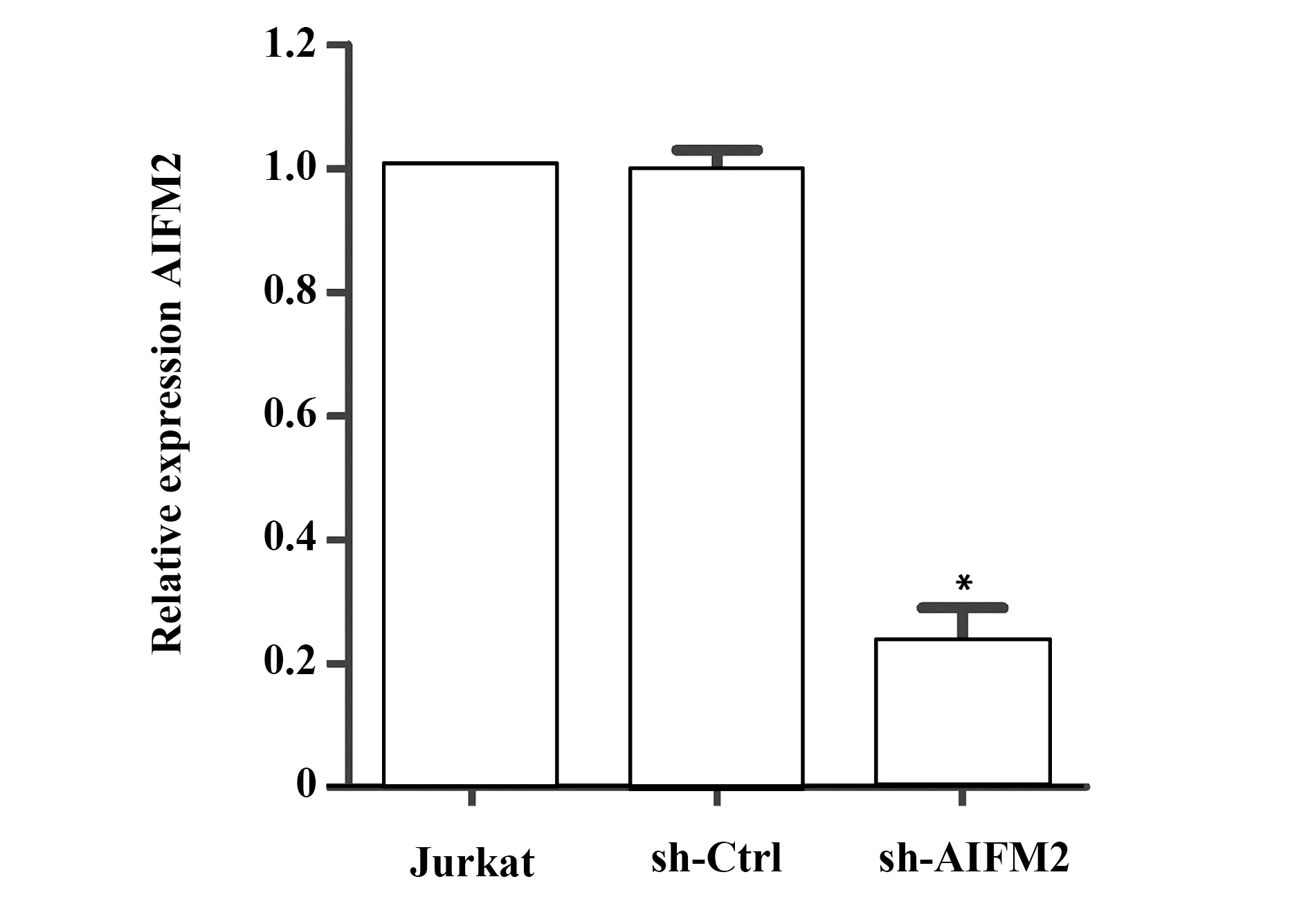
图3 qRT-PCR检测AIFM2表达Fig.3 Expression of AIFM2 was detected by qRT-PCRNote: *.P<0.05 vs.Jurkat(control group).
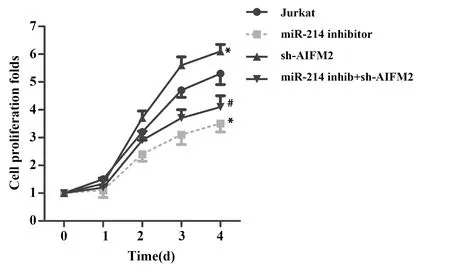
图4 CCK-8检测细胞增殖Fig.4 Cell proliferation was measured by CCK-8Note: *.P<0.05 vs.Jurkat(control group);#.P<0.05 VS.miR-214 inhibitor group.
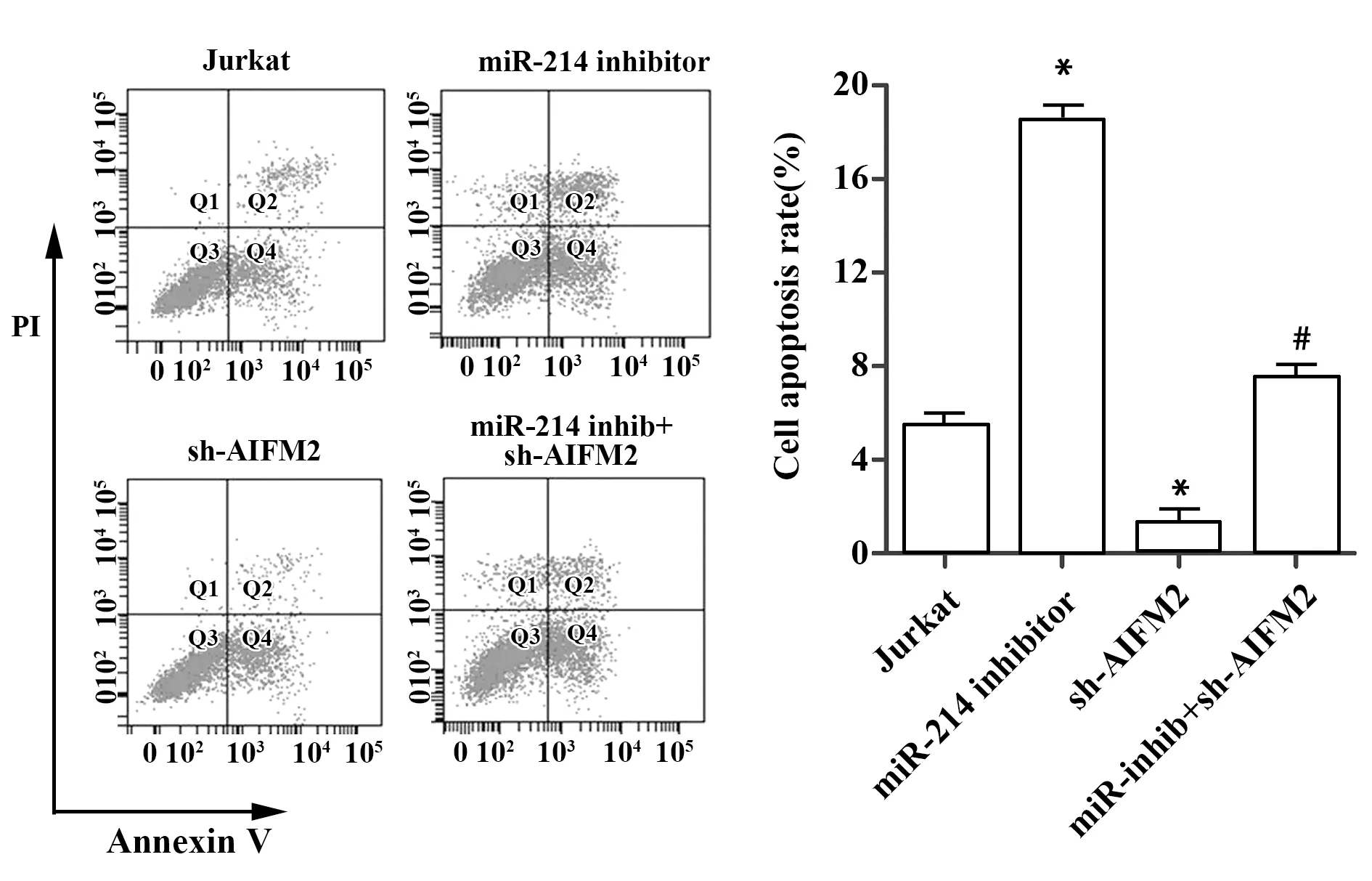
图5 流式细胞术检测细胞凋亡Fig.5 Apoptosis was detected by flow cytometryNote: *.P<0.05 vs.Jurkat(control group);#.P<0.05 vs.miR-214 inhibitor group.
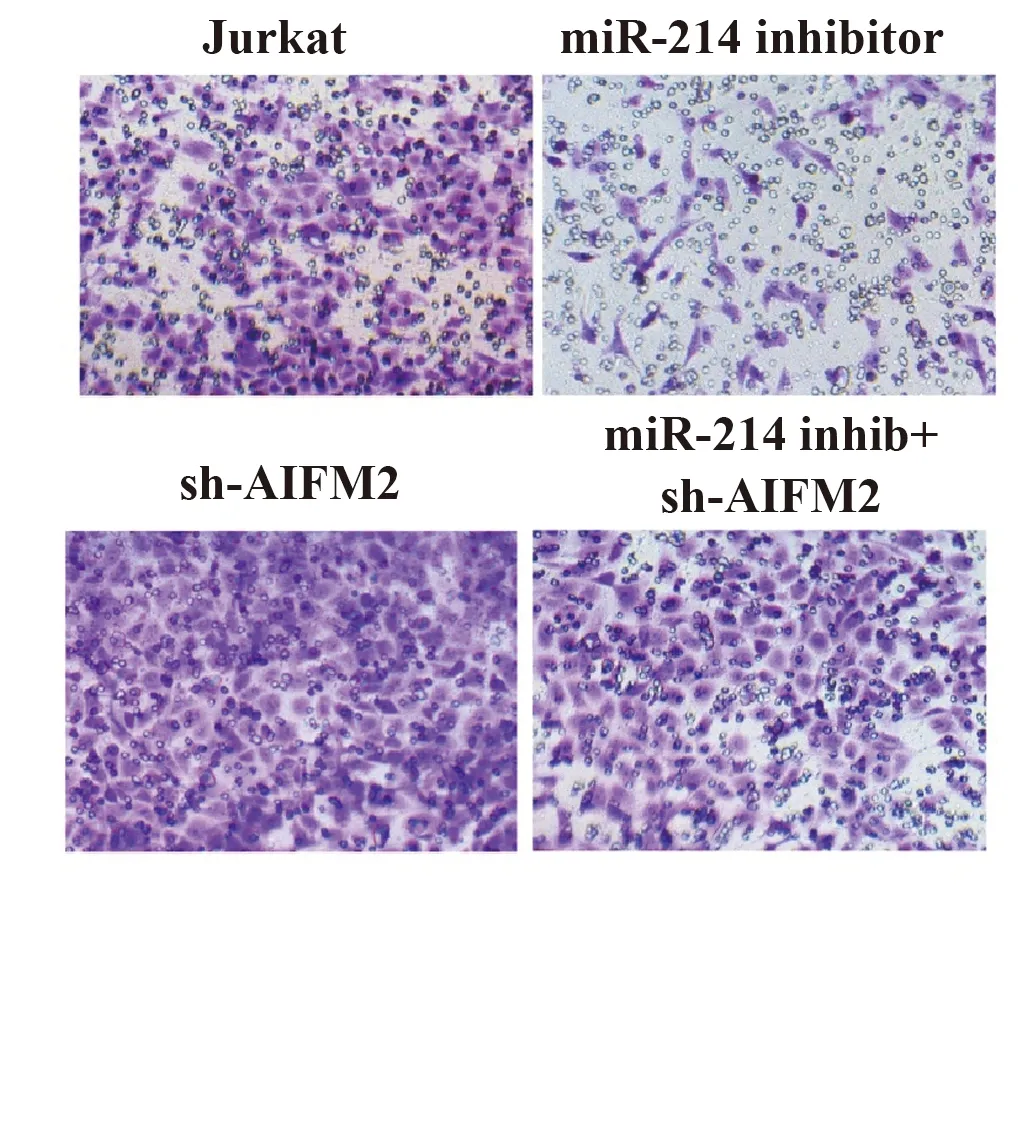
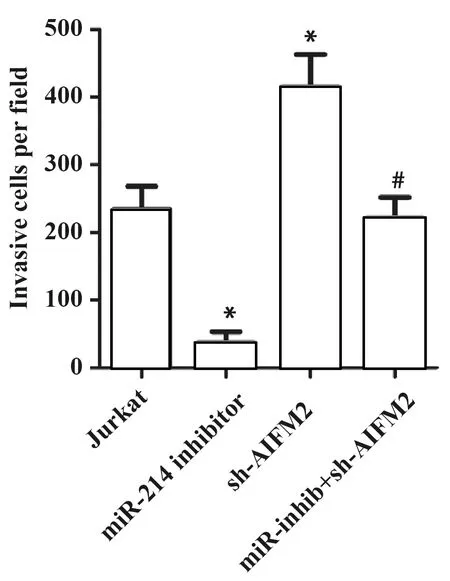
图6Transwell检测细胞侵袭
Fig.6CellinvasionwasdetectedbyTranswell
Note: *.P<0.05 vs.Jurkat(control group);#.P<0.05 vs.miR-214 inhibitor group.
3 讨论
目前针对LBL的治疗策略主要包括强化诱导缓解化疗,早期的中枢神经系统预防,合并阻断和随后的维护治疗等。随着分子生物学的发展,靶向治疗受到了越来越多的关注[2]。大量数据表明许多microRNAs在靶向治疗中发挥着积极作用[11-13]。这些microRNAs具有调控细胞增殖、凋亡和侵袭等功能。
细胞增殖的不受控制是癌细胞的主要特征之一。大量文献报道microRNAs在细胞增殖方面具有重要的调控作用。有研究表明降低miR-155表达可通过FOXO3抑制NK/T细胞淋巴瘤细胞SNK-6增殖[14]。Li等[15]发现miR-23a/b可通过直接靶向Fas提高小鼠胸腺淋巴瘤细胞增殖。有数据显示抑制鼻咽癌细胞miR-214表达可通过Bax降低细胞增殖[16]。据报道在卵巢癌中miR-214可通过直接靶向PTEN促进细胞增殖[17]。本文结果显示,在Jurkat细胞中miR-214负向调控AIFM2表达,而且miR-214与AIFM2存在直接靶向关系。抑制Jurkat细胞miR-214可通过AIFM2降低细胞增殖。
各类癌症中常常会出现细胞凋亡的异常,许多microRNAs具有调控细胞凋亡的作用。有研究发现抑制miR-155可通过SOCS3促进淋巴瘤OCI-LY10细胞凋亡[18]。据报道miR-467a可直接靶向FAS和Bax抑制小鼠胸腺淋巴瘤细胞凋亡[19]。Wang等[20]发现在乳腺癌细胞中miR-214可通过直接靶向PTEN降低细胞凋亡,发挥致癌作用。有研究表明在口腔癌细胞中抑制miR-214可通过靶向RASSF5 促进细胞凋亡[21]。类似地,本研究结果显示,抑制Jurkat细胞miR-214可通过AIFM2提高细胞凋亡。
越来越多的研究表明microRNAs在调节细胞侵袭方面具有重要作用。据报道,抑制弥漫性大B细胞淋巴瘤细胞miR-21表达可通过PDCD4 和PTEN导致细胞侵袭的降低[22]。有数据显示miR-214可通过直接下调LZTS1表达提高骨肉瘤细胞侵袭[23]。Yang等[24]发现在胃癌细胞中转染miR-214 inhibitor会降低细胞侵袭,但下调PTEN会减轻miR-214 inhibitor对侵袭的抑制作用。有研究表明miR-214可通过靶向P53促进乳腺癌细胞侵袭[25]。与前人结果类似,本文结果显示,抑制Jurkat细胞miR-214可通过AIFM2降低细胞侵袭。
研究表明miR-214在不同的癌症中可能具有不同的功能。miR-214在口腔癌、胃癌及骨肉瘤等癌症中发挥致癌基因的作用[21-24]。但有研究表明miR-214在宫颈癌中通过ARL2发挥着抑癌基因的作用[26]。这可能与miR-214的靶基因有关。据报道miR-214可通过AIFM2调控T-LBL细胞SUP-T1增殖和凋亡,而对T-LBL细胞侵袭的影响还未见报道[27]。本研究表明,在Jurkat细胞中,miR-214靶向AIFM2不仅可以调节细胞增殖和凋亡,还可以调控细胞侵袭。下一步计划运用动物模型研究miR-214在T细胞淋巴母细胞性淋巴瘤中的作用。