RNA干扰UBQLN1基因表达对乳腺癌细胞增殖、凋亡、侵袭的影响及机制研究
2018-10-12胡潺潺李青山刘兰芳梁云微朱翠敏张晶晶李爱科
胡潺潺 李青山 刘兰芳 梁云微 朱翠敏 张晶晶 李爱科 王 锐
(承德医学院附属医院肿瘤科,承德067000)
乳腺癌是女性常见的恶性肿瘤之一,近些年的发病率及死亡率呈上升趋势,对女性的生命健康造成严重的威胁[1]。乳腺癌的发生发展、转移是由多基因、多阶段参与的一个复杂过程,具体作用机制目前尚未清楚。随着基因及免疫学技术的不断发展,基因治疗肿瘤有了很大的进步,且有大量研究表明在乳腺癌等多种肿瘤中抑癌基因失活、癌基因的激活影响其发生发展[2,3],因此,研究乳腺癌发生发展的分子机制具有重要意义。泛素1(Ubiquitin 1,UBQLN1)是一个高度保守的泛素样蛋白质,在人体的不同组织均有表达,与蛋白质酶体介导的多种蛋白质降解有关,近些年的研究显示,UBQLN1可通过参与细胞凋亡、受体转运、自噬等多种机制影响肿瘤的侵袭、迁移等过程[4,5]。UBQLN1在乳腺癌中的研究较少,有研究发现,乳腺癌中UBQLN1相对高表达,与TNM分期、肿瘤大小、淋巴结转移、肿瘤远处转移、ki67、p53等呈现正相关,且与患者预后不良有密切关系,可能作为预测乳腺癌患者预后的指标[6]。UBQLN1对乳腺癌生物学特性影响还未清楚。有研究显示,沉默UBQLN1在乳腺癌细胞的表达可增强辐射敏感性,miR-200c可通过靶向抑制UBQLN1增加乳腺癌的辐射敏感性[7]。因此,本研究中首先检测了不同乳腺癌细胞中UBQLN1的表达,通过RNA干扰抑制其表达,检测细胞的增殖、凋亡和侵袭,并进一步研究引起生物特性变化的机制。
1 材料与方法
1.1试剂和仪器 胎牛血清、胰蛋白酶、RPMI1640培养基均购自美国Gibco;LipofectamineTM2000购自美国Invitrogen公司;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙锭(PI)细胞凋亡试剂盒购自南京凯基生物科技公司;CCK8试剂和二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒购自南京碧云天生物试剂研究所;Transwell小室购自美国Corning公司;UBQLN1、 p53、Survivin、基质金属蛋白酶2(Matrix metalloproteinase 2,MMP-2)、基质金属蛋白酶9(Matrix metalloproteinase 9,MMP-9)、STAT3、磷酸化的信号转导与转录因子3(Phosphorylated signal transducers and activators of transcription 3,p-STAT3)抗体购自美国Cell signal公司;流式细胞仪购自美国BD公司。
1.2方法
1.2.1细胞及其培养 正常乳腺上皮细胞MCF-10A和乳腺癌MCF7、MDA-MB-231、T47D、BT549细胞均购自美国ATCC细胞库;细胞在含血清的RPMI1640培养液中,5%CO2、37℃饱和湿度培养箱中进行常规培养。
1.2.2Western blot检测乳腺癌细胞UBQLN1的蛋白表达 在生长至对数期的MCF-10A、MCF7、MDA-MB-231、T47D、BT549细胞中加入适量的RIPA裂解液提取细胞总蛋白,BCA试剂盒对蛋白定量,按照40 μg/孔的蛋白量行SDS-PAGE,蛋白分离后转至NC膜,室温明胶封闭1 h,4℃孵育一抗过夜,其中UBQLN1抗体和内参GAPDH抗体分别按照1∶500和1∶1 000稀释,洗膜,室温孵育二抗(1∶10 000稀释的HRP标记的羊抗兔IgG)1 h,洗膜,显色液中显色。
1.2.3转染 MDA-MB-231细胞于37℃,5%CO2培养箱中培养,细胞达80%~90%的生长密度时,用LipofectamineTM2000将干扰UBQLN1表达的siRNA(UBQLN1-siRNA)转染细胞,同时转染阴性对照组(NC组),细胞中仅加入脂质体的为空白对照组,48 h后通过Western blot检测各组细胞UBQLN1的蛋白表达。
1.2.4CCK8法检测抑制UBQLN1表达对MDA-MB-231细胞活力的影响 以1×105ml-1浓度接种生长至对数期的MDA-MB-231细胞于96孔板,每孔100 μl,常规培养24 h后进行同步化处理,参照1.2.3方法将UBQLN1-siRNA和阴性对照组转染细胞,并设置空白对照组,每组设置5个平行孔,分别于转染的24、48、72 h收集细胞,每孔细胞中加入无血清的培养液,再加入10 μl的CCK8试剂,培养2 h后,酶标仪测定450 nm波长的吸光度值(A值)。实验重复3次。
1.2.5流式细胞仪检测抑制UBQLN1表达对MDA-MB-231细胞凋亡的影响 细胞凋亡率检测使用Annexin V-FITC和PI进行荧光染色,通过流式细胞仪检测。取转染48 h的细胞,预冷的PBS洗涤细胞,胰酶消化后将细胞密度调整为1×106ml-1,结合缓冲液洗涤及重悬细胞,加入FITC标记的Annexin V和PI各5 μl,室温避光环境孵育5~15 min,流式细胞仪检测凋亡率,实验重复3次。
1.2.6Transwell小室检测抑制UBQLN1表达对MDA-MB-231细胞侵袭的影响 在Transwell小室的外膜上涂纤维黏连蛋白50 μl,枪头摊平,风干后在内膜中铺Matrigel(按照1∶3稀释),37℃条件过夜后将转染48 h的细胞制成单细胞悬液,以1.5×106ml-1密度接种于上室中,接种200 μl,Transwell小室的下室中加入600 μl含血清的培养液,培养12 h,棉签轻轻擦去上室中的细胞,甲醇固定,洗涤后结晶紫进行30 min的染色,拍照,计数。
1.2.7p53、Survivin、MMP-2、MMP-9、STAT3、p-STAT3蛋白表达检测 提取转染48 h的各组细胞总蛋白,蛋白定量后,依次经SDS-PAGE,转膜、封闭,加稀释好的 p53、Survivin、MMP-2、MMP-9、STAT3和p-STAT3抗体(稀释比1∶1 000),洗膜,孵育二抗,通过显色液显色。
2 结果
2.1UBQLN1在乳腺癌细胞的表达 UBQLN1在乳腺癌T47D、BT549、MDA-MB-231、MCF7细胞的表达结果如图1所示,正常乳腺上皮细胞MCF-10A与乳腺癌T47D、BT549、MDA-MB-231、MCF7细胞UBQLN1的蛋白表达分别为0.088±0.010、0.162±0.018、0.178±0.019、0.389±0.045、0.297±0.034,正常乳腺上皮细胞MCF-10A与乳腺癌T47D、BT549、MDA-MB-231、MCF7细胞UBQLN1的蛋白表达比较,差异具有统计学意义(F=53.898,P=0.000)。与MCF-10A细胞比较,UBQLN1在四种乳腺癌细胞中的表达均显著升高(P<0.01)。选择MDA-MB-231细胞为研究对象。
2.2转染UBQLN1-siRNA的MDA-MB-231细胞UBQLN1的表达 收集转染UBQLN1-siRNA 48 h的细胞,通过Western blot检测转染后的细胞中UBQLN1的蛋白表达,结果如图2所示,Control 组、NC组和UBQLN1-siRNA组UBQLN1的蛋白表达分别为0.526±0.058、0.507±0.052、0.153±0.018,三组UBQLN1的蛋白表达比较,差异具有统计学意义(F=62.142,P=0.000)。UBQLN1-siRNA组UBQLN1的表达显著低于对照组(P<0.01),NC组UBQLN1的表达与对照组差异无统计学意义(P>0.05)。
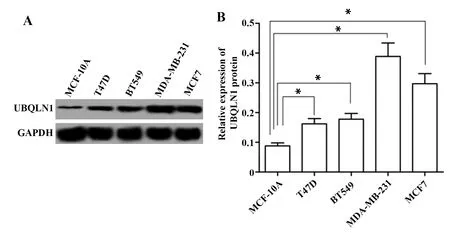
图1 UBQLN1在乳腺癌细胞的表达Fig.1 Expression of UBQLN1 in breast cancer cellsNote: A.Western blot was used to detect the protein expression of UBQLN1 in breast cancer cells;B.The relative expression of UBQLN1 protein;compared with MCF-10A cells,*.P<0.01.
2.3UBQLN1-siRNA转染降低MDA-MB-231细胞活力 通过CCK8法检测转染UBQLN1-siRNA后的MDA-MB-231细胞活力,结果如表1所示,与NC组比较,UBQLN1-siRNA组细胞在转染24、48和72 h的细胞活力均显著降低(P<0.05)。
2.4UBQLN1-siRNA转染诱导MDA-MB-231细胞凋亡 流式细胞仪检测UBQLN1-siRNA转染MDA-MB-231细胞48 h的细胞凋亡率,Western blot检测促凋亡蛋白p53及抑凋亡蛋白Survivin的蛋白表达,结果如图3和表2所示, 与NC组比较,UBQLN1-siRNA组细胞凋亡率显著升高(P<0.01),p53蛋白表达显著升高(P<0.01),Survivin蛋白表达显著降低(P<0.01)。

图2 转染UBQLN1-siRNA的MDA-MB-231细胞UBQLN1的表达Fig.2 Expression of UBQLN1 in MDA-MB-231 cells transfected with UBQLN1-siRNANote: A.Western blot was used to detect the protein expression of UBQLN1 in breast cancer cells;B.The relative expression of UBQLN1 protein;compared with Control group,*.P<0.05.
表1UBQLN1-siRNA转染对MDA-MB-231细胞活力的影响
Tab.1EffectofUBQLN1-siRNAtransfectiononactivityofMDA-MB-231cells
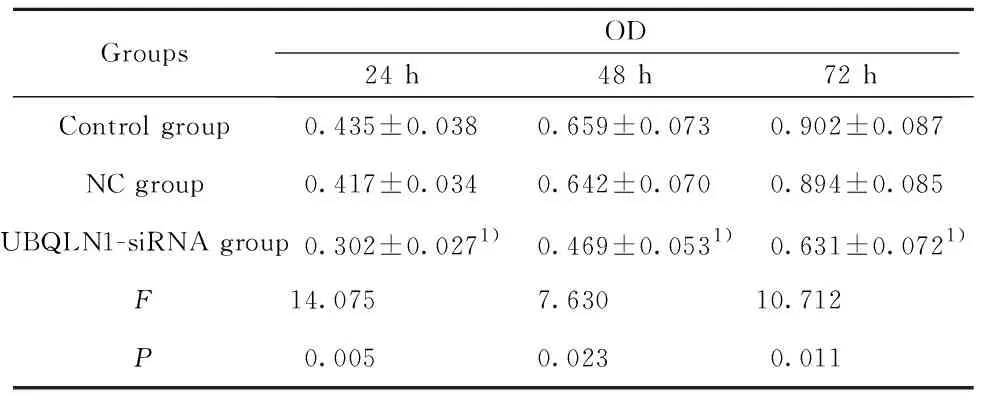
GroupsOD24 h48 h72 hControl group0.435±0.0380.659±0.0730.902±0.087NC group0.417±0.0340.642±0.0700.894±0.085UBQLN1-siRNA group0.302±0.0271)0.469±0.0531)0.631±0.0721)F14.0757.63010.712P0.0050.0230.011
Note:Compared with NC group,1)P<0.05.
2.5UBQLN1-siRNA转染抑制MDA-MB-231细胞侵袭能力 Transwell小室检测各组细胞的侵袭能力,Western blot检测侵袭相关蛋白MMP-2和MMP-9的蛋白表达,结果如图4和表3所示,与NC组比较,UBQLN1-siRNA组细胞的侵袭能力显著降低(P<0.01),MMP-2和MMP-9的蛋白表达均显著降低(P<0.01)。
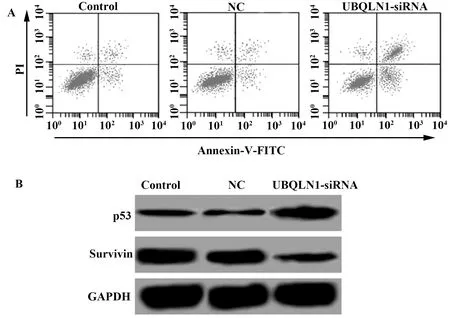
图3 UBQLN1-siRNA转染对MDA-MB-231细胞凋亡的影响Fig.3 Effect of UBQLN1-siRNA transfection on apoptosis of MDA-MB-231 cellsNote: A.Results of flow cytometry;B.Results of Western blot.
表2UBQLN1-siRNA转染对MDA-MB-231细胞凋亡的影响
Tab.2EffectofUBQLN1-siRNAtransfectiononapoptosisofMDA-MB-231cells
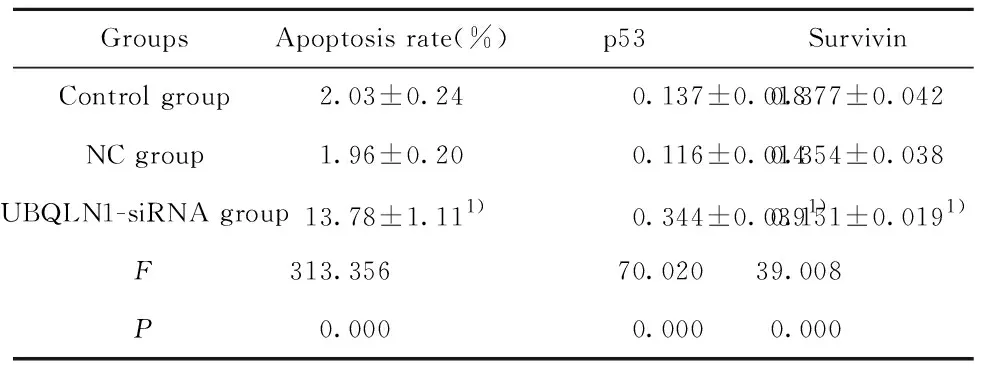
GroupsApoptosis rate(%)p53SurvivinControl group2.03±0.240.137±0.0180.377±0.042NC group1.96±0.200.116±0.0140.354±0.038UBQLN1-siRNA group13.78±1.111)0.344±0.0391)0.151±0.0191)F313.35670.02039.008P0.0000.0000.000
Note:Compared with NC group,1)P<0.01.
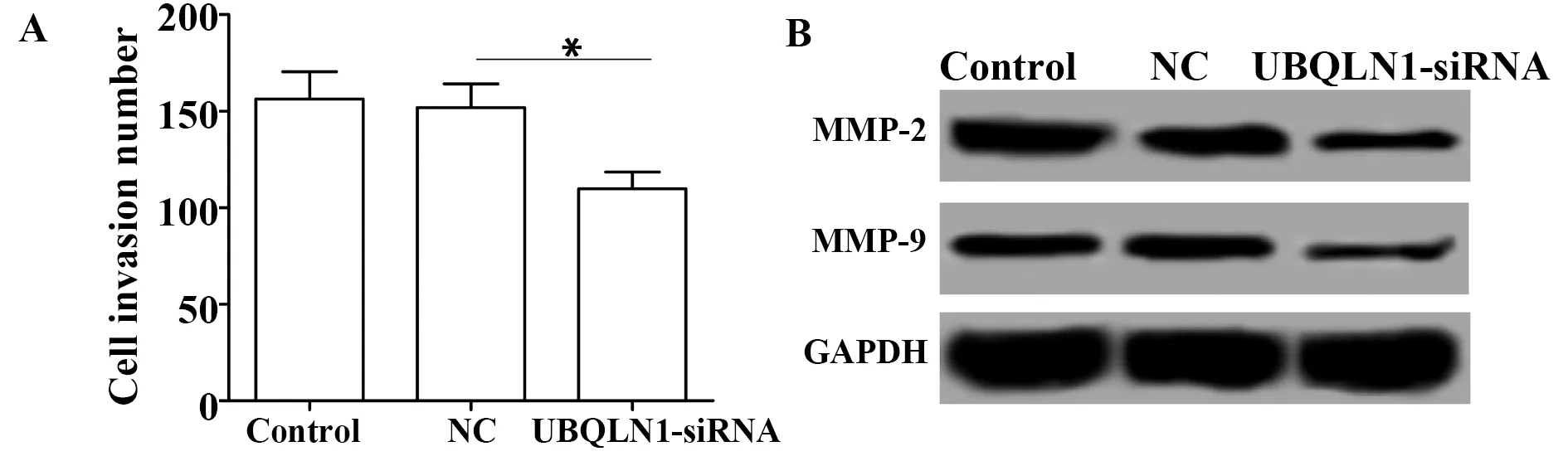
图4 UBQLN1-siRNA转染对MDA-MB-231细胞侵袭的影响Fig.4 Effect of UBQLN1-siRNA transfection on invasion of MDA-MB-231 cellsNote: A.Transwell were used to detect cell invasiveness;B.Western blot was used to detect the protein expression of MMP-2 and MMP-9.
2.6UBQLN1-siRNA转染下调MDA-MB-231细胞STAT3信号通路 通过Western blot检测各组细胞中STAT3和p-STAT3的蛋白表达,结果如图5和表4所示,与NC组比较,UBQLN1-siRNA组p-STAT3的蛋白表达显著降低(P<0.01),三组间STAT3的蛋白表达差异无统计学意义(P>0.05)。
表3UBQLN1-siRNA转染对MDA-MB-231细胞侵袭的影响
Tab.3EffectofUBQLN1-siRNAtransfectiononinvasionofMDA-MB-231cells
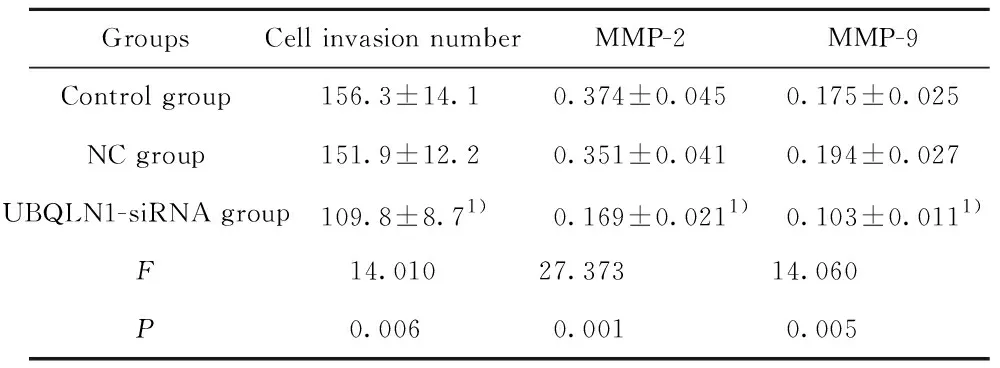
GroupsCell invasion numberMMP-2MMP-9Control group 156.3±14.10.374±0.0450.175±0.025NC group 151.9±12.20.351±0.0410.194±0.027UBQLN1-siRNA group 109.8±8.71)0.169±0.0211)0.103±0.0111)F 14.01027.37314.060P 0.0060.0010.005
Note:Compared with NC group,1)P<0.01.
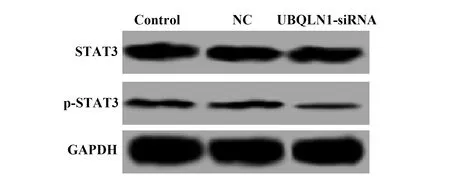
图5 UBQLN1-siRNA转染对MDA-MB-231细胞STAT3信号通路的影响Fig.5 Effect of UBQLN1-siRNA transfection on STAT3 signaling pathway in MDA-MB-231 cells
表4UBQLN1-siRNA转染对MDA-MB-231细胞STAT3信号通路的影响
Tab.4EffectofUBQLN1-siRNAtransfectiononSTAT3signalingpathwayinMDA-MB-231cells
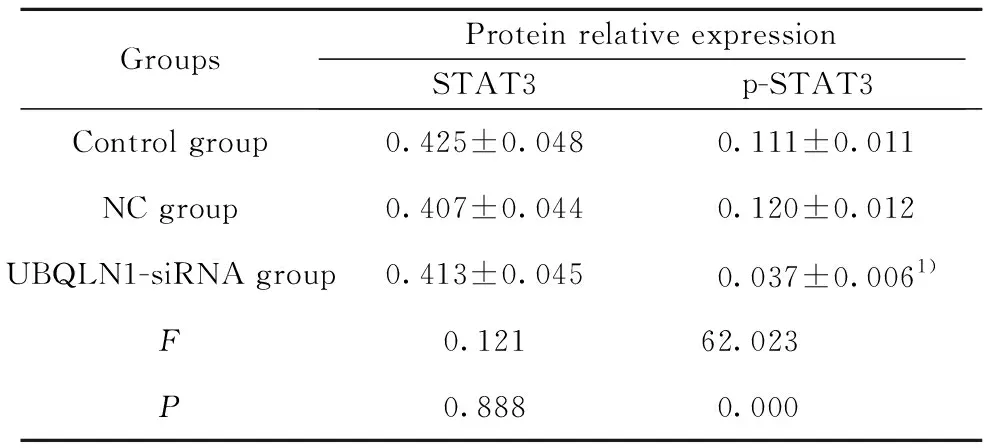
GroupsProtein relative expressionSTAT3p-STAT3Control group0.425±0.0480.111±0.011NC group0.407±0.0440.120±0.012UBQLN1-siRNA group0.413±0.0450.037±0.0061)F0.12162.023P0.8880.000
Note:Compared with NC group,1)P<0.01.
3 讨论
乳腺癌的治疗有手术、放化疗、分子靶向治疗和内分泌治疗,目前分子靶向治疗成为研究热点,有研究显示,UBQLN1可能是一项用于预测乳腺癌患者预后的指标[6,9]。UBQLN1定位于人类9q22,是泛素样蛋白家族中的一员,在组织中表达广泛,其功能与传递蛋白类似,可将多泛素化目标提供给特定的蛋白,从而降解蛋白酶体[10]。UBQLN1在肿瘤中的作用研究尚不多,有研究发现,肺癌中UBQLN1的表达升高会降低生存期[11];肺腺癌中UBQLN1的高表达可诱导癌细胞的侵袭、迁移和上皮间质化[12];UBQLN1的高表达增强卵巢癌顺铂耐药性[13]。UBQLN1在乳腺癌中的作用罕见报道,直到2015年Sun等[7]研究发现沉默UBQLN1在乳腺癌细胞的表达可增强辐射敏感性,miR-200c可通过靶向抑制UBQLN1增加乳腺癌的辐射敏感性。这提示UBQLN1可能影响乳腺癌的发生发展。本研究试图证实UBQLN1对乳腺癌增殖、凋亡、侵袭的影响。
RNA干扰可在转录水平、染色质水平和翻译水平参与调节基因表达,有强的序列特异性和有效性,目前已在基因治疗肿瘤中广泛应用,且与基因治疗肿瘤的其他方法比较效果更优[14,15]。为了研究UBQLN1对乳腺癌的影响,通过RNA干扰技术沉默乳腺癌细胞中UBQLN1的表达,分别检测其对细胞增殖、凋亡、侵袭的影响,发现UBQLN1的表达受到抑制后乳腺癌细胞的活力及侵袭能力均明显降低,且凋亡率增加。这提示UBQLN1可能在乳腺癌中充当癌基因样作用。STATs是有高度同源性的一族转录因子,可调控细胞的功能,影响靶基因转录,与肿瘤的凋亡及发生发展有密切关系,STAT3是STATs家族中的一个重要成员,目前已证实其在乳腺癌、肺癌、头鳞癌等多种肿瘤中有过度表达及激活,异常激活的STAT3可通过影响下游分子p53、Survivin、MMP-2和MMP-9等促进肿瘤的发生发展,因此目前将STAT3定义为癌基因[16-18]。p53是一种肿瘤抑制物,具有诱导细胞凋亡及调节细胞周期的作用,目前在多种肿瘤中均有研究,乳腺癌中p53的活化可抑制癌细胞增殖和促进凋亡[19,20]。Survivin属于人类凋亡抑制蛋白家族(IAPs)的一个成员,在包括乳腺癌在内的多种人类肿瘤中高表达,影响细胞凋亡、周期等功能,在乳腺癌等多种肿瘤中抑制Survivin的表达可增加化疗药物敏感性及促进细胞的凋亡[21-23]。MMP-2和MMP-9为MMPs家族的重要成员,在多种肿瘤中表达升高,可通过裂解细胞外基质及基底膜促进肿瘤转移、脉管生成、转移等[24,25]。乳腺癌中MMP-2和MMP-9的高表达与其转移进展有密切关系,也有研究发现抑制MMP-2和MMP-9的表达可降低乳腺癌细胞的侵袭和迁移能力[26,27]。本研究发现,抑制UBQLN1的表达可下调磷酸化的STAT3、Survivin、MMP-2和MMP-9的表达,上调p53的表达。这提示UBQLN1可通过下调STAT3信号影响乳腺癌细胞的增殖、凋亡及侵袭能力。
综上所述,抑制乳腺癌细胞中UBQLN1基因表达可降低乳腺癌细胞活力和侵袭能力,并诱导细胞凋亡和下调STAT3信号通路。其中诱导凋亡的方式是下调Survivin和上调p53的表达,对侵袭的影响是下调MMP-2和MMP-9的表达。本研究为UBQLN1在乳腺癌中的作用研究奠定了一定的基础,由于UBQLN1在乳腺癌中的研究较少,值得进一步深入挖掘。