黄芪升麻柴胡治疗实验性自身免疫性重症肌无力大鼠的量效关系及免疫学机制研究①
2018-10-12何骁隽吴颢昕吴周烨许梦贤许骏尧陶伟伟
何骁隽 吴颢昕 吴周烨 许梦贤 许骏尧 陈 刚 陶伟伟
(南京中医药大学基础医学院,南京210023)
重症肌无力(Myasthenia gravis,MG)是乙酰胆碱受体抗体(Acetylcholinergic receptor antibody,AchR-Ab)介导的、细胞免疫依赖的和补体参与的神经-肌肉接头(Neuromuscularjunction,NMJ)处传递障碍的自身免疫性疾病,病变主要累及NMJ突触后膜上乙酰胆碱受体(Acetylcholinergic receptor,AChR),是一种比较常见的神经肌肉疾病。其机制为多重因素参与刺激AchR产生的AchR-Ab,与AchR结合并使其内吞或降解,阻断AchR与乙酰胆碱结合,激活补体形成膜攻击复合物,破坏NMJ突触后膜,导致神经系统兴奋性递质传递障碍[1]。
MG现代医学目前尚无特效治疗药物。临床药物长期使用常可伴随一系列不良反应[2,3]。中医药凭借其独特的理论体系,以“益气升提”为基本治法,从整体出发,辨证论治,给予患者个性化的治疗,在减小毒药物的副作用,改善患者的生活质量方面具有很好的效果。已有的临床实验证明,以补中益气汤与升陷汤为代表,益气升提法对MG有确切的治疗效果。黄芪、柴胡、升麻是补中益气汤与升陷汤的共同组成部分,也是益气升提法的代表。一项对30年间中医药治疗MG文献的研究表明,黄芪使用频率最高,升麻柴胡分别排在使用频率的第五和第六位[4]。可以认为黄芪、升麻、柴胡是益气升提法治疗MG的代表结构。然而临床应用黄芪与柴胡、升麻配伍治疗MG时,升麻与柴胡二药用量相对固定,但黄芪用量变化较大,从30~150 g不等。黄芪与升麻柴胡配伍治疗的最佳剂量以及其免疫机制一直是有待进一步研究的内容。
在前期研究中,本课题组已经验证“益气升提法”的代表方剂升陷汤对治疗重症肌无力确有其效[5,6],在将升陷汤按治则治法拆方研究后,发现其中益气升提组(黄芪、升麻、柴胡)对MG疗效最为显著[7]。现为进一步探究,本实验将不同剂量黄芪与柴胡升麻配伍治疗EAMG,以重症肌无力综合评分评价其治疗效果,探究其量效关系及相关的免疫机制。
1 材料与方法
1.1实验材料、试剂
1.1.1动物 SPF级雌性Lewis大鼠50只,体质量140~160 g,6~8周龄,购于上海西普尔-必凯实验动物有限公司,许可证号:SCXK(沪)2013-0016。饲养于南京中医药大学中医脑病SPF级动物实验室,选用标准无菌饲料喂养,动物实验室昼夜各12 h,通风与消毒条件正常。
1.1.2药物 药物购于南京中医药大学国医堂,药材品质由南京中医药大学基础医学院脑病实验室陶伟伟进行鉴定。
1.1.3试剂 鼠源AchR-α亚基97-116肽(Rα97-116):DGDFAIVKFTKVLLDYTGHI,由苏州强耀生物科技有限公司合成。完全弗氏佐剂(Complete freund′s adjuvant,CFA)、不完全弗氏佐剂(Incompl-ete freund′s adjuvant,IFA):美国Sigma公司。H37Ra干粉:美国Difco Bacto公司。Fixation/Permeabilization Kit、FITC-anti rat CD4、FITC anti rat CD25:美国BD公司。Antimouse/rat Foxp3 PE:美国eBioscience公司。大鼠AChR-Ab、转化生长因子β(Transforming growth factor-β,TGF-β)、干扰素γ(Interferon-γ,IFN-γ)、IL-6、IL-17 ELISA试剂盒:南京金益柏生物科技有限公司。
1.2方法
1.2.1实验动物模型建立 本实验参考Na等和Baggi等[8]方法建立EAMG模型,通过人工合成AChR多肽,构建EAMG模型[9]。第1天将与完全弗氏佐剂(CFA)充分混匀的200 μl乳剂(含Rα97-116 50 μg、H37Ra干粉1 mg),多点皮下注射于造模大鼠肩背部、尾基部、足垫部;佐剂对照组注射等量PBS与CFA混匀的乳剂。第30、45天,将与不完全弗氏佐剂(IFA)充分混匀的乳剂200 μl(含Rα97-116 50 μg),在相同部位注射强化免疫;佐剂对照组注射等量PBS与IFA混匀的乳剂。第60天为造模结束。
1.2.2实验动物模型及治疗效果评估 为了精细客观地比较各给药组的治疗效果与造模情况,本研究将Lenon评分中各项内容具体量化,对EAMG大鼠按抓力、体质量、低频重复神经电刺激(Repetitive nerve stimulation,RNS)衰减率、血清AchR-Ab含量,进行MG综合评分。
模型评估:对体质量、抓力、血清AchR-Ab含量分别评分,再汇总进行综合评分。总分70分,各指标:抓力20分,体质量20分,AchR-Ab 30分;各项指标的具体评分,按其与佐剂对照组对应指标相关性程度打分,P<0.05为60%,P<0.01为80%,P<0.001为100%,无相关性或阴性结果计为0分。综合评分超过42分被认为EAMG造模成功大鼠。模型评估综合评分里不包括肌电图的检测,因检测肌电图须进行麻醉,EAMG大鼠受麻醉易致死。
治疗效果评估:对抓力、体质量、肌电图、血清AchR-Ab含量分别评分,再汇总进行综合评分。总分100分,各指标:抓力20分,体质量20分,肌电图30分,血清AchR-Ab滴度30分,其中肌电图3、5、10 Hz各占10分。各项指标具体评分,按其与模型对照组对应指标相关性程度打分,P<0.05为60%,P<0.01为80%,P<0.001为100%,无相关性或为阴性结果计为0分。
例如,给药后低剂量组抓力与模型对照组抓力相比显著上升(P<0.01),则低剂量组抓力治疗效果评分为20×80%=16分。
1.2.3分组及给药 造模之前随机选出10只大鼠作为佐剂对照组,其余造模,末次免疫后2周对造模大鼠评估,将造模大鼠随机分为模型对照组,益气升提黄芪低剂量组(以下简称“低剂量组”),益气升提黄芪中剂量组(以下简称“中剂量组”),益气升提黄芪高剂量组(以下简称“高剂量组”),每组10只。各中药组药物剂量如下——低剂量组:黄芪20 g,柴胡10 g,升麻10 g,中剂量组:黄芪40 g,柴胡10 g,升麻10 g,高剂量组:黄芪80 g,柴胡10 g,升麻10 g。实际给药剂量根据人体体质量折算,相当于成人等效剂量的8倍。
1.2.4检测指标及方法
1.2.4.1体质量 实验期间每10 d记录体质量。
1.2.4.2抓力 实验期间每隔10 d测抓力3次,取最大值。
1.2.4.3低频重复神经电刺激(Repetitive nerve stimulation,RNS)衰减率(D) 参照许文华等[10]方法进行,10%水合氯醛按30 mg/kg腹腔注射麻醉大鼠后固定,选用BL-420S生物机能系统进行检测,取4根针灸针作为电极,将刺激电极置于坐骨神经附近肌肉内,参考电极置于腹部皮下,记录电极1、2分别插入同侧腓肠肌内侧头、跟腱附着处,分别以3、5、10 Hz频率连续10次电刺激。计算RNS衰减率(D),D(%)=(动作电位1-动作电位5)/动作电位1×100%。
1.2.4.4ELISA检测大鼠外周血AChR-Ab、IL-6、IL-17、TGF-β、IFN-γ水平 第3次免疫15 d后尾静脉取血,静置30 min,3 000 r/min、4℃离心15 min,提取血清,-20℃保存,检验AchR-Ab水平。给药结束后经颈动脉取血,血清提取方法同前,严格按照试剂盒说明检测。
1.2.4.5流式细胞术(FCM)测定大鼠外周血淋巴细胞CD4+CD25+FoxP3+Treg比例 给药结束后,大鼠眼眶取血2 ml,50 μl EDTA(1.5%)抗凝,等体积PBS稀释获得稀释全血,加入0.9%氯化钠溶液和大鼠淋巴细胞分离液,800 g离心30 min,PBS清洗3次,获得外周血淋巴细胞,严格按照CD4-APC、CD25-FITC、FoxP3-PE抗体说明检测。
2 结果
2.1给药前后大鼠体质量变化 见图1、表1。各组大鼠在实验开始第1天,体质量无显著性差异。造模后,各模型组大鼠与佐剂对照组相比,体质量均显著下降(P<0.001)。给药后,与模型对照组相比较,低中高剂量组大鼠体质量均显著上升(P<0.01,P<0.001)。
2.2给药前后大鼠抓力变化 见图2、表2。造模后(第3次免疫后15 d,即60 d),各组大鼠抓力与佐剂对照组相比,均显著下降(P<0.001)。给药后,与给药前相比较,低中高剂量组大鼠抓力均显著上升(P<0.001);与模型对照组相比较,低剂量组与高剂量组抓力显著上升(P<0.01,P<0.05)。
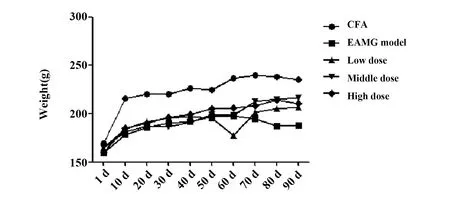
图1 大鼠体质量变化(n=10)Fig.1 Weight of rats(n=10)
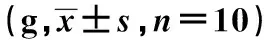
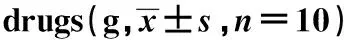
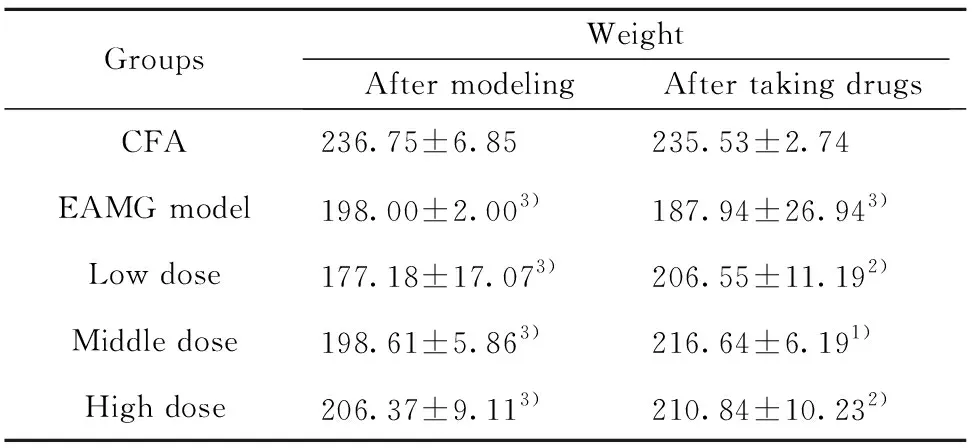
GroupsWeightAfter modelingAfter taking drugsCFA 236.75±6.85235.53±2.74EAMG model198.00±2.003)187.94±26.943)Low dose177.18±17.073)206.55±11.192)Middle dose198.61±5.863)216.64±6.191)High dose206.37±9.113)210.84±10.232)
Note:Compared with EAMG model,1)P<0.01,2)P<0.001;compared with CFA,3)P<0.001.
2.3给药后大鼠RNS衰减率变化 见图3。给药后,在不同条件电刺激下,模型对照组大鼠RNS衰减率均为最高,与佐剂对照组相比有显著性差异(P<0.01,P<0.001)。与模型对照组相比,在3 Hz与5 Hz刺激下,低中高剂量组RNS衰减率均显著下降(P<0.01,P<0.001);在10 Hz刺激下,低剂量组和高剂量组RNS衰减率显著下降(P<0.05,P<0.01)。
2.4给药前后大鼠血清AChR-Ab含量 见表3。
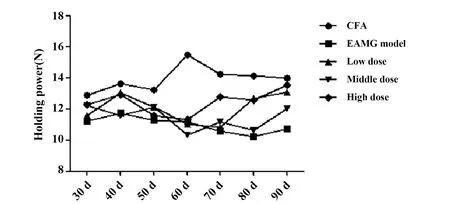
图2 大鼠抓力变化(n=10)Fig.2 Holding power of rats(n=10)
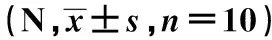
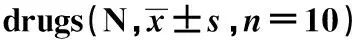

GroupsHolding powerAfter modelingAfter taking drugsCFA 15.49±1.1713.96±0.79EAMG model11.18±0.813)10.72±1.563)Low dose11.05±0.023)13.07±0.912)4)Middle dose10.31±0.293)12.03±0.964)High dose11.34±0.503)13.52±1.071)4)
Note:Compared with EAMG model,1)P<0.01,2)P<0.001;compared with CFA,3)P<0.001;compared with after modeling,4)P<0.001.
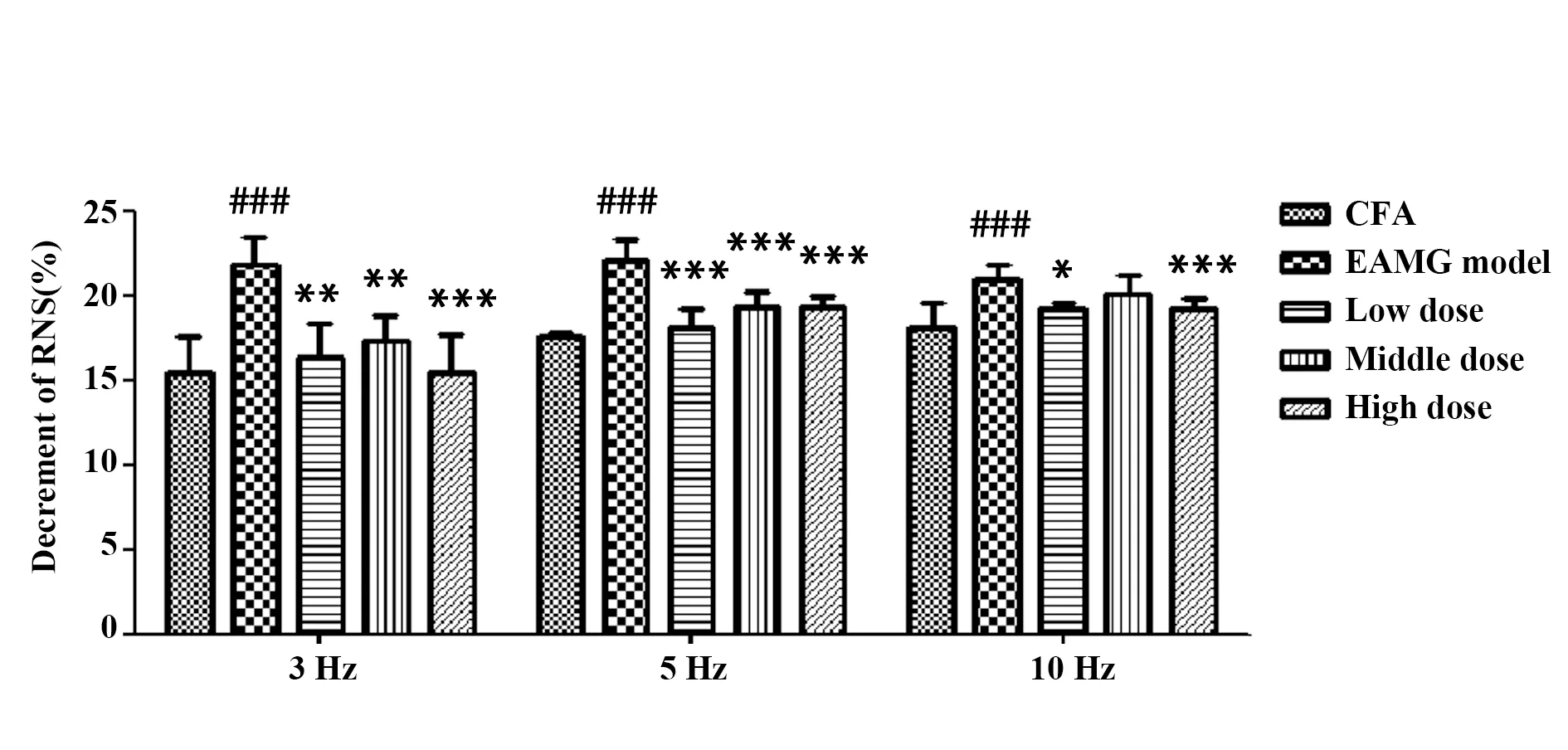
图3 给药后大鼠RNS衰减率变化(n=10)Fig.3 Decrement percentage of RNS after taking drugs (n=10)Note:Compared with EAMG model,*.P<0.05,**.P<0.01,***.P<0.001;compared with CFA,###.P<0.001.
造模后,除佐剂对照组外各组大鼠血清AChR-Ab含量均显著升高(P<0.05,P<0.01)。给药后,与模型对照组比较,低中高剂量组AChR-Ab含量均显著下降(P<0.05,P<0.01)。
2.5给药后大鼠血清TGF-β、IFN-γ、IL-6、IL-17含量 见表4。给药后,与模型对照组相比较,低中高剂量组大鼠血清TGF-β含量均显著升高(P<0.05,P<0.01),IFN-γ、IL-6含量均显著降低(P<0.001),低剂量组与高剂量组血清IL-17含量显著降低(P<0.05,P<0.01)。
2.6给药后大鼠外周血淋巴细胞CD4+CD25+FoxP3+Treg比例 见图4、表5。给药后,与佐剂对照组比较,模型对照组CD4+CD25+FoxP3+Treg比例显著降低(P<0.05);与模型对照组比较,高剂量组CD4+CD25+FoxP3+Treg比例显著升高(P<0.05)。
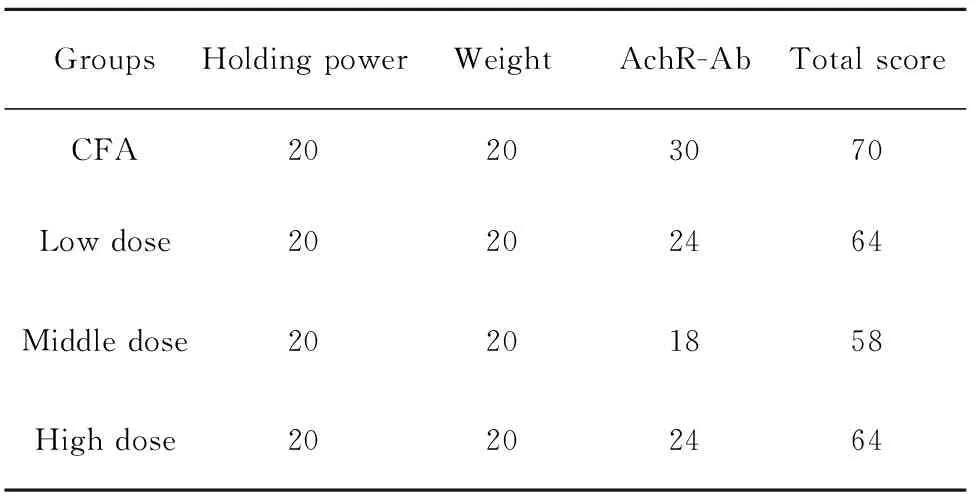
2.7EAMG大鼠模型综合评分 见表6。造模后,对各模型组大鼠EAMG表现进行综合评分,模型对照组70分,低剂量组70分,中剂量组58分,高剂量组64分,均符合EAMG模型评分要求。
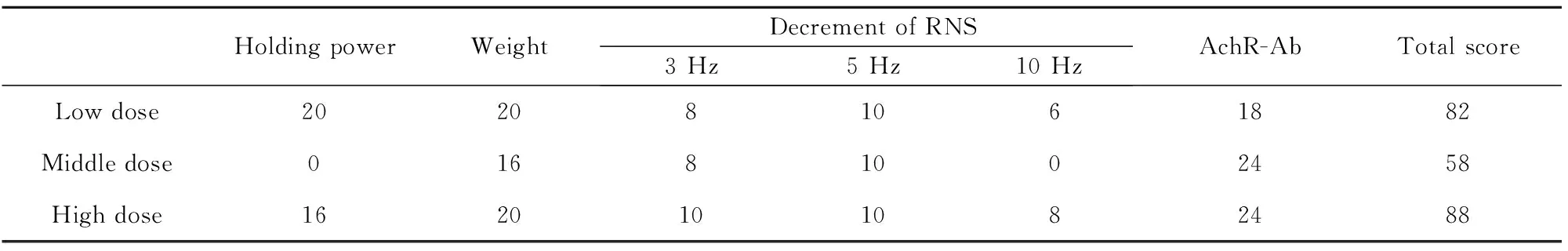
2.8各组治疗效果综合评分 见表7。给药后,对治疗效果进行综合评分,低剂量组82分,中剂量组58分,高剂量组88分。
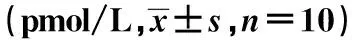
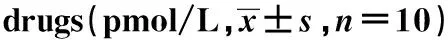
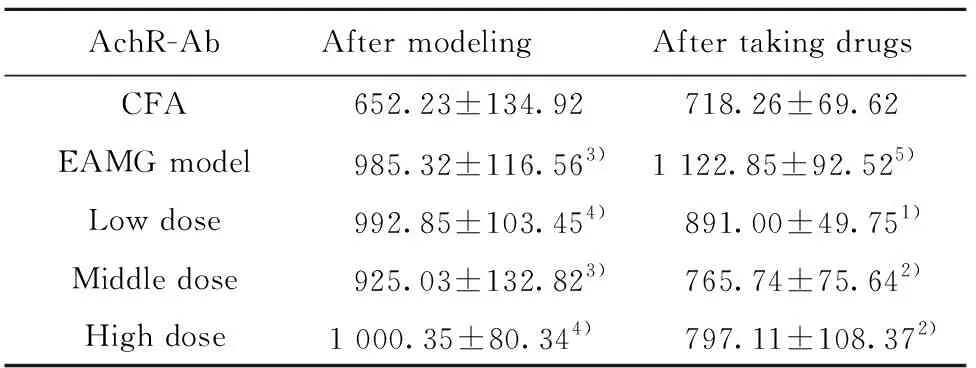
AchR-AbAfter modelingAfter taking drugsCFA 652.23±134.92 718.26±69.62 EAMG model 985.32±116.563)1 122.85±92.525)Low dose 992.85±103.454) 891.00±49.751)Middle dose 925.03±132.823) 765.74±75.642)High dose1 000.35±80.344) 797.11±108.372)
Note:Compared with EAMG model,1)P<0.05,2)P<0.01;compared with CFA,3)P<0.05,4)P<0.01,5)P<0.001.
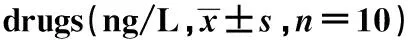

GroupsTGF-βIFN-γIL-6IL-17CFA 168.40±3.671099.08±19.24 65.02±1.48 51.65± 5.35EAMG model125.33±4.305)1 467.31±124.145)80.61±12.265)71.11±5.295)Low dose151.90±4.301)1 120.15±80.483)71.35±3.213)59.82±1.741)Middle dose156.12±7.242)1 106.19±103.013)73.35±4.542)73.39±4.16High dose142.44±7.261)1 162.28±57.003)73.78±1.672)4)61.86±4.992)
Note:Compared with EAMG model,1)P<0.05,2)P<0.01,3)P<0.001;compared with CFA,4)P<0.05,5)P<0.001.

图4 给药后大鼠外周血淋巴细胞CD4+CD25+ FoxP3+Treg比例Fig.4 Proportion of CD4+CD25+FoxP3+Treg in peripheral blood lymphocytes after taking drugsNote:A.CFA;B.EAMG model;C.Low dose;D.Middle dose;E.High dose.
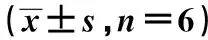
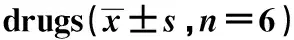

GroupsCD4+(%)CD25+FoxP3+(%)CD4+CD25+FoxP3+(%)CFA 47.06±8.141.28±0.120.60±0.04EAMG model50.66±5.170.60±0.113)0.31±0.082)Low dose47.53±3.451.11±0.151)0.53±0.11Middle dose49.67±8.770.98±0.010.50±0.14High dose58.00±11.080.96±0.160.62±0.111)
Note:compared with EAMG model,1)P<0.05;compared with CFA,2)P<0.01,3)P<0.001.
表6造模后各组大鼠EAMG模型评估综合评分
Tab.6EAMGcomprehensivescoreofratsafterestablishingtheEAMGmodel
GroupsHolding powerWeightAchR-AbTotal scoreCFA 20203070Low dose20202464Middle dose20201858High dose20202464
表7给药后各组治疗效果综合评分
Tab.7EAMGcomprehensivescoreofratsaftertakingdrugs
Holding powerWeightDecrement of RNS3 Hz5 Hz10 HzAchR-AbTotal scoreLow dose202081061882Middle dose01681002458High dose1620101082488
3 讨论
新近的免疫学理论认为 Th1、Th2、Th17 和Treg四种辅助性Th细胞亚群的平衡,在包括 MG 在内的自身免疫性疾病的发病机制中起到了重要的作用。在EAMG发病的早期时相,Th1、Th2、Th17 细胞的比例下降,Treg 细胞比例上升;在EAMG发病的高峰期和晚期时相,Th1和Th17细胞的比例显著上升,Th2和Treg细胞的比例显著下降[11]。细胞因子在这细胞亚群的分化方向上起着重要作用[12]。
IFN-γ是由Th1型淋巴细胞分泌的促炎性因子,在MG发病过程中可介导多种信号转导使T细胞迁移到炎性反应部位并放大炎性反应,导致促炎性因子的生产[13],还能够增加MHCⅡ类分子的表达、激活巨噬细胞,诱导B淋巴细胞成熟,促进AchR-Ab的产生、进而诱发EAMG[14,15]。本实验中给药后模型组血清TGF-β含量上升,中药组降低。
IL-6是B细胞终末分化并分泌抗体的必需因子,可以诱导T细胞的活化、增殖和分化,促进T细胞表达IL-2R和IL-2[16]。研究表明IL-6协同TGF-β可以诱导CD4+初始T细胞分化成Th17细胞,并能促进调节性T细胞的分化[17]。对EAMG小鼠给予抗IL-6抗体可以下调Th17相关基因IL-17、IL-17R、IL-23R和IL-21水平,降低小鼠AChR-Ab滴度和B细胞数量[18]。本实验中给药后模型组血清IL-6含量上升,中药组降低。TGF-β是由Th3型淋巴细胞分泌的内源性免疫抑制性细胞因子,是MG发病中的负调节因素[19],可以抑制乙酰胆碱特异性T细胞和B细胞增殖,并抑制IFN-γ的生成[20]。TGF-β表达与AchR-Ab含量变化呈负相关[21],其含量降低可导致FoxP3表达降低,增加AchR-Ab表达。本实验中给药后模型组血清TGF-β含量降低,中药组上升。
IL-17是由Th17型淋巴细胞分泌的促炎性细胞因子,可作用于自身抗原,增强自身免疫应答引起自身免疫反应,在介导EAMG中有重要作用[22]。有研究利用基因敲除法证实IL-17参与了EAMG的发病过程[23]。EAMG病程中B细胞介导的自身免疫、抗AchR抗体的产生依赖于CD4+IL-17的表达[24]。本实验中给药后模型组血清IL-17含量上升,中药组降低。
调节性T细胞(regulatory cells,Treg)主要产生于胸腺,是一种功能成熟的T细胞亚群,具有抑制效应性T细胞增殖活化,降低促炎性因子水平的功能。Treg细胞的比值下降与EAMG的发病有着密切关系[15],其最重要的表型标记是CD4+CD25+FoxP3+,FoxP3+是Treg的特异性转录因子[25,26]。AchR-Ab水平和FoxP3表达呈负相关[27]。FoxP3水平可以被TGF-β上调,与RORγt基因配合,减少IL-17产生和表达[15]。本实验中给药后模型组血清Treg含量上升,中药组降低。
中医历代文献中并无“重症肌无力”病名的记载。根据其眼睑下垂、四肢无力、吞咽无力等特征表现,重症肌无力被归属于《内经》所说的“痿证”范畴。《内经》提出“治痿独取阳明”的治疗观点,认为本病之责在于脾,脾气虚衰,则肌肉无力,四肢不用。治当益气健脾,升中举陷。在MG的临床治疗中,各名老中医均以益气升提为基本治法,邓铁涛教授[28]提出了“重补脾胃,益气升陷,兼治五脏”的治疗大法。王新志教授[29]认为本病以大气下陷为主要病机。
“益气升提法”是针对脾虚气陷而设,脾居中焦,乃气机升降之要冲。若脾虚气陷,则清阳不升。经云:“下者举之。”“衰者补之。”(《素问至真要大论》)又云“气虚宜掣引之。”(《素问·阴阳应象大论》)本法选药组方双管齐下,既补中焦之气,又举下陷之清阳。黄芪、升麻、柴胡三者为益气升提法的代表结构。黄芪既善补气,又善升气,能补五脏诸虚(《本草逢原》);柴胡为少阳之药,能引大气之陷者自左上升;升麻为阳明之药,能引大气之陷者自右上升。现代药理研究也表明,上述三药内含有多种有效成分具有免疫调节作用。黄芪有效成分黄芪多糖可诱导T细胞增生,黄芪甲苷对T、B淋巴细胞增殖、腹腔巨噬细胞功能等都有影响[30]。柴胡可使T淋巴细胞增殖能力提高,增加Th1和Th2型细胞因子产生[31],升麻可使药物活性成分入血后及时向组织分布和消除,维持血浆中的药物浓度。
黄芪临床使用剂量变化较大,其作用也各不相同。现代研究表明,黄芪对细胞因子及免疫功能的调节作用与其剂量有关。侯天禄等[32]发现,黄芪总酮可使肝硬化模型SD大鼠肝组织TGF-βR1表达降低,高剂量组显著低于低剂量组。阴永辉等[33]发现,黄芪与当归按不同配比均能抑制糖尿病模型大鼠IL-6的表达,其中当黄芪当归3∶2 作用最为显著。高光平等[34]研究发现紫黄散(内含黄芪提取物)可使免疫抑制模型的昆明小鼠增强免疫,抑制血清IL-2、IL-4和IFN-γ水平,其中以中剂量效果最佳。刘言振等[35]对昆明小鼠给予单味黄芪水煎液,发现在一定浓度下,黄芪水煎液剂量增大与机体免疫力成正比,超过一定剂量范围,变化不再明显。李丽君等[36]研究发现大剂量黄芪当归按5∶1 配比能明显改善肺纤维化模型的IPF小鼠生存质量,抑制Th17分化关键基因TGF-β、IL-6、RORγmRNA的表达,促进Treg分化关键基因FoxP3mRNA的表达水平。本研究显示,MG综合评分:低剂量组82分,中剂量组58分,高剂量组88分,给药后各中药组大鼠EAMG症状均有所好转,体质量上升,抓力上升,RNS衰减率显著降低,血清TGF-β含量均显著上升,AChR-Ab、IFN-γ、IL-6、IL-17含量均显著降低。其中,低剂量组与高剂量组MG综合评分较为接近,并且对综合评分涉及的体质量、抓力、RNS衰减、血清AchR-Ab含量均有明显改善,但考虑到高剂量组CD4+CD25+FoxP3+Treg比例显著上升,与模型组相比有显著性差异,认为高剂量组疗效优于低剂量组。中剂量组的MG综合评分较低,主要是因为对抓力的提升不够明显,但中剂量组抓力给药后与给药前相比较,是显著上升的,并且中剂量组在MG的特异性指标肌电图衰减率和AchR-Ab的治疗效果上略优于低剂量组,故认为中剂量组与低剂量组治疗效果较为接近。根据以上结果,可以认为在20 g、40 g、80 g三剂量中,黄芪配伍升麻柴胡治疗MG的最佳剂量为80 g。通常认为,低剂量黄芪可以益气固表,高剂量黄芪可以升阳举陷。MG固然有气虚表现,然而更应属于中气下陷之重症,故益气升提法低剂量与中剂量黄芪益气固表具有一定治疗效果,但想要进一步治疗,还需要加大黄芪剂量行升阳举陷之力。在上述其他学者的研究中,黄芪最佳剂量以其研究对应的中剂量与高剂量居多,且在超过一定剂量后,黄芪对免疫的调节作用不再随剂量增大而明显增大。因此,我们认为黄芪配伍升麻柴胡治疗MG的最佳剂量可能为80 g或者更多,在继续加大黄芪的剂量后,对MG的治疗效果可能会有进一步增强,也可能不再有显著的提升,这还需要再做进一步研究。本研究结果表明,益气升提法对EAMG有明确的治疗效果,其中不同剂量黄芪配伍升麻柴胡,治疗效果存在一定区别,对细胞因子的影响也具有差别。高剂量黄芪(80 g)配伍升麻柴胡的疗效最为优秀,低剂量(20 g)与中剂量(40 g)也都具有显著的治疗效果,但不如高剂量。益气升提法治疗EAMG的免疫机制可能是通过上调TGF-β水平,下调IFN-γ、IL-6、IL-17水平,上调FoxP3+的转录和表达使CD4+CD25+FoxP3+Treg比例升高,调节Th1与Th2细胞比例,加强自身免疫抑制,减轻机体自身免疫应答,调控淋巴细胞网络因子,使其恢复免疫平衡稳态,降低AchR-Ab水平,减轻NMJ处AchR损伤,缓解临床症状,从而达到治疗效果。以MG综合评分对治疗效果做评估,将独立的症状表现与指标检测结果综合汇总,设立明确的衡量标准,能够使对MG治疗效果的评价更客观具体。在接下来实验设计中,可以进一步完善MG综合评分,加入更多评分项目,合理分配各项指标比重,更全面地体现对MG的治疗评估。