单核细胞趋化蛋白1在前列腺癌进展中的调节作用
2018-10-11陈昆韩前河张楠单中杰管庆军
陈昆,韩前河,张楠,单中杰,管庆军
(河南省郑州人民医院 泌尿外科,河南 郑州 450000)
前列腺癌是最常见的癌症之一,也是导致男性死亡的第二大癌症[1]。有报道表明,与肿瘤结合的巨噬细胞能促进肿瘤的发生,是肿瘤患者不良预后的原因之一[2-3]。单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)对于募集免疫细胞具有重要作用,能促进肿瘤细胞血管的生成[4-6]。血管紧张素Ⅱ 1型受体(angiotensin Ⅱ type 1 receptor,AT1R)可以作为炎症因子调节高血压性血管疾病中MCP-1的表达[7]。但到目前为止,并没有关于前列腺癌中MCP-1的表达与AT1R的关系的研究。本研究就此进行讨论。
1 材料与方法
1.1 实验试剂
血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ),AT1R阻断剂CV11974、TCV116,PI3k的抑制剂LY294002(美国Sigma公司)。蛋白提取试剂盒(美国Thermo公司),RPMI 1640培养液,胎牛血清(美国Gibco公司)。人MCP-1 ELISA试剂盒、MCP-1抗体、AT1R抗体、磷酸化蛋白激酶Bser473(p-Aktser473)抗体、蛋白激酶B(Akt)抗体、ACTB抗体、F4/80+抗体和CD68抗体(美国Abcam公司)。
1.1.1 前列腺癌细胞系 前列腺癌细胞系LNCaP、C4-2和C4-2AT6(本研究中所用前列腺癌细胞系中,LNCaP属于雄激素依赖型前列腺癌细胞,C4-2属于雄激素非依赖型前列腺癌细胞,C4-2AT6属于雄激素非依赖型且具有较强血管生成能力的前列腺癌细胞,其恶变程度,逐渐增加)。购自中国科学院上海细胞库,培养于含10%胎牛血清和1%双抗的RPMI 1640培养液中,放入5%二氧化碳CO2相对湿度为95%的37℃培养箱中培养。
1.1.2 前列腺癌临床样本 选取2014年6月-2016年6月郑州人民医院收治的前列腺癌患者,共100例(患者术前未经任何激素治疗)。其中50例进行格里森分数分级,格里森分数≤6的患者24例,格里森分数≥7的患者,即雄激素依赖性前列腺癌(androgendependent prostate caner,ADPC)患者26例;50例进行病理TNM分级,病理TNM分级≤T2的患者25例,≥T3的患者25例。年龄36~70岁,平均(55±5)岁。所有组织样本均经过病理证实,前列腺癌患者的选择标准以患者的临床表现、病理学检测结果为准。
1.2 实验方法
1.2.1 免疫组织化学(简称免疫组化)检测MCP-1和F4/80+的表达 前列腺癌细胞系LNCaP、C4-2和C4-2AT6按1×105个/L的细胞密度接种于放有载玻片的6孔板中,待细胞长到对数生长期时进行MCP-1和AT1R的 检 测。C4-2AT6细 胞 按1×105个/L的细胞密度接种于放有载玻片的6孔板中,待细胞长到对数生长期时加入10-8mol/L AngⅡ,10-8mol/L AngⅡ+10-7mol/L CV11974,培养24 h,进行MCP-1和F4/80+表达的检测。前列腺癌患者的组织制成切片,将其固定在载玻片上进行干燥处理。之后将切片放入二甲苯(I)(Ⅱ)中脱蜡,然后逐级置于100%的纯酒精(I)(Ⅱ)、95%、80%、70%的酒精中各5 min进行水化。水化后在室温下置入3%的H2O2中孵育10 min,PBS洗涤3次。将切片放入柠檬酸缓冲液(0.01 mol/L,pH 6.0)中,先加热至沸腾,然后改为中火(92℃以上),在室温下复温后PBS洗涤3次。将多余液体吸干,并滴加山羊血清封闭液,在37℃条件下孵育30 min。MCP-1抗体(1∶500),AT1R抗体(1∶1 000),F4/80+抗体(1∶1 000)和CD68抗体(1∶800)4℃过夜,取出后在烤箱中以37℃复温30 min,PBST洗3次。滴加生物素抗兔/鼠二抗后,在37℃下孵育1 min,再用PBST洗涤3次。用DAB试剂盒显色30 min后对切片进行清洗。室温下滴加苏木素染液3 min,用清水将苏木素染液洗净,盐酸酒精分化1 s,氨水返蓝5 min。将切片放入浓度分别为70%、80%的酒精各1 min,放入90%的酒精2 min、95%的酒精3 min、100%的酒精(I)(Ⅱ)3 min。二甲苯(I)(Ⅱ)中各放置15 min,取出后晾干,采用中性树胶封片。每个标本以只滴加PBS液的为阴性对照,在显微镜(日本Olympus公司)下观察各切片着色,并对染色强度评分:棕褐色记3分,棕黄色记2分,淡黄色记1分,无着色记0分。显微镜下计阳性细胞数,随机观察10个高倍镜视野,阴性记0分;平均每个高倍镜视野的阳性细胞数1%~25%计1分,25%~50%计2分,50%~75%计3分,≥75%计4分。两得分相乘后,分值满3分判定为阳性表达。
1.2.2 ELISA检测Ang Ⅱ和CV11974对MCP-1的影响 前列腺癌细胞系中LNCaP、C4-2和C4-2AT6按1×105个/L的细胞密度接种于6孔板中,待细胞长到对数生长期时按如下加药:10-8mol/L AngⅡ,10-8mol/L AngⅡ+10-7mol/L CV11974,分别培养12和24 h。C4-2AT6细胞按1×105个/L的细胞密度接种于6孔板中,待细胞长到对数生长期时按如下加药:10-8mol/L AngⅡ,10-8mol/L AngⅡ +10-7LY294002,10-7LY294002培养24 h。并设空白对照。分别吸取上述培养液于离心管中, 3 000 r/min,离心10 min,取上清液用于检测MCP-1,MCP-1检测按照人MCP1 ELISA试剂盒说明书进行操作,并在酶标仪上(美国Thermo公司)进行检测。
1.2.3 Western blot检测Ang Ⅱ和CV11974对p-Akt的影响 C4-2AT6细胞按1×105个/L的细胞密度接种于6孔板中,长到对数生长期时按如下进行加药:分别加入10-8mol/L AngⅡ,10-8mol/L AngⅡ+10-7mol/L CV11974,10-7mol/L CV11974,并作空白对照。加完药后培养24 h,用蛋白提取试剂盒提取细胞蛋白,用BCA法测定每组蛋白质浓度,每孔总蛋白上样量为40 μg,进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转PVDF膜(80 V,90 min),用5%脱脂奶粉封闭2 h,TBST洗膜5 min/次,洗5次。分别用如下一抗p-Aktser473(1 ∶ 1 000),Akt抗体(1 ∶ 600),ACTB(1 ∶ 1 000)抗体4℃过夜,TBST洗膜5 min/次,洗5次。分别用稀释比例为1∶1 000的抗兔/鼠二抗37℃摇床反应1 h,TBST洗膜5 min/次,洗5次。用ECL试剂盒进行显色后凝胶成像系统(美国Bio-Rad公司)中进行拍照,然后采用Lab Works 4.6软件进行分析。
1.3 统计学方法
数据分析采用SPSS 10.0统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验或方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 MCP-1和AT1R在前列腺癌细胞系中的表达
MCP-1和AT1R在前列腺癌细胞系中LNCaP,C4-2和C4-2AT6中均表达,且整体差异有统计学意义(P<0.05)。见图1。MCP-1和AT1R在 LNCaP细胞中表达较低,在C4-2和C4-2AT6中高表达,且在C4-2AT6中表达最高。见表1。
2.2 AT1R对前列腺细胞系中MCP-1生成的作用
分别检测10-8mol/L AngⅡ作用于前列腺癌细胞系LNCaP、C4-2和C4-2AT6 12和24 h时,AT1R阻断剂CV11974对MCP-1生成的影响。在LNCaP细胞

图1 MCP-1和AT1R在前列腺癌细胞系LNCaP、C4-2和C4-2AT6中的表达 (免疫组化×100)
表1 MCP-1和AT1R在前列腺癌细胞系中的表达(n =3,±s)
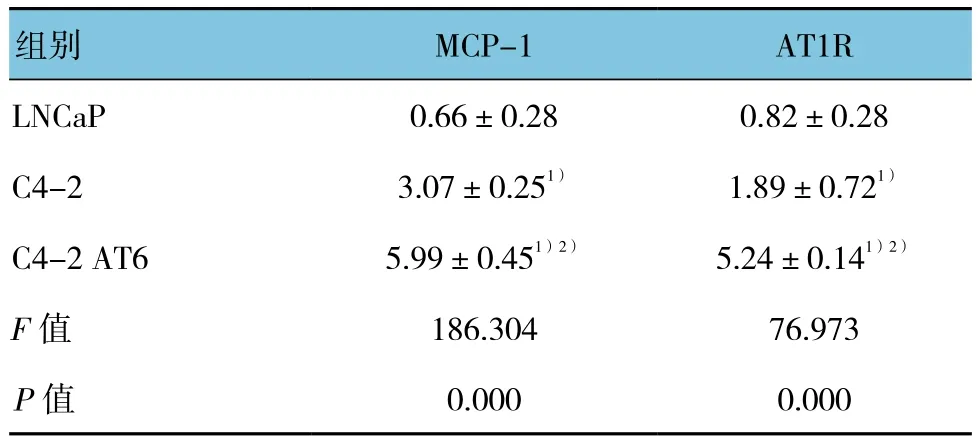
表1 MCP-1和AT1R在前列腺癌细胞系中的表达(n =3,±s)
注:1)和 LNCaP 比较,P <0.05;2)与 C4-2 比较,P <0.05
组别 MCP-1 AT1R LNCaP 0.66±0.28 0.82±0.28 C4-2 3.07±0.251) 1.89±0.721)C4-2 AT6 5.99±0.451)2) 5.24±0.141)2)F值 186.304 76.973 P值 0.000 0.000
中,各组MCP-1生成的整体比较差异无统计学意义(P>0.05);在C4-2、C4-2 AT6细胞中,各组MCP-1生成的整体比较差异有统计学意义(P<0.05)。在C4-2、C4-2AT6细胞中,与空白对照比较,10-8mol/L AngⅡ作用24 h时MCP-1的生成增加(P<0.05),加入CV11974后与10-8mol/L AngⅡ作用24 h比较,MCP-1 的生成降低(P<0.05)。见表 2。
2.3 影响AT1R-磷脂酰肌醇(-3)激酶/蛋白激酶B信号通路后C4-2AT6细胞中MCP-1的生成情况
各组的MCP-1生成的整体比较差异有统计学意义(F=21.859,P=0.000);与空白对照组(12.32±1.95)比较,加入10-8mol/L AngⅡ后MCP-1的生成(33.10±6.13)增加(P<0.05),而与 10-8mol/L AngⅡ比较,加入PI3k的抑制剂LY294002后,MCP-1的生成(15.88±3.04)降低(P<0.05),单纯加入LY294002(0.5μmol/L)时,MCP-1的生成量为(9.92±3.11)。与空白对照比较,加入10-8mol/L AngⅡ后Akt蛋白的磷酸化水平表达增加,而加入CV11974后与10-8mol/L AngⅡ组比较,Akt蛋白的磷酸化水平表达降低。见图2。
2.4 C4-2AT6细胞中AT1R阻断剂TCV116对MCP-1和F4/80+表达的影响
与空白对照组比较,加入TCV116后,C4-2AT6细胞中MCP-1和巨噬细胞标志物F4/80+表达均降低,巨噬细胞浸润降低。见表3和图3。
2.5 前列腺癌患者组织中MCP-1和CD68的表达情况
表2 MCP-1在前列腺细胞系中的表达 (n =3,±s)

表2 MCP-1在前列腺细胞系中的表达 (n =3,±s)
注:1)和空白对照比较,P <0.05;2)与10-8 mol/L AngⅡ作用24 h时比较,P <0.05
LNCaP C4-2 C4-2 AT6空白对照组 4.10±1.12 9.10±1.23 12.19±2.42 AngⅡ(10-8 mol/L,12 h) 4.27±3.14 16.05±2.49 17.84±2.60 AngⅡ(10-8 mol/L,12 h)+CV11974(10-7 mol/L) 4.00±0.52 9.46±2.43 9.13±2.05 AngⅡ(10-8 mol/L,24 h) 9.61±2.32 23.51±2.661) 42.48±9.921)AngⅡ(10-8 mol/L,24 h)+CV11974(10-7 mol/L) 6.28±2.95 9.57±0.702) 18.02±2.302)CV11974(10-7 mol/L) 4.76±3.07 8.00±1.59 9.97±1.85 F值 2.257 27.89 22.543 P值 0.099 0.000 0.000组别

图2 C4-2AT6细胞中AT1R- PI3K/Akt信号通路对MCP-1的生成的影响
MCP-1和CD68的表达与前列腺癌的恶性程度有关。不同格力森分数及去势抵抗性前列腺癌(castrationresistant prostate cancer, CRPC)患者中MCP-1和CD68表达的整体比较,差异有统计学意义(P<0.05);MCP-1在格里森分数≤6的患者中低表达,在格里森分数≥7的患者中高表达,在CRPC患者中表达最高。CD68在≤T2的患者中低表达,在≥T3的患者中高表达。见图4和表4。
表3 C4-2AT6细胞中TCV116对MCP-1和F4/80+ 表达的影响 (±s)
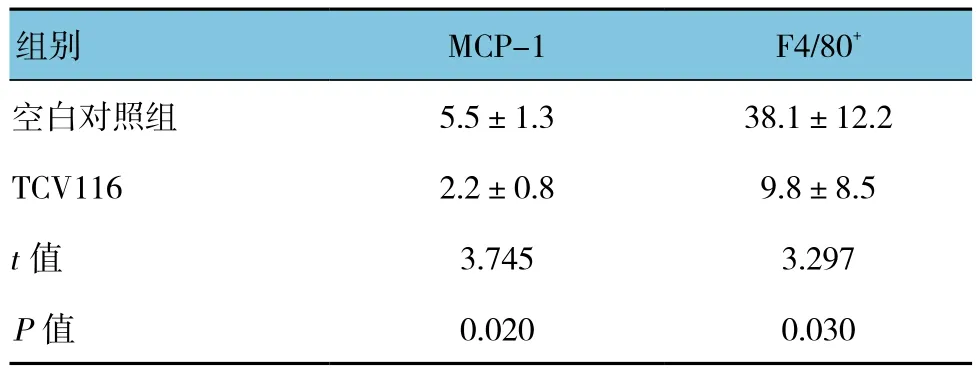
表3 C4-2AT6细胞中TCV116对MCP-1和F4/80+ 表达的影响 (±s)
组别 MCP-1 F4/80+空白对照组 5.5±1.3 38.1±12.2 TCV116 2.2±0.8 9.8±8.5 t值 3.745 3.297 P值 0.020 0.030

图3 C4-2AT6细胞中TCV116对MCP-1和F4/80+表达的影响 (免疫组化×200)
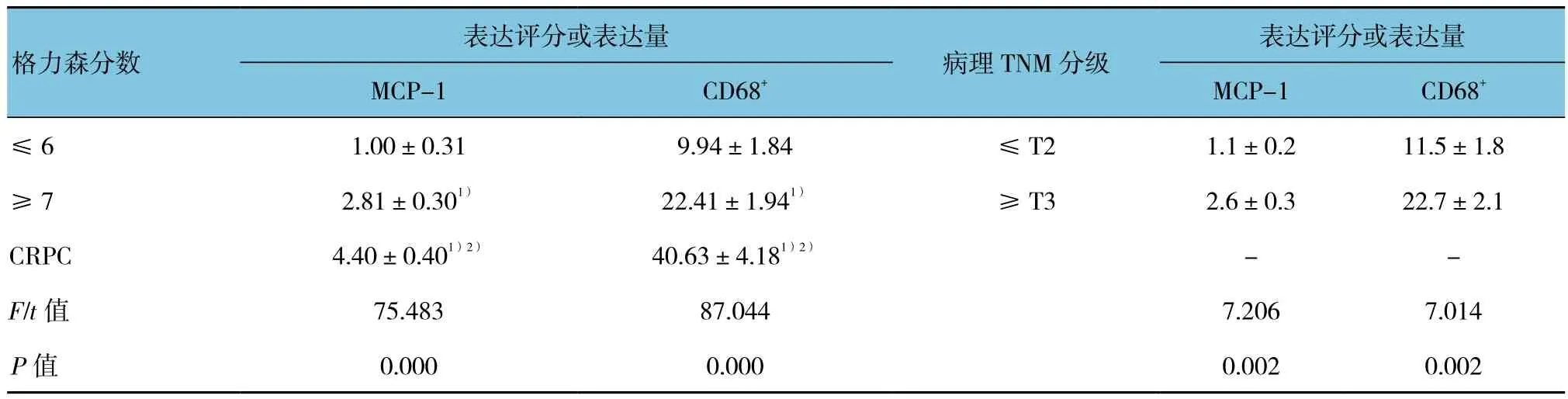
表4 前列腺癌患者组织中MCP-1和CD68的表达 (n =3)

图4 前列腺癌患者组织中MCP-1和CD68的表达 (免疫组化×200)
3 讨论
本研究发现前列腺癌细胞系中MCP-1表达与前列腺癌的恶性程度有关,同时AT1R可通过PI3K/Akt信号通路来调节前列腺癌中MCP-1的表达[8-9]。肿瘤结合的巨噬细胞浸润现象存在于多种癌症中,所以现在已有大量关于巨噬细胞与恶性肿瘤发展关系的报道。但是,有关巨噬细胞在恶性肿瘤中所扮演的角色并没有统一的结论。尤其是在前列腺癌中,只有少部分关于巨噬细胞参与癌症发生和转移过程的报道[10]。并且,巨噬细胞浸润是否可以作为判断患者患有前列腺癌的一种指标仍然具有争议。其中一个重要的因素就是,人们很难对肿瘤细胞中巨噬细胞的亚种群进行分类。单核细胞转移到组织之后,可以分化成常驻巨噬细胞保护组织。但是在癌症发展过程中,一些常驻巨噬细胞会发生分化,然后调节癌症细胞的增殖和血管生成[11]。所以,通常在癌症病变的组织中存在着不同功能的巨噬细胞。如果要进一步了解癌症的发病机制,不仅要考虑巨噬细胞的因素,也要考虑肿瘤相关趋化因子在其中的作用。
癌症细胞和基质细胞中,单核细胞的化学诱导物表达水平的增加与肿瘤微环境中巨噬细胞的增加密切相关。已有研究者证明,MCP-1可以促进单核细胞/巨噬细胞的分化,这说明MCP-1对于巨噬细胞的募集具有重要作用[12]。本研究发现,前列腺癌细胞系中MCP-1的表达水平与前列腺癌细胞恶变的程度有关。越来越多的证据表明,MCP-1有可能成为癌症治疗的靶分子[13],它所诱导的巨噬细胞浸润为大家了解癌症细胞中血管生成的分子机制提供了一个新的方向。
体外研究发现,MCP-1和AT1R在前列腺癌细胞系中LNCaP,C4-2和C4-2AT6中均表达,在LNCaP细胞中表达较低,C4-2和C4-2AT6细胞中高表达,且在C4-2AT6中表达最高。而了解肿瘤细胞中MCP-1表达的上游分子机制对调节肿瘤细胞中MCP-1的表达具有重要意义。之前有研究发现细胞核因子kappa B(nuclear factor-kappa B, NF-κB)和活化蛋白-1(activated protein -1, AP-1)是调节MCP-1的转录的重要因子[14]。在血管平滑肌细胞中,AngⅡ-AT1R可以通过调节NF-κB和AP-1来调节MCP-1的表达。据报道CRPC比雄性激素依赖的前列腺癌症表现出更高的AT1R表达水平[15]。本研究发现,AngⅡ处理细胞24 h时MCP-1和AT1R在C4-2AT6细胞中表达最高,而加入CV11974后的C4-2AT6细胞中,MCP-1的表达降低,加入AT1R的另一个阻断剂TCV116后MCP-1和巨噬细胞标志物F4/80+表达均降低,巨噬细胞浸润降低。
AngⅡ可以激活与细胞增殖相关的多种细胞通路,例如蛋白激酶C(PKC),丝裂原活化蛋白激酶(MAPK)和JAK-STAT3。进一步研究发现,刺激AT1R可以激活PI3K/Akt信号通路。有趣的是,MCP-1可以通过PI3K/Akt信号通路刺激前列腺癌细胞的增殖[16]。本研究表明,加入10-8mol/L AngⅡ后MCP-1的生成增加(P<0.05),加入PI3K的抑制剂LY294002后,MCP-1的生成降低(P<0.05),而加入CV11974后Akt蛋白的磷酸化水平表达降低,说明PI3K/Akt信号通路可能是AngⅡ调节MCP-1表达的上游信号因子。即这个信号通路可能会成为CRPC治疗的一个重要靶点。通过临床样本,也发现MCP-1和CD68的表达与前列腺癌的恶性程度有关。在癌症的发生和发展中,肿瘤微环境和信号通路发挥重要的作用,其具体机制还需更加深入的研究,为癌症的治疗提供充分的理论依据。
