长链非编码RNA HOTAIR对胃肠间质瘤细胞化疗敏感性的影响
2018-10-11李冰熊正方郭亚民
李冰,熊正方,郭亚民
(青海省人民医院 普外科,青海 西宁 810000)
胃肠间质瘤(gastrointestinal stromal tumor, GIST)是胃肠道常见的间质恶性肿瘤,手术切除结合伊马替尼化疗是目前较理想的治疗方案[1]。但在化疗后期,GIST患者对伊马替尼敏感性的逐步降低,最终导致患者生存周期缩短[1-2]。研究发现,长链非编码HOX转录反义RNA(long chain noncoding HOX transcript antisense RNA, HOTAIR)不仅在肿瘤细胞增殖、凋亡中发挥重要作用,还通过内源性竞争微小RNA(MicroRNAs, miRNA)控肿瘤细胞的化疗耐药[3]。本研究以GIST-T1细胞为研究对象,探讨HOTAIR是否可通过miRNAs对细胞的化疗敏感性发挥调控作用。
1 材料与方法
1.1 材料与试剂
伊马替尼购自上海21CEC PX药业公司,胃肠间质瘤细胞GIST-T1由西安交通大学基础医学院实验室馈赠。10例胃肠间质瘤组织及配对正常组织由青海省人民医院普外科手术提供,并通过医院伦理委员会论证;培养基(Dulbecco's modified eagle medium, DMEM)及胎牛血清购自上海酶远生物科技有限公司,HOTAIR(743-752)野生型、突变型质粒、si-HOTAIR及荧光素酶质粒由上海和元生物公司合成,实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)试剂盒购自日本TaKaRa公司,miRNA-133、miRNA-137、miRNA-185、miRNA-21、miRNA-218、miRNA-332及miRNA-518引物购自上海和元生物公司,细胞计数试剂盒(Cell Counting Kit-8, CCK-8)、TdT末端标记(TdT-mediated dUTP nick end labeling, TUNEL)试剂盒购自南京凯基生物有限公司。
1.2 试验方法
1.2.1 细胞培养及小干扰RNA(Small interfering RNA,siRNA)si-下调HOTAIR表达 胃肠间质瘤细胞GIST-T1用含10%小牛血清的DMEM培养基,置5%二氧化碳CO2,37℃孵箱中常规传代培养,选择对数生长期的细胞用于后期实验。将合成的si-HOTAIR(5'-GAACGGGAGUACAGAGAGA-3') 用 LipofectamineTM3000转染,48 h后换液,用于qRT-PCR检测。
1.2.2 半 抑 制 浓 度(half maximal inhibitory concentration, IC50)测定 细胞经伊马替尼处理后,按70%~80%浓度比例铺于96孔板,待细胞完全贴壁后,每孔加入CCK-8试剂10 μl,放入细胞培养箱孵育3 h,分别在24、48、72及96 h用酶标仪检测A450 nm处光密度值(OD值)。每组至少重复检查3次。按伊马替尼药物浓度的细胞存活率,作对数曲线,用SPSS软件计算细胞50%生存率时的药物浓度IC50。
1.2.3 TUNEL检测细胞凋亡 细胞经伊马替尼处理后,采用4%多聚甲醛固定,PBS清洗3次,室温下依次进行通透,末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase, TdT)反应液反应、荧光标记试剂作用、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI)染色,在荧光显微镜下观察,随机选择8个视野下统计阳性细胞数。
1.2.4 荧光素酶活性强度检测 采用LipofectamineTM3000阳离子脂质体法对GIST-T1细胞进行转染。将 质 粒 lncRNA-3'-UTR 野 生 型(wild type,wt)、lncRNA-3'-UTR突变型(mutant type,mut)、阴性对照(negative control, NC)转染至GIST-T1细胞。并归为相应组别。lncRNA-3'UTR野生型序列(743-752)为5'-UUGGUGUUC-3';lncRNA-3'-UTR突变型序列(743-752)为5'-GGGUCCCGG-3'。共转染miRNA-21 minics、inhibitor或miRNA-NC;细胞裂解后上机检测荧光素酶活性强度。原则上,参考Promega公司Dual-Luciferase Reporter Assay System E1910荧光酶活性检测说明书完成,适当做调整。将萤火虫荧光素酶的荧光值进行归一化(海肾荧光素酶荧光值),每组实验重复3次,取平均值进行后续统计分析。
1.2.5 qRT-PCR检 测lncRNA HOTAIR和miRNAs水平含量 选择U6为内参。HOTAIR引物:正向AGCCAGAGGAGGGAAGAGAG,反向TCCCGTTC CCTAGATTTTCC。miRNA-21、miRNA-133、miRNA-137、miRNA-185、miRNA-218、miRNA-332、miRNA-518和U6引物由上海合元公司合成。miRNA-21引物,正向CGGGATCCAGCCACTACCAAGGCATGT T, 反 向 CGGAATTCAACCACGACTAGAGGCTGAC;miRNA-133引物,正向UUUGGUCCCCUUCAACCAG CUA,反向GCUGGUUGAAGGGGACCAAAUU;miRNA-137引物,正向GCGUUAUUGCUUAAGAAUAC,反向CAGTGCAGGGTCCGAGGT;miRNA-185引物,正向GTGATGAGATGGGCACTGTC,反向TCCTCTGCATTGA TCACCAT;miRNA-218引物正向ACAGCAGGCACA GACAGGCAGU,反向UGCCUGUCUGUGCCUGCUGUU U;miRNA-332引物,正向GGGTCTTTGGTTATCTAG C,反向TGCGTGTCGTGGAGTC;miRNA-518引物,正向GGCTTCAGATGGACACACGA,反向GCTCTCCGC TCTAATGGCTT;U6引物,正向CTCGCTTCGGCAGC ACA,反向 5'-AACGCTTCACGAATTTGCGT-3'。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,组间数据的比较采用t检验或重复测量设计的方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 LncRNA HOTAIR在GIST组织及正常组织中的表达水平
GIST组织与正常组织中的lncRNA HOTAIR含量比较,差异有统计学意义(t=3.091,P=0.042),GIST组织中lncRNA HOTAIR表达含量高于正常组织(见图 1)。
2.2 GIST-T1细胞si-HOTAIR的干扰效果
si-HOTAIR组与si-NC组细胞中的HOTAIR表达含量比较,差异有统计学意义(t=14.315,P=0.007),si-HOTAIR组细胞中lncRNA HOTAIR表达含量低于si-NC组细胞(见图2)。
2.3 HOTAIR对GIST-T1细胞伊马替尼化疗敏感性的影响
TUNEL结果显示,si-HOTAIR组细胞DNA损伤阳性细胞比例为(21.4±4.3)%,si-NC组(10.5±1.6)%。两组DNA损伤阳性细胞比较,差异有统计学意义(t=3.384,P=0.037)。si-NC组与si-HOTAIR组吸光度值比较采用重复测量设计的方差分析,结果:①不同时间点间的OD值有差异(F=169.564,P=0.000);②组间OD值有差异(F=69.861,P=0.000),si-HOTAIR组与si-NC组比较,OD值较低,提示HOTAIR干扰后,细胞增殖降低。③两组的OD指标变化趋势有差异(F=16.297,P=0.000),见表1。根据OD值计算各组对于IC50值。si-HOTAIR组细胞伊马替尼IC50为(14.8±2.6)μmol/L,si-NC组伊马替尼IC50为(26.7±2.4)μmol/L,两组比较,差异有统计学意义(t=3.716,P=0.032),si-HOTAIR组细胞对伊马替尼的敏感性高于si-NC组(见图3)。
2.4 HOTAIR与miRNA-21的相互关系

图1 LncRNA HOTAIR在GIST组织及正常组织中的相对表达量

图2 LncRNA HOTAIR的相对表达量
表1 si-NC组与si-HOTAIR组在不同时间点OD值比较 (±s)

表1 si-NC组与si-HOTAIR组在不同时间点OD值比较 (±s)
组别 24 h 48 h 72 h 96 h si-NC 组 0.132±0.004 0.184±0.006 0.647±0.065 1.144±0.072 si-HOTAIR 组 0.134±0.003 0.166±0.005 0.436±0.048 0.867±0.049
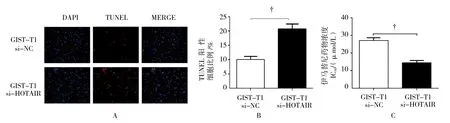
图3 HOTAIR对GIST-T1细胞伊马替尼化疗敏感性的影响
si-HOTAIR组与si-NC组细胞miRNA-21表达含量比较,差异有统计学意义(t=12.714,P=0.008),si-HOTAIR组细胞miRNA-21表达含量高于si-NC对照组(见图4A)。RNA hybird分析显示,HOTAIR序列中743-752区域与miRNA-21核心区域碱基互补(见图4B)。荧光素酶报告显示,在转染wt-3'-UTRHOTAIR的GIST-T1细胞中,miRNA-21组与miRNANC组进行荧光素酶活性比较,差异有统计学意义(t=3.192,P=0.041);inhibitor-miRNA-21组与inhibitormiRNA-NC组进行荧光素酶活性比较,差异有统计学意义(t=12.672,P=0.008);在转染 mut-3'-UTR-HOTAIR的GIST-T1细胞中,将miRNA-21组与miRNA-NC组、inhibitor-miRNA-21组与inhibitormiRNA-NC组分别进行荧光素酶活性比较,差异无统计学意义(P>0.05),HOTAIR与miRNA-21存在序列结合的关系(见图4C)。

图4 HOTAIR与miRNA-21的相互关系
2.5 HOTAIR竞争性结合miRNA-21对GIST-T1细胞伊马替尼化疗敏感性的影响
TUNEL法结果显示,miRNA-21+NC组DNA损伤阳性细胞比例为(18.7±2.5)%,miRNA-21+HOTAIR-wt(野生型)组为(8.7±1.4)%,miRNA-21+HOTAIR-mut(突变型)组为(17.2±2.6)%,经方差分析,差异有统计学意义(F=6.354,P=0.034)。经LSD-t检验两两比较,miR-21+NC和miRNA-21+HOTAIR-mut组TUNEL阳性细胞比例高于miRNA-21+HOTAIR-wt组(t=7.214和 8.133,P=0.024和0.018),miR-21+NC组与 miRNA-21+HOTAIR-mut组比较差异无统计学意义(t=1.307,P>0.05)。3组吸光度值比较采用重复测量设计的方差分析,结果:①不同时间点间的OD值有差异(F=203.973,P=0.000)。②3组间的OD值有差异(F=54.027,P=0.000),miRNA-21+HOTAIR-wt组 与 miRNA-21+HOT-mut组 比 较,OD值较高,提示HOTAIR突变后,细胞增殖程度较低。③miRNA-21+HOTAIR-wt组与miRNA-21+HOT-mut组的OD指标变化趋势有差异(F=10.705,P=0.000),见表2。根据OD值计算各组对于IC50值。IC50结果显示:miRNA-21+NC组细胞(17.6±2.2)μmol/L,miRNA-21+HOTAIR-wt(野生型)组细胞为(27.3±3.1)μmol/L,miRNA-21+HOTAIR-mut(突变型)组细胞为(18.1±2.9)μmol/L,经方差分析,差异有统计学意义(F=9.268,P=0.017)。经LSD-t检验两两比较,miRNA-21+NC组和miRNA-21+HOTAIR-mut组IC50低于miRNA-21+HOTAIR-wt组(均P<0.05),miRNA-21+NC 组与miRNA-21+HOTAIR-mut组比较差异无统计学意义(P>0.05)。HOTAIR可通过竞争性结合 miRNA-21,降低GIST-T1细胞对伊马替尼化疗敏感性。见图5。
表2 3组细胞在不同时间点OD值比较 (±s)
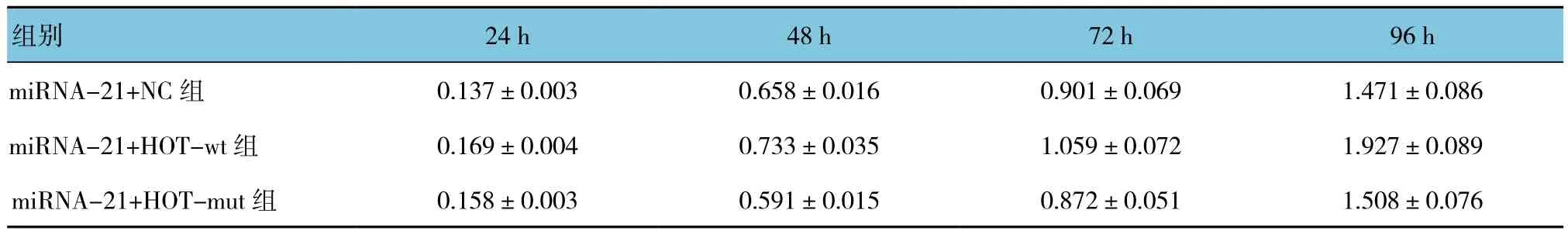
表2 3组细胞在不同时间点OD值比较 (±s)
组别 24 h 48 h 72 h 96 h miRNA-21+NC 组 0.137±0.003 0.658±0.016 0.901±0.069 1.471±0.086 miRNA-21+HOT-wt组 0.169±0.004 0.733±0.035 1.059±0.072 1.927±0.089 miRNA-21+HOT-mut组 0.158±0.003 0.591±0.015 0.872±0.051 1.508±0.076

图5 HOTAIR对GIST-T1细胞伊马替尼化疗敏感性的影响
3 讨论
国内外大量研究发现,lncRNA HOTAIR在肺癌、胃癌及乳腺癌的化疗耐药中发挥重要作用。如Deng等在肺腺癌中发现,HOTAIR通过调控细胞周期蛋白依赖性激酶抑制因子,导致细胞周期停滞,介导顺铂耐药[4]。有学者通过调查大样本的临床数据,指出HOTAIR可能是顺铂耐药性卵巢癌的潜在治疗靶点[5]。本研究所收集的GIST样本中,HOTAIR的表达含量高于配对的正常组织。结合细胞水平的研究结果显示:lncRNA HOTAIR在GIST耐药细胞中表达含量高于敏感细胞系[6];提示HOTAIR可能在GIST的化疗中,起抑制药物敏感性的作用。
此外,近年来研究表明,lncRNA HOTAIR还在多个消化系统肿瘤的预后分析中发挥重要作用。如HOTAIR的过度表达与肝癌、胃癌、食管鳞状细胞癌的复发密切相关,并提示肿瘤转移和预后不良[7]。SMEKALOVA等在小鼠的肝癌模型中,对HOTAIR进行抑制后,肝癌细胞增殖速率降低,对化疗药物的敏感性增高[8]。本研究中,HOTAIR干扰后,GIST细胞对伊马替尼的敏感性增高,提示HOTAIR可能参与GIST的伊马替尼化疗耐药。
在作用机制的研究中发现,目前国内外专家一致认为lncRNAs可以在转录水平、转录后水平、染色质重构3个层面发挥调控作用,并表现出一定的时间和空间性。Protoso等认为lncRNAs可通过募集特异的染色质或内源竞争RNA(competing endogenous RNAs,ceRNA)机制,诱导表观遗传学的调控。如lncRNAs Xist/RepA可通过募集多梳家族蛋白(polycomb-group proteins, PRC2)与果蝇zeste基因增强子同源物2相互作用后,提高其在X染色体的密度,抑制X染色体的活性[9]。还有学者发现,肝癌细胞中,lncRNAUCA1通过结合miR-216b,进一步激活细胞外调节蛋白 激 酶(extracellular regulated protein kinases, ERK)信号通路,导致肿瘤细胞的恶性增殖[10]。HOTAIR调控转录的重要机制之一就是分子诱饵(molecular decoys)。LncRNAs HOTAIR作为ceRNA,与miRNAs小分子的核心序列结合,通过与编码基因竞争性结合miRNAs,降低后者对下游靶基因的抑制作用。如国内有学者在胃癌细胞中,HOTAIR通过吸附miR-331,调控人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)的活性,进而改变细胞的恶性生物学行为[11]。
本研究中,荧光素酶实验证实miRNA-21可通过对HOTAIR部分序列结合,降低荧光素酶的相对活性;同时还发现,对相应结合序列进行突变后,荧光素酶的活性未见明显改变,结合前期基因序列分析结果,提示lncRNA的部分序列与miRNA-21序列存在互补,在GIST-T1细胞中,HOTAIR可通过ceRNA机制结合miRNA-21,从而发挥相应的作用。将lncRNA HOTAIR与miRNA-21共同转染GIST-T1细胞后发现,突变型的HOTAIR未能影响GIST-T1细胞在伊马替尼刺激下的凋亡速度,而野生型的HOTAIR可与miRNA-21核心序列结合,降低TUNEL阳性细胞比例。提示HOTAIR可通过ceRNA机制,调控miR-21活性,进一步降低GIST-T1细胞对伊马替尼的敏感性。
此外,国内外多数学者认为,ceRNA机制中,lncRNAs与miRNAs并非完全的一一对应关系。如lncRNA MALAT1可以通过抑制miRNA-146b、miRNA-143和miRNA-124的活性,调控多个肿瘤细胞对化疗药物的敏感性[12-13];而lncRNA CASC2与lncRNA CRNDE均可与miR-181a的核心序列区结合,分别调控胶质瘤及结肠癌对化疗药物的耐药性[14]。在本研究中,敲减HOTAIR 后发现,除miRNA-21外,miRNA-137、miRNA-332和miRNA-218同样出现变化,提示HOTAIR可能有多个调控基因,有待后期进一步探索。同时应注意到,HOTAIR调控肿瘤细胞的化疗耐药并非完全依赖于miRNAs。如在小细胞肺癌中,HOTAIR可通过影响同源框A1基因的甲基化水平,降低细胞对多柔比星、顺铂和依托泊苷等化疗药物的敏感性;或通过作用于某信号传导通路,直接作用于肿瘤凋亡相关蛋白,改变DNA损伤修复及细胞周期进程等发挥作用[15]。
本研究的不足之处在于仅验证HOTAIR是否通过ceRNA机制调控GIST对伊马替尼的敏感性。后续可通过耐药基因的甲基化、细胞周期蛋白的调控或细胞自噬等方面进行深入研究。此外,本研究的细胞系较为单一,组织样本数量较少,后续将在多个GIST细胞系及动物模型水平进行验证。总之,HOTAIR可通过抑制miRNA-21的活性,影响GIST对伊马替尼的敏感性,有望为GIST的化疗提供新的实验依据。
