C/EBP-α基因在大鼠肝星状细胞株HSC-T6自噬中的作用*
2018-10-11陈耀丽翟颖真刘桓余彭继英尹为华陶丽丽刘秀萍
陈耀丽,翟颖真,刘桓余,彭继英,尹为华,陶丽丽,刘秀萍
(1.北京大学深圳医院 病理科,广东 深圳 518036;3.复旦大学上海医学院 病理学系,上海 200032;2.上海阿克曼医学检验所,上海 200331)
肝纤维化是肝脏对各种慢性损伤的一种修复反应,是各种慢性肝病进展至肝硬化的必经阶段,目前尚缺少有效的治疗方法。其中肝星状细胞(hepatic stellate cells, HSCs)的激活在肝纤维化过程中起关键作用[1-2]。CCAT增强子结合蛋白α(CCAT/enhancer binding protein, C/EBP-α)是一种核转录因子,本课题组前期研究发现其可促进激活的HSCs转向静止状态,恢复其贮存脂滴和维生素A功能,并诱导其凋亡[3-5]。近来有报道发现自噬可通过调节HSCs脂滴促进HSCs激活[6-7]。由于C/EBP-α与自噬均参与HSCs脂滴的调控,因此它们之间可能有相关性。本研究拟从两者之间的关系着手,探讨诱导HSCs自噬激活的可能机制,为肝纤维化早期干预提供新的理论线索。
1 材料与方法
1.1 实验材料
1.1.1 细胞来源 大鼠肝星状细胞株HSC-T6由上海中医药大学徐列明教授馈赠。
1.1.2 药物与试剂 兔抗大鼠多克隆抗体C/EBP-α购于美国Santa Cruz Biotechnology公司,兔单克隆抗体LC3抗体美国Cell Signal Technology公司,α-SMA抗体、Collagen(胶原)抗体、HRP标记的羊抗鼠/兔二抗购于北京鼎国生物技术有限责任公司。
1.2 实验方法
1.2.1 细胞培养 HSC-T6使用含10%新生牛血清的DMEM培养基中培养,取呈指数生长的细胞进行实验。
1.2.2 携带C/EBP-α的慢病毒载体Lenti-C/EBP-α的构建 质粒PDC316-C/EBP-α由本实验室前期构建,携带C/EBP-α的慢病毒载体Lenti-C/EBP-α由北京本元正阳生物公司构建。
1.2.3 Western blot检测各目标蛋白表达 以未感染Lenti-C/EBP-α的HSC-T6为对照组,Lenti-C/EBP-α感染大鼠肝星状细胞株HSC-T6为感染组;Western blot检测自噬相关蛋白微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3)表达;采用自噬激活剂Rapamycin处理HSC-T6(处理组),Western blot检测C/EBP-α和LC3的表达;将HSC-T6经Lenti-C/EBP-α及自噬激活剂Rapamycin共处理(共处理组),Western blot检测C/EBP-α和LC3的改变。细胞经过不同处理因素后,搜集细胞,裂解组织,抽提蛋白;进行变性电泳、转膜封闭、洗膜后分别加入鼠抗GAPDH单克隆抗体(1∶1 000 TBST稀释)或兔抗C/EBP-α抗体(1∶2 000 TBST稀释)、鼠抗α-SMA及胶原蛋白单克隆抗体(1∶1 000 TBST稀释);37℃孵育1 h后4℃过夜;加入二抗(1∶2 000 TBST稀释);用ECL发光液显示蛋白条带,以GAPDH为内对照,用GEL PRO蛋白条带分析软件测定Western blot条带灰度值,并与内参照结果相比较,计算其比值,比较各组差异。
1.3 统计学方法
数据分析采用SPSS 11.0统计软件,计量资料以均数±标准差(±s)表示,比较做t检验,P<0.05为差异有统计学意义。
2 结果
2.1 HSC-T6感染Lenti-C/EBP-α后胶原蛋白、C/EBP-α、LC3的表达
与正常对照组比较,HSC-T6感染Lenti-C/EBP-α后,Western blot结果显示,C/EBP-α表达量增高,而LC3激活减少,提示自噬活性下降;胶原蛋白表达量减少,提示HSCs激活受到抑制;两组比较,采用t检验分析,差异有统计学意义,Lenti-C/EBP-α组C/EBP-α表达高于对照组,而LC3和胶原蛋白表达低于对照组(P<0.05)。见表1和图1。

表1 HSC-T6感染Lenti-C/EBP-α后胶原蛋白、C/EBP-α、LC3的表达

图1 HSC-T6感染Lenti-C/EBP-α后胶原蛋白、C/EBP-α、LC3的表达
2.2 Rapamycin处理HSC-T6后C/EBP-α及LC3的表达
与对照组比较,经Rapamycin处理后,HSC-T6细胞C/EBP-α表达量下降,而LC3激活增多,自噬活性增高,两组比较,采用t检验分析,差异有统计学意义(P<0.05)。见图 2和表 2。
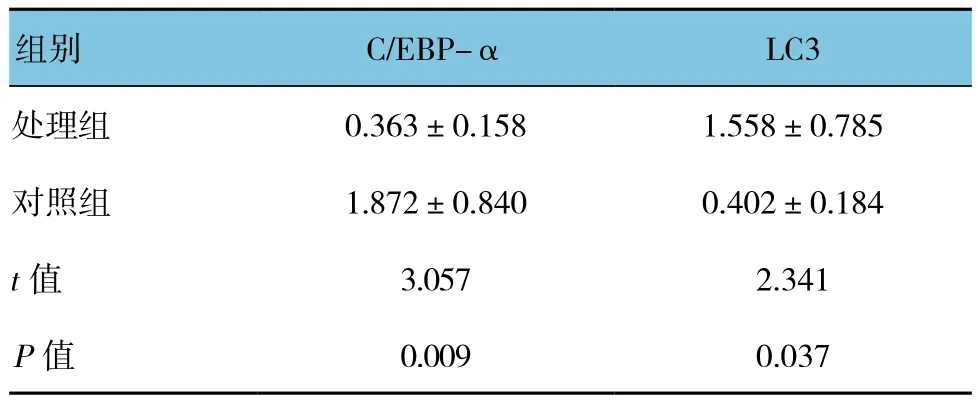
表2 自噬激活剂Rapamycin处理HSC-T6后C/EBP-α、LC3的表达

图2 Rapamycin处理HSC-T6后C/EBP-α、LC3的表达
2.3 HSC-T6经Lenti-C/EBP-α和Rapamycin共处理后C/EBP-α及LC3的表达
HSC-T6经Lenti-C/EBP-α和Rapamycin共处理后,Western blot结果显示与单纯使用Rapamycin(处理组)比较,C/EBP-α表达升高,LC3激活减少,自噬活性下降,α-SMA表达减少,提示HSCs激活受到抑制。两组比较,采用t检验分析,差异有统计学意义(P<0.05),见图 3和表 3。
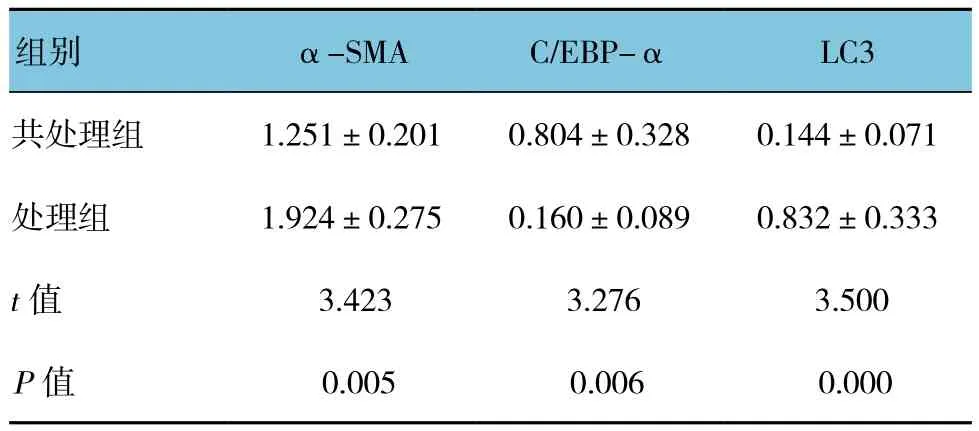
表3 HSC-T6经Lenti-C/EBP-α和Rapamycin共处理后α-SMA、C/EBP-α及LC3的表达

图3 HSC-T6经Lenti-C/EBP-α和Rapamycin共处理后α-SMA、C/EBP-α及LC3的表达
3 讨论
肝纤维化是各种慢性肝病进展至肝硬化的必经阶段,临床治疗的疗效不甚理想,迄今仍是消化内科的难治之症及研究热点。近年发现肝纤维化的过程可以逆转,其中心环节是活化的HSC发生凋亡[1-2]。激活的HSCs表达α-SMA和胶原蛋白,而静止HSCs不表达,因此检测这两个指标侧面反映HSCs激活状态的改变;此外静息的HSCs贮存脂滴,激活的HSCs失去贮存脂滴的功能。因此一些特异性调控脂肪细胞的基因很可能参与了HSCs的调控。C/EBP-α基因可以调控脂肪细胞成熟分化过程中细胞增殖状态[8]。笔者课题组前期发现C/EBP-α在体内和体外都可以诱导HSCs发生凋亡,而对肝细胞的凋亡作用影响很小,对肝脏功能亦无明显损伤[3-5]。
自噬是普遍存在于大部分真核细胞中的一种现象,从酵母到人类具有高度的保守性且非常复杂的分子调控机制。自噬是膜结构的溶酶体依赖性的降解途径,此过程中一些自噬相关基因(Autophagy related gene, Atg) 如 Atg5、Atg7、Atg8(LC3)、Atg12等 的表达对自噬的形成至关重要[9-10]。LC3是自噬标志物,自噬形成时,胞浆型LC3(即LC3-Ⅰ)会酶解掉一小段多肽,转变为膜型(即LC3-Ⅱ),LC3-Ⅱ/Ⅰ比值的大小可估计自噬水平的高低,因此笔者选用LC3反映自噬激活的状况。
自噬在脂类代谢中的作用早有相关报道[11-12]。但研究HSCs激活及脂滴代谢中的作用的文献较少,VAN GRUNSVEN等发现HSCs激活过程中,自噬增加,而使用自噬抑制剂后,可以部分抑制HSCs的激活[6]。2012年FRIEDMAN SCOTT等发现[7]自噬通过调节HSCs脂滴促进HSCs激活。近年有一些相关研究认为一些药物可以通过调控自噬来治疗肝纤维化[13-14]。
结合文献和笔者前期研究结果,并通过初步研究,发现C/EBP-α基因参与HSCs的自噬过程[15-17],在本研究中,笔者构建携带C/EBP-α的慢病毒载体,并采用一直以来研究的大鼠HSCs株(HSC-T6),用自噬激动剂Rapamycin和(或)C/EBP-α共处理,研究结果表明,在HSCs中C/EBP-α表达与自噬有关,C/EBP-α可以抑制自噬激活,从而抑制HSCs激活,其机制有待于进一步深入研究,为以后开发高选择性抗纤维化药物提供新的潜在的作用靶点。
