葛黄颗粒对酒精性肝损伤大鼠醇、醛脱氢酶及细胞色素P450 2E1活性的影响*
2018-10-11杨国川刘友平李志李波梁杨蒲清荣魏嵋
杨国川,刘友平,李志,李波,梁杨,蒲清荣,魏嵋
(西南医科大学 1.附属中医医院 肝胆病科,2.基础医学院生物化学与分子生物学教研室,3.附属中医医院 脾胃病科,四川 泸州 646699)
酒精性肝损伤(alcoholic liver injury, ALI)是指长期大量饮酒所致的肝脏一系列病变,如酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和肝硬化等[1]。肝脏是乙醇代谢的主要场所,机体摄入的乙醇90%在肝脏内代谢。大量研究证实乙醇在肝内主要有2条代谢途径[1]:①醇脱氢酶(alcohol dehydrogenase, ADH)氧化体系;②微粒体乙醇氧化酶体系(microsomal ethanol oxidizing system, MEOS)。当机体摄入少量乙醇时,乙醇主要通过第一条代谢途径进行代谢,即乙醇在肝内首先由ADH氧化为乙醛,继而被醛脱氢酶(aldehyde dehydrogenase,ALDH)氧化为乙酸最终分解为CO2和H2O。但当长期大量饮酒时,血液中高浓度的乙醇会激活第2条途径MEOS,刺激该系统的细胞色素P450 2E1(cytochrome P450 2E1,CYP450 2E1)活性增加参与乙醇的分解代谢,该途径在乙醇代谢过程中会产生大量的活性氧及毒素乙醛,对肝脏导致极大的损伤[2]。由此可见,ADH、ALDH及CYP450 2E1是肝脏中参与乙醇代谢的最主要酶分子,也是导致酒精性肝损伤的主要机制所在[3]。
针对以上乙醇的代谢特点,当前解酒药的开发主要从以下两方面进行:①加强乙醇在胃肠道的首过代谢,抑制其胃肠吸收以降低血中乙醇的浓度;②药物直接作用于参与乙醇代谢的酶系,提高乙醇及其代谢产物的消除率以减轻其对肝脏及其他组织的损伤[4]。葛黄颗粒是本院全国中西医结合肝病专家孙同郊教授经过长期临床探索总结出的纯中药解酒经验方,具有保肝、降酶、降脂的功效,对长期大量饮酒造成的醉酒及预防酒精性肝损伤收到良好的效果。本研究探讨葛黄颗粒对酒精性肝损伤模型大鼠ADH、ALDH及CYP450 2E1的影响,以进一步了解葛黄颗粒的解酒机制。
1 材料与方法
1.1 实验动物
清洁级SD雄性大鼠共90只,体重150~200 g,由西南医科大学实验动物中心提供。
1.2 实验药物
葛黄颗粒由西南医科大学附属中医医院中药制剂室自制的院内颗粒剂组方。处方组成:葛花、赶黄草、柴胡、丹参、枳棋子、虎杖、白术、甘草等。批号20160405,规格10 g/袋。
1.3 试剂
红星二锅头酒由北京红星股份有限公司生产,批号20151001,规格53% Vol,750 ml/瓶;普通饲料(西南医科大学实验动物中心),油红O染液购自北京索莱宝科技有限公司,丙氨酸氨基转移酶(alartine arninotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)检测试剂盒购于南京建成生物工程研究所,ADH、ALDH检测试剂盒购自上海桥杜生物科技有限公司,Anti-Cytochrome P4502 E1抗体购自Abcam公司。
1.4 方法
90只SD雄性大鼠适应性喂养1周后随机分为5组:即正常对照组(正常组)、模型组,葛黄颗粒干预的高、中、低剂量组(简称高剂量组、中剂量组及低剂量组),正常组10只,其余各组20只。模型组、干预组均给予红星二锅头灌胃(乙醇浓度由30%开始,每2周递增乙醇浓度5%,直至乙醇浓度为53%维持3周),剂量为2.0 ml/(100 g·d)(分上下午2次,每次1.0 ml/100 g),正常组采用蒸馏水灌胃2.0 ml/(100 g·d),方法同上。以上各组均自由饮水,饲普通饲料,每周称取体重1次。实验7周后,随机从模型组中选出2只大鼠,取肝脏行HE染色观察其病理学改变,判定已形成ALI,开始给药干预处理,高、中、低剂量组分别灌胃葛黄颗粒0.75、0.50和0.25 g/(100 g·d)(以上药物剂量是根据临床计量的换算及前期预试实验所定),灌胃体积1.0 ml/(100 g·d)(每天上午给药),持续给药至13周结束。
干预组最后1次给药后禁食12 h,以2%戊巴比妥钠0.3~0.4 ml/100 g麻醉,采集腹主动脉血,高速离心10 min后取血清,置入-80℃冰箱冷冻保存备用。全自动生化分析仪检测血清ALT、AST等肝功能指标,ELISA检测ADH、ALDH含量;然后各组大鼠剖腹快速取出肝脏,称量肝湿重,计算肝脏指数(肝脏指数=完整肝脏湿重/体重×100%);切取相同肝叶并用4%甲醛固定,行HE染色观察肝组织的结构;剩余肝组织采用Western blot检测CYP450 2E1表达量。Western blot基本过程:一抗为1∶1 000鼠来源抗P450 2E1蛋白4℃孵育过夜,二抗为1∶3 000羊抗鼠HRP摇床上低速震荡1 h,曝光显影结果采用Bandscan图像分析软件进行光密度积分值分析。
1.5 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,先用Komogorov-Smimov法进行正态分布检验,用Leneve法进行方差齐性检验,组间比较采用方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝组织HE染色情况
正常组大鼠肝细胞形态正常无肿大,结构无紊乱,细胞排列规整。模型组肝细胞肿大明显,结构不清晰,边界不清,细胞排列层次紊乱,肝细胞内可见大小不一的脂肪空泡,少数细胞核被脂肪空泡挤到一边。高剂量组大鼠肝细胞组织形态及结构较模型组改善明显,肝细胞排列较整齐,仅少数肝细胞出现大小不一,呈轻度肿大。中剂量组肝细胞结构、组织形态与模型组相比有所改善,但肝细胞仍存在肿大。低剂量组与模型组比较,组织形态及结构无明显改变,肝细胞仍肿大明显,细胞排列无规则,肝细胞内可见脂肪空泡。见图1。
2.2 各组大鼠肝脏指数的比较
模型组,低、中剂量组肝脏指数较正常组升高(均P<0.05);高、中剂量组肝脏指数与模型组比较均降低(P<0.05),且存在低剂量组>中剂量组>高剂量组的规律。高、中、低剂量组组间比较均无差异。见表1。

图1 各组大鼠病理切片 (HE×400)
表1 各组大鼠肝脏指数的比较 (±s)

表1 各组大鼠肝脏指数的比较 (±s)
注:1)与正常组比较,P <0.05;2)与模型组比较,P <0.05
组别 肝脏指数正常组 2.078±0.316模型组 3.168±0.3021)高剂量组 2.320±0.2582)中剂量组 2.524±0.1091)2)低剂量组 2.675±0.1961)F值 2.578 P值 0.014
2.3 各组大鼠血清AST、ALT、ALDH、ADH含量比较
各组大鼠血清AST、ALT、ALDH、ADH含量比较差异有统计学意义(P<0.05)。与正常组比较,其余各组血清AST、ALT及ADH均有所升高,除高剂量组升高无差异外,其余各组升高差异有统计学意义(P<0.05);与模型组比较,AST、ALT、ALDH在低、中、高剂量组均有所下降,下降趋势依次递减,但仅葛黄颗粒高剂量组下降差异有统计学意义(P<0.05)。与正常组比较,其余各组血清ALDH含量均有所降低,但仅高剂量组降低无差异外,其余各组降低差异均有统计学意义(P<0.05);与模型组比较,血清ALDH含量在高、中、低剂量组均有所升高,升高趋势依次递减,但仅葛黄颗粒高剂量组升高,差异有统计学意义(P<0.05)。高、中、低剂量组组间比较差异均无统计学意义。见表2。
2.4 各组大鼠肝组织CYP450 2E1蛋白表达比较
大鼠肝组织CYP450 2E1蛋白表达量组间比较差异有统计学意义。与正常组比较,除高剂量组外各组大鼠P4502E1蛋白表达升高,差异有统计学意义(P<0.05)。与模型组比较,高、中剂量组P4502E1蛋白的表达均降低,差异有统计学意义(P<0.05)。与高剂量组比较,中、低剂量组P450 2E1蛋白的表达升高,差异均有统计学意义(P<0.05)。见表3和图2。
表2 各组大鼠血清AST、ALT、ADH、ALDH的比较 (±s)
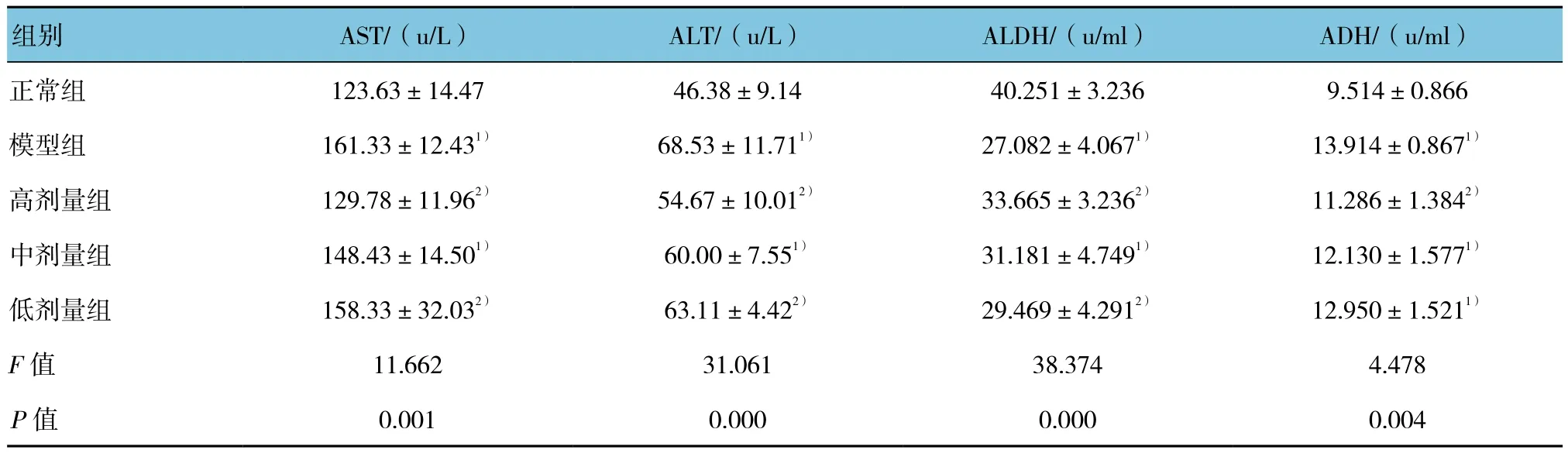
表2 各组大鼠血清AST、ALT、ADH、ALDH的比较 (±s)
注:1)与正常组比较,P <0.01;2)与模型组比较,P <0.05
组别 AST/(u/L) ALT/(u/L) ALDH/(u/ml) ADH/(u/ml)正常组 123.63±14.47 46.38±9.14 40.251±3.236 9.514±0.866模型组 161.33±12.431) 68.53±11.711) 27.082±4.0671) 13.914±0.8671)高剂量组 129.78±11.962) 54.67±10.012) 33.665±3.2362) 11.286±1.3842)中剂量组 148.43±14.501) 60.00±7.551) 31.181±4.7491) 12.130±1.5771)低剂量组 158.33±32.032) 63.11±4.422) 29.469±4.2912) 12.950±1.5211)F值 11.662 31.061 38.374 4.478 P值 0.001 0.000 0.000 0.004
表3 各组大鼠肝组织P4502E1蛋白表达的比较 (±s)

表3 各组大鼠肝组织P4502E1蛋白表达的比较 (±s)
注:1)与正常组比较,P <0.01;2)与模型组比较,P <0.05;3)与高剂量组比较,P <0.01
组别 P4502E1蛋白表达正常组 0.572±0.052模型组 1.482±0.1071)高剂量组 0.723±0.0631)2)中剂量组 1.056±0.0311)2)3)低剂量组 1.226±0.0211)3)F值 13.927 P值 0.000

图2 各组肝组织CYP450 2E1蛋白表达的比较
3 讨论
本研究结果显示,酒精性肝损伤造模成功。同时与正常组比较,在模型组中ADH及CYP450 2E1均升高(P<0.01),而ALDH却降低(P<0.01)。可见,在模型组参与乙醇第一条代谢途径即ADH氧化体系中,因ADH升高及ALDH降低而导致模型组大鼠机体大量乙醛堆积,而乙醛具有很强的毒性,能使肝细胞线粒体受损,引起肝细胞膜脂质过氧化,同时还可与蛋白质结合形成乙醛复合体,导致蛋白质功能紊乱[5]。同时,模型组CYP450 2E1的升高可能是由于长期大量饮酒,血液中高浓度乙醇刺激第二条重要的乙醇代谢途径MEOS活化所致[6],该系统的活化会伴随大量氧自由基的产生,这些氧自由基也会引起肝细胞膜及肝线粒体脂质过氧化反应致肝细胞损伤严重[7-8]。可见,模型组出现典型的酒精性肝损伤,可能与参与乙醇代谢的这3种关键酶活性的改变密切相关。在造模成功后给予不同剂量(高、中、低)的葛黄颗粒干预发现,与模型组比较,不同剂量(高、中、低)的葛黄颗粒均可逆转以上3种酶活性,且存在一定的剂量-效应关系,即高剂量组逆转效果最好,几乎趋于正常值,其次是中剂量组。通过这些指标在不同组间的趋势变化图分析发现,这3种乙醇代谢酶在不同组间的逆转趋势与肝功指标及肝脏指数指标逆转趋势类似。可见,在葛黄颗粒干预下,3种酶不同程度的逆转导致肝损伤不同程度的逆转从而到达不同程度的治疗效果,其中以高剂量组的治疗效果最佳。
葛黄颗粒组方有葛花、白术、柴胡、丹参、虎杖、赶黄草、枳棋子、甘草等,其中葛花作为“解酒方”的君药,研究发现:葛花可降低酒后血中乙醇浓度,推测其可能增强胃的首过代谢,抑制乙醇的胃肠道吸收进而抑制其在肝中的代谢[9],同时葛花还具有消除患者肝内活性氧成分以减少脂质过氧化反应,进一步改善肝功能之功效[10];柴胡和白术作为“解酒方”的臣药,具有抑制自由基的生成,提高抗氧化能力,从而减弱脂质过氧化反应等保肝之功效[11-12];枳棋子和丹参作为“解酒方”的佐药,具有解酒,保护肝细胞及促进组织修复与再生之功效[13-14];虎杖、赶黄草、甘草作为“解酒方”的使药,具有降脂、抗氧化、保肝之功效[15]。可见,一定剂量的葛黄颗粒对酒精性肝损伤有一定的阻止及逆转作用,其机制可能与葛黄颗粒复方药物多靶点、多途径共同协同进行降酒毒、逆转ADH、ALDH等乙醇代谢酶的活性进而抑制自由基生成,促进毒物乙醛分解,最终起到解酒保肝以延缓或逆转酒精性肝损伤发展进程的作用有关。
