硝酸镧示踪大鼠肠上皮细胞糖萼的透射电镜观察
2018-09-27刘文波高贝贝杨春燕张瑾锦
刘文波,高贝贝,杨春燕,张瑾锦
(滨州医学院医药研究中心,烟台 264003)
肠道是机体消化系统主要组成部分,具有免疫调节、黏膜屏障等功能,肠粘膜屏障在维护肠道功能中发挥重要作用。肠上皮细胞糖萼是覆盖于上皮细胞表面的一层富含多糖的结构,也是肠粘膜屏障的组成部分,其在肠粘膜损伤中会发生改变。1966年Luft等[1]首次利用透射电子显微镜观察到糖萼的存在。以往研究多见于血管内皮糖萼,迄今为止,利用特殊方法显示肠粘膜糖萼的报道尚不多见。本实验拟以大鼠为研究对象,以脂多糖(LPS)制造肠粘膜损伤模型[2],利用硝酸镧作为肠上皮细胞糖萼示踪剂,取小肠组织制备超薄切片,利用透射电子显微镜观察肠上皮糖萼,以探讨硝酸镧作为示踪剂显示肠上皮细胞表面糖萼的效果。
材料和方法
1 主要试剂和仪器
脂多糖(LPS,美国Sigma公司),二甲胂酸钠(山东西亚化工有限公司,进口分装,批号:N6347),硝酸镧(天津福晨化学试剂厂,批号:20080317),戊二醛(美国Alfa Aesar公司),锇酸(美国Ted Pella公司),Epon812环氧树脂(美国SPI公司 )。
透射电子显微镜(日本JEOL公司,JEM-1400型,配美国Gatan公司792型CCD),超薄切片机(德国Leica公司,UC7型)。
2 实验材料与方法
雄性SD大鼠(体质量220±20g)6只,购自山东省济南朋悦实验动物繁育有限公司,实验动物合格证 No∶0024545,许可证号:SCXK(鲁)20140007,随机分成2组,每组3只,分别为对照组( A组)和模型组( B组);各组动物在相同条件下适应性喂养7d,自由饮食、饮水。造模前1d禁食不禁水,造模当天行腹腔注射,A组腹腔注射生理盐水,B组腹腔注射LPS 0.5mg/kg(生理盐水配制),注射6h后各组动物进行取材。
3 动物处理及取材
各组动物经4%水合氯醛麻醉后,打开腹腔,取空肠组织3块,标本经生理盐水漂洗后置于含2.5%戊二醛、2%硝酸镧的0.1mol/L二甲胂酸钠溶液(pH 7.4)中,标本均于4℃低温下固定24h。
4 透射电镜样品制备
将经过固定的标本用0.1mol/L二甲胂酸钠缓冲液漂洗,再经1%锇酸(由二甲砷酸缓冲液配制,4℃条件下)后固定1.5h,缓冲液漂洗后经梯度乙醇脱水至无水,再经丙酮置换,Epon812浸透、包埋,升温聚合后进行半薄切片定位到肠粘膜游离面纵切方向,切70nm厚度超薄切片捞于200目铜网上,两组切片不经染色直接在透射电镜下观察、拍照。
结 果
糖萼广泛存在于哺乳动物细胞膜的表面,尤以上皮细胞和内皮细胞糖萼更为丰富。上皮细胞表面的糖萼富含多糖,常与细胞膜上脂类和蛋白质结合形成糖脂和糖蛋白。糖萼带有负电荷,三价阳离子镧与之结合后在透射电镜下原位显示为覆盖于细胞表面的高电子密度致密物。正常肠粘膜表面富含糖萼,硝酸镧与其结合使其保存下来,在后期制样中也不容易流失,透射电镜下可见到小肠黏膜上皮细胞微绒毛顶端及侧面均有镧盐附着,多呈高电子密度的团簇状,微绒毛顶端更为丰富(图1A),肠粘膜损伤后糖萼明显减少乃至消失,故高密度的镧盐数量和分布均明显减少(图1B)。
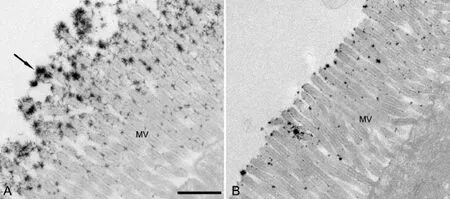
图1 大鼠小肠上皮细胞微绒毛糖萼透射电镜观察(超薄切片未经染色)。A,对照组,糖萼经硝酸镧染色,呈高电子密度团簇状(箭头)附着于微绒毛(MV)表面及侧面;B,模型组,微绒毛表面及侧面的糖萼数量明显减少;比例尺,0.5μmFig. 1 Transmission electron microscopic observation of glycalyx on the microvilli of rat intestinal epithelial cells ( not stained by uranium acetate and lead citrate). A, control group, glycalyx stained with lanthanum nitrate, a large number of clusters of lanthanum salt (arrow) were deposited on the surface and side of microvilli; B, model group, the deposition of lanthanum salt on the surface and side of microvilli obviously decreased. MV, microvilli;scale bar, 0.5μm
讨 论
肠上皮细胞糖萼是上皮细胞产生的糖蛋白,其糖链含半乳糖、葡萄糖、岩藻糖、甘露糖和唾液酸等糖基。带正电荷的硝酸镧可与带负电荷的糖基结合,在透射电镜下呈现高电子密度,从而原位显示出糖萼的位置和数量。上皮细胞糖萼对上皮细胞有保护作用,在细胞识别中起重要作用,细胞表面的糖链能吸收胰蛋白酶和胰淀粉酶等消化酶,微绒毛表面有双糖酶和多肽酶,故肠上皮细胞的微绒毛与表面的糖萼是消化的关键场所,又是物质吸收的门户。
在常规透射电镜制样中标本需经过多次缓冲液漂洗和乙醇、丙酮等有机溶剂脱水,造成糖萼在制样中不断流失,最终在透射电镜下很难直接观察到糖萼的存在,故鲜有采用常规透射电镜方法研究细胞表面糖萼的报道。1966年Luft等[1]应用钌红染色首次在电子显微镜下观察到内皮细胞表面约20nm厚呈毛绒状的糖萼的存在。Haldenby等[3]以阿利新蓝(alcian blue)代替钌红观察到了兔动脉内皮细胞表面厚度约45-80nm的糖萼。吴双等[4]利用阿利新蓝和硝酸镧染色观察了小鼠空肠黏膜微血管内皮细胞表面糖萼的形态及厚度,刘增波等[5]利用硝酸镧示踪显示肾小球血管内皮细胞糖萼的结构,也获得良好的效果。Hegermann J 等[6]利用胶体态的氧化钍作示踪剂观察了大鼠肾小球血管内皮细胞表面糖萼,观察到的厚度50~300nm。由于各种糖萼染料的性质差异及样品固定方法的不同,导致细胞表面糖萼形态和厚度的观察结果有很大差异[7]。冷冻蚀刻透射电镜技术是观察细胞表面糖萼的有效技术,Ghadially 等[8]应用冷冻蚀刻复型技术原位观察到肠上皮细胞微绒毛表面保存完好地糖萼结构。Ebong等[9]通过高压冷冻-冷冻替代的方法也较好地保存了糖萼结构,测得其厚度达1μm以上,但受到仪器设备制约,这两种技术应用受到很大限制。
本实验应用硝酸镧示踪来显示小肠上皮细胞微绒毛表面的糖萼,超薄切片不需染色即可直接观察,由于没有铅、铀等染料的干扰,实验结果直观且明确。实验结果显示正常大鼠小肠上皮细胞微绒毛表面有大量糖萼存在,微绒毛顶端和侧面均有,在微绒毛顶端糖萼最为丰富;而受损伤的模型组的小肠上皮细胞微绒毛表面糖萼明显减少,很多部位甚至消失,与预期结果一致。实验结果表明应用硝酸镧示踪肠上皮细胞糖萼是一种简单有效的方法,可以应用于各种肠粘膜损伤导致的糖萼数量改变的研究中。
