尿素/甲酰胺复配增塑聚乙烯醇薄膜的制备及性能研究
2018-09-26田华峰王格涵姚媛媛姜亚楠项爱民
田华峰,王格涵,姚媛媛,刘 茜,李 岩,姜亚楠,项爱民*
(1.北京工商大学材料与机械工程学院,北京 100048; 2.首都师范大学附属中学,北京 100048;3.中国建筑科学研究院有限公司,北京100013)
0 前言
PVA分子上含有大量的羟基,是一种可水溶、可完全生物降解、高阻隔、无静电、不吸尘且具有良好力学性能的环境友好型高分子材料[1-3]。PVA良好的成膜特性使其在薄膜材料中占有独特的、十分重要的地位[4-5]。PVA分子链由于排列整齐、规整性高、易于排入晶格而具有很高的结晶度。此外,PVA分子链上的羟基能形成大量的分子内和分子间氢键,导致其熔点(Tm,190 ℃)远高于分解温度(Td,140 ℃),因此熔融加工困难[6]。目前,PVA薄膜的生产多采用流延法[7- 8],但溶液加工成型工艺复杂、效率低、品质不均匀且难以制备厚壁及形状复杂的产品,极大地限制了PVA薄膜的广泛应用。因此,通过破坏PVA分子的氢键作用以改善其熔融加工性能引起了越来越多的关注。
研究表明,在PVA基体中引入小分子增塑剂是改善其熔融加工的一种实施方便、操作简单的有效方法[9-10]。常用的PVA增塑剂主要有乙二醇[11]、甘油[12]、尿素[13]、山梨醇[14]等物质,小分子增塑剂的添加能够有效减弱PVA基体内部的氢键作用,提高分子链及链段的运动能力,降低Tm,进而实现PVA的热塑加工。然而,单独使用尿素或甘油增塑PVA时易造成小分子析出现象,严重影响产品品质。具有活泼反应性的甲酰胺不仅能够与PVA分子链中的羟基形成氢键,而且能够与尿素形成良好的复配增塑剂体系[15]。
本文以尿素/甲酰胺为复配增塑剂,采用熔融共混法制备了PVA薄膜,并对复配增塑PVA薄膜的微观形貌、分子结构、热性能、结晶性能及力学性能进行了研究。
1 实验部分
1.1 主要原料
PVA,117,日本可乐丽化学有限公司;
尿素、甲酰胺,分析纯,北京国药集团化学试剂有限公司;
去离子水,实验室自制。
1.2 主要设备及仪器
高速混合机,SHR10DY,北京华新科塑料机械有限公司;
转矩流变仪,XSS-300,上海科创模塑机械设备有限公司;
平板硫化机,LP-S-50,瑞典 Labtech Engineering 公司;
扫描电子显微镜(SEM),TESCAN VEGA,捷克Tescansro公司;
傅里叶变换红外光谱仪(FTIR),iN10 MX,美国Nicolet仪器公司;
差示扫描量热仪(DSC),Q100,美国TA公司;
微机控制电子拉力试验机,CMT6104,美特斯工业系统(中国)有限公司。
1.3 样品制备
室温条件下,将PVA、尿素、甲酰胺和去离子水按照表1的配方在容器中混合均匀得到预混料,然后将预混料在高速混合机中充分混合10 min,静置4~5 h后在转矩流变仪中105 ℃下熔融塑化10 min,转速设置为60 r/min,将塑化后的物料经热压机在温度为110 ℃、压力为1.0×105N的条件下压制成厚度为0.65 mm的PVA薄膜;测试前,将所制备的薄膜置于相对湿度为59 %的环境中恒湿7 d。
1.4 性能测试与结构表征
SEM分析:将制得的增塑PVA薄膜在液氮中脆断,其断面经喷金处理后,通过SEM观察其断面特征并拍照,加速电压为10 kV;
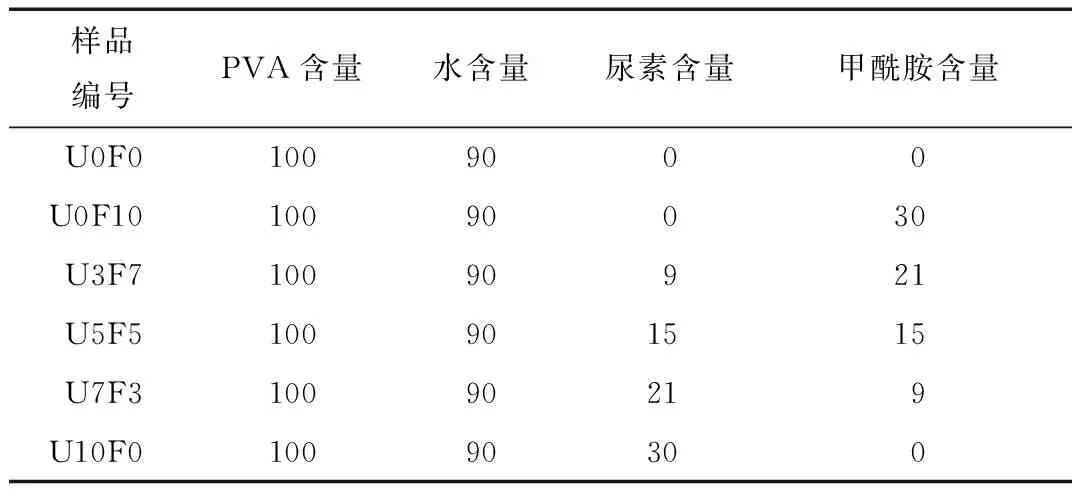
表1 尿素/甲酰胺增塑PVA的样品配方表 份
FTIR分析:将测试样品与少量溴化钾粉末按照1∶200的质量比混合研磨均匀并压片,采用FTIR对样品进行扫描,扫描范围为4 000~500 cm-1,分辨率为4 cm-1,扫描次数为32次;
DSC分析:取5~10 mg样品置于样品盘中,在氮气气氛下快速升温至190 ℃并保持3 min以消除热历史,然后以10 ℃/min的速率降温至40 ℃保持3 min,再以10 ℃/min的速率升温至230 ℃,记录DSC曲线,其结晶度(Xc)按式(1)计算:
(1)
式中Xc——结晶度, %
ΔHf——试样的熔融热焓, J/g
拉伸性能按GB/T 13525—1992测试,将薄膜切成C型样条并置于相对湿度为59 %的环境中恒湿7 d,测试温度为25 ℃,拉伸速率为50 mm/min,每个配方测试5个样品并取其平均值。
2 结果与讨论
2.1 SEM分析
如图1所示,所有PVA薄膜的脆断面均呈现出带状条纹状的粗糙状态,这是典型韧性断裂的特征,表明PVA分子本身具有良好的柔韧性。相比于纯PVA薄膜,尿素/甲酰胺复配增塑剂的添加使得材料的脆断面更为粗糙,带状条纹更加明显,即尿素/甲酰胺复配增塑体系能够有效改善PVA薄膜的冲击韧性。此外,当尿素与甲酰胺的质量比为3∶7时,可观察到有白色晶体析出,而当尿素与甲酰胺比例相当时,薄膜的脆断面较为均一。

样品:(a)U0F0 (b)U3F7 (c)U5F5 图1 尿素/甲酰胺复配增塑PVA薄膜的SEM照片Fig.1 SEM of urea/formamide complex plasticized PVA films
分析其原因认为,尿素或甲酰胺等小分子能够与PVA分子上的羟基产生氢键,进而减弱了PVA分子内和分子间的氢键作用并破坏了其有序结构,降低了分子链或链段的相互作用力,不容易结晶(图5),呈现出韧性断裂特征。然而,尿素或甲酰胺小分子单独使用时,极易析出于聚合物表面,增塑效果不佳,所以当尿素与甲酰胺复配使用且比例相当时,增塑效果达到最佳。
2.2 FTIR分析

收峰,其中U10F0样品最为明显。图2(b)中3 416 cm-1处宽而强的吸收峰归因于PVA基体中—OH的伸缩振动,2 917 cm-1处的吸收峰对应于PVA中亚甲基的不对称伸缩振动,1 331 cm-1处为甲基与亚甲基的弯曲振动吸收峰。尿素和甲酰胺引入使得PVA中—OH的伸缩振动特征吸收峰向高波数移动,由U0F0的3 419 cm-1移动至U10F0的3 448 cm-1。这是因为增塑剂的加入破坏了PVA分子间和分子内的氢键,而增塑剂本身又与PVA形成新的氢键作用,改变了原有羟基的伸缩振动频率,使PVA羟基最大吸收波数向高波数偏移。
样品:1—U0F0 2—U0F10 3—U3F7 4—U5F5 5—U7F3 6—U10F0 7—尿素图2 尿素及增塑PVA薄膜的FTIR谱图Fig.2 FTIR spectra of urea and plasticized PVA films
2.3 DSC分析
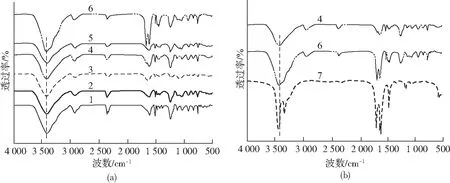
图3为尿素/甲酰胺增塑PVA薄膜的DSC结晶曲线。由图3可以看出,纯PVA薄膜的结晶温度为187 ℃,且结晶峰峰形尖锐。加入尿素/甲酰胺后,PVA薄膜的结晶温度明显降低,结晶峰强度逐渐减小,且结晶温度随着尿素含量的增加而逐渐降低,当尿素含量继续增加时,PVA薄膜的结晶峰消失。这是由于PVA分子链内和分子链间存在大量的氢键作用,使其具有稳定的聚集态结构,结晶温度较高,结晶峰尖锐。尿素/甲酰胺小分子的引入将渗透到PVA分子间,与PVA大分子上的羟基结合形成更稳定的氢键,从而减弱了PVA分子链内和分子链间的氢键作用,破坏了分子的规整性,使PVA分子链段的活动性增强,降低结晶度,从而使PVA薄膜的结晶温度降低。当尿素和甲酰胺的质量比大于1∶1时,结晶峰消失。这是由于尿素分子中氨基的数量多于甲酰胺,更易与PVA分子链上的羟基结合形成氢键[17]。
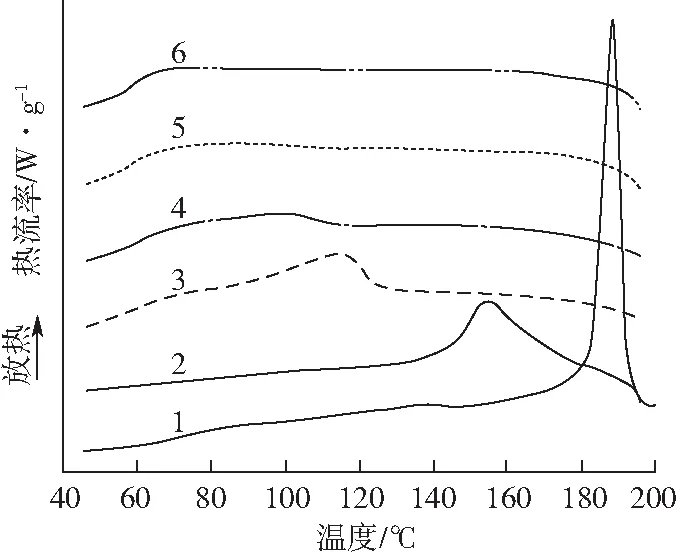
样品:1—U0F0 2—U0F10 3—U3F7 4—U5F5 5—U7F3 6—U10F0图3 尿素/甲酰胺增塑PVA薄膜的DSC结晶曲线Fig.3 DSC cooling curves of urea/formamide plasticized PVA films
尿素/甲酰胺增塑PVA薄膜的熔融曲线如图4所示,由尿素/甲酰胺复配增塑的PVA薄膜较纯PVA薄膜的熔融温度降低。这是由于尿素/甲酰胺作为增塑剂破坏了PVA分子链内和分子链间的氢键作用,增强了PVA分子链段的运动能力,影响了PVA的结晶行为,使得PVA分子的无定形区域增大,熔融峰减弱,熔融温度降低,因而PVA薄膜的熔点随着增塑剂的添加而显著降低,并且随着尿素含量的增加呈现出逐渐降低的趋势。然而,当尿素和甲酰胺质量比为10∶0(U10F0)时,薄膜的熔融温度相对较高。分析其原因认为,甲酰胺是尿素的良溶剂,使尿素在PVA中更稳定、不易析出,达到较好的增塑效果,而尿素单独使用时则在PVA基体中容易析出而效果不佳。
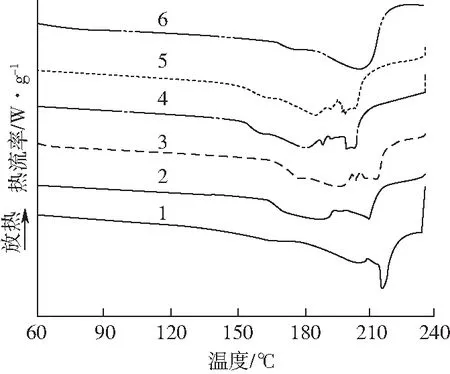
样品:1—U0F0 2—U0F10 3—U3F7 4—U5F5 5—U7F3 6—U10F0图4 尿素/甲酰胺增塑PVA薄膜的DSC熔融曲线Fig.4 DSC melting curves of urea/formamide plasticized PVA films
由式(1)计算得到的尿素/甲酰胺增塑PVA薄膜的结晶度如图5所示, 纯PVA薄膜的结晶度为38.2 %,加入尿素、甲酰胺后,薄膜的结晶度明显降低,且随着尿素含量的增加,PVA薄膜的结晶度由U0F0的38.2 %逐渐降低至U10F0的3.7 %,达到了良好的增塑效果,这与DSC结晶曲线和熔融曲线的变化规律相一致。
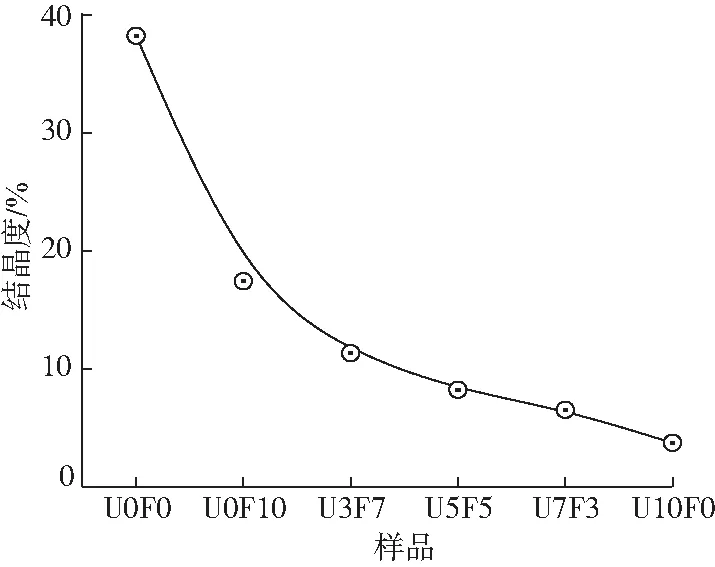
图5 尿素/甲酰胺增塑PVA薄膜的结晶度Fig.5 Crystallinity of urea/formamide plasticized PVA films
2.4 力学性能分析
从图6可以看出,纯PVA薄膜的拉伸强度为38.86 MPa,加入尿素/甲酰胺后,PVA薄膜的拉伸强度明显降低,弹性模量呈现出先减小而后增大的趋势。这是因为尿素/甲酰胺能够与PVA的分子链之间形成氢键,减弱了PVA分子链内及分子链间的氢键作用,减少了PVA分子链间的物理交联点,从而使得PVA分子链间的相互作用减弱。薄膜的拉伸强度随尿素含量的增加而减小,尿素分子中含有较多的氨基,能与PVA分子链上的羟基产生稳定的氢键,更有利于破坏PVA本身的氢键作用,进而破环了PVA分子链的结晶行为而导致拉伸强度降低,弹性模量减小。此外,纯PVA薄膜的断裂伸长率为1 207.24 %,加入尿素/甲酰胺后,PVA薄膜的断裂伸长率明显增大,表现出良好的增塑增韧效果。一方面,尿素/甲酰胺破坏了PVA
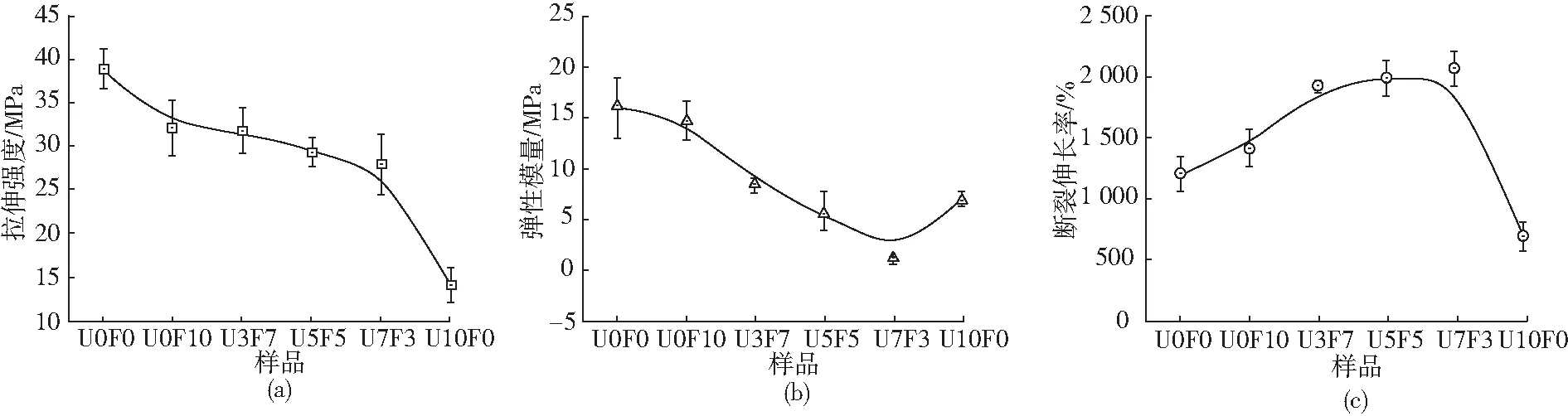
(a)拉伸强度 (b)弹性模量 (c)断裂伸长率图6 尿素/甲酰胺增塑PVA薄膜的力学性能Fig.6 Mechanical properties of urea/formamide plasticized PVA films
分子的有序结构,导致其结晶度降低(图5),即尿素/甲酰胺复配增塑体系使得PVA基体晶区/无定形区的比例减小,分子链运动能力增强,导致断裂伸长率增大。另一方面,小分子的尿素/甲酰胺渗透于PVA分子链间,增大了其分子链间的距离,减小了分子链及链段旋转的空间位阻,从而使分子链的柔韧性增加,断裂伸长率增大。U10F0样品弹性模量的增大及断裂伸长率的降低归因于尿素单独使用时极易析出,增韧效果不佳。
3 结论
(1)将尿素、甲酰胺、水和PVA共混,通过低温熔融法制备了PVA薄膜,研究了尿素和甲酰胺配比对薄膜结构和性能的影响;
(2)尿素、甲酰胺能够与PVA分子链上的羟基形成更稳定的氢键,有效破坏了PVA分子内和分子间的氢键,破坏了PVA分子链的规整性,降低了结晶温度、熔融温度以及结晶度;尿素单独使用时易析出,效果不佳,甲酰胺作为尿素的良溶剂,能有效抑制尿素析出,因此尿素/甲酰胺复配增塑PVA取得了有益效果;
(3) 尿素/甲酰胺的质量比为1∶1时,薄膜既具有良好的韧性,又保持较好的拉伸强度且表面无白色晶体析出,增塑效果最佳。
