茶叶中10种农药残留的 液相色谱-串联质谱法 和气相色谱-串联质谱法测定
2018-09-22胡雪艳王雯雯
胡雪艳,彭 涛,陈 辉,王雯雯
(1.中国检验检疫科学研究院,北京 100176; 2.安捷伦科技有限公司,北京 100102)
近年来,我国的茶叶产业得到了很大发展,茶叶出口国家和地区已经达到120余个,出口的茶叶品种不断增加。目前,我国茶叶出口主要有欧盟、美国、日本等国际市场,其中欧盟和日本作为我国茶叶出口两大主要市场,均对茶叶制定了非常苛刻的农药残留限量标准,截止到2015年7月,欧盟和日本对茶叶中农药残留最大限量(MRL)都做了严格的规定,其中欧盟459种,日本240种[1-2]。茶叶出口的农药残留限量标准的不断提高,直接影响了中国茶叶出口的数量。本文研究的10种农药是FAPAS茶叶标准物质(19184)能力测试样品中含有的农药,欧盟和日本肯定列表中均对MRL做了严格限量,如欧盟规定了啶虫脒、溴氰菊酯、乐果、吡虫啉、高效氯氟氰菊酯、灭多威、p,p′-滴滴伊、甲基嘧啶磷、腐霉利、哒螨灵的MRL分别为0.05、5、0.05、0.05、1、0.1、0.2、0.05、0.05、0.05 mg/kg。从2012年起至2015年初,欧盟食品饲料快速预警系统(RASFF)通报显示,我国出口欧洲的6批茶叶产品因农药残留超标被欧盟成员国通报[3]。而我国在2013年3月1日实施《食品中农药最大残留限量》(GB 2763-2012)之前,对茶叶的农药残留限量标准只有9种,GB 2763-2012实施后涉及茶叶中农药残留25项,其中部分指标与日本的残留限量对比,我国的限量要求更为严格(除杀螟硫磷指标限量),说明我国与世界的限量标准在一步步的接轨中。但在我国,真正把茶叶农药残留限量标准的政策措施落到实处还有很长的一段路要走。因而,探索上述农药的快速、准确的检测方法十分必要。
本文研究的10种农药均是在茶叶种植过程中经常使用的农药,目前,国内外涉及上述10种农药的检测方法主要有气相色谱-串联质谱(GC-MS/MS)[4-8]、液相色谱-串联质谱(LC-MS/MS)[9-14]、GC-MS[15-16]等。Tomas等[7]采用茶叶水化后,液液萃取的前处理方式,建立了茶叶中135种农药的GC-MS/MS检测方法;Chen等[9]采用改进的QuEChERS前处理方式,建立了茶叶中65种农药的LC-MS/MS检测方法;贾玮等[14]采用改进的QuEChERS前处理方式,样品经乙腈直接提取,建立了茶叶中290种农药的LC-MS/MS检测方法,以上这些方法检测农药数量虽然较多,但均未能同时包含这10种农药的测定。提取方法方面,以上文献均未考察过浸泡提取对农药提取效率的影响。本方法针对FAPAS茶叶标准物质(19184)能力测试样品中含有的10种农药在检测中存在的问题,并参考GB/T 23204-2008[17]和GB/23200.13-2016[18]方法,对茶叶实际样品中存在的10种农药残留的检测进行了优化。检测中发现提取过程如果采用直接均质提取无法达到最佳的提取效率,于是对浸泡提取时间进行了优化。由于茶叶样品基质复杂,本文采用基质匹配标准曲线来降低基质对准确定量的干扰。本实验对茶叶中农药残留实际的检测工作具有一定的指导意义。
1 材料与方法
1.1 材料与仪器
啶虫脒(acetamiprid)、溴氰菊酯(deltamethrin)、乐果(dimethoate)、吡虫啉(imidacloprid)、高效氯氟氰菊酯(lambda-cyhalothrin)、灭多威(methomyl)、p,p′-滴滴伊(p,p′-滴滴伊)、甲基嘧啶磷(pirimiphos-methyl)、腐霉利(procymidone)、哒螨灵(pyridaben)标准品(纯度均大于95%) 德国Dr.Ehrenstorfer公司;乙腈、甲苯(均为色谱纯) 美国Honeywell公司;甲酸(纯度大于96%) 美国MREDA公司;Cleanert TPT固相萃取小柱(2 g/12 mL) 天津博纳艾杰尔科技有限公司;所测定的茶叶样品为茶叶标准物质(编号:19184,白茶)及其空白茶叶 北京中检维康技术有限公司。
Agilent 1290-6460液相色谱-串联质谱仪(配有电喷雾电离源) 美国Agilent公司;Agilent 7890A-7000B气相色谱-串联质谱仪(配有电子轰击电离源) 美国Agilent公司;T25均质器 德国IKA公司;N-EVAP-112型氮吹仪 美国Organomation公司;R-215旋转蒸发仪 瑞士Buchi公司;KDC-40离心机 中国中佳公司;SYNER型超纯水发生器 美国Millipore公司。
1.2 实验方法
1.2.1 对照品溶液制备 溴氰菊酯为溶于丙酮中浓度为0.1022 mg/mL的标准溶液,其他9种农药标准品为固体,分别准确称量9种固体农药标准品,均用甲醇配制成浓度约为1.0 mg/mL的单一标准储备液;将10种农药配制成浓度为5 mg/L的混合标准溶液,于1~4 ℃下冷藏避光保存。磷酸三苯酯(triphenyl phosphate,TPP)为气相色谱-串联质谱法测定样品的内标,用甲醇配制成浓度为5 mg/L的标准溶液,于1~4 ℃下冷藏避光保存。
1.2.2 茶叶中农药的提取 参考GB/T 23204-2008[17]和GB/T 23205-2008[18]方法,增加了浸泡提取步骤,称取2 g茶叶样品(精确到0.01 g),至80 mL离心管中,分别加入15 mL乙腈,浸泡1 h;15000 r/min均质提取1 min;低速离心机离心5 min(4200 r/min);将上清液转至150 mL鸡心瓶中;重复上述提取步骤,合并两次提取上清液;旋转蒸发(45 ℃,40 r/min)至约2 mL,待净化。
1.2.3 茶叶样品的净化
1.2.3.1 LC-MS/MS测定净化方法 活化Clearn-TPT柱(柱顶部填入约2 cm高的无水Na2SO4,5 mL乙腈-甲苯(3∶1,v/v)溶液淋洗两次),弃去流出液,下接80 mL鸡心瓶,放入固定架上待用;将1.2.1中待净化浓缩提取液移至TPT柱中,2 mL乙腈-甲苯(3∶1,v/v)溶液洗涤鸡心瓶3次,25 mL乙腈-甲苯(3∶1,v/v)洗脱;待所有液体收集完毕之后,取下鸡心瓶;旋转蒸发(45 ℃,70 r/min)至约0.5 mL;于35 ℃水浴中用氮气吹干,残渣用1 mL乙腈-0.1%甲酸水溶液(2∶8,v/v)超声波溶解,经0.22 μm微孔过滤膜,滤液供LC-MS/MS测定。
1.2.3.2 GC-MS/MS测定净化方法 活化Clearn-TPT柱(柱顶部填入约2 cm高的无水Na2SO4,5 mL乙腈-甲苯(3∶1,v/v)溶液淋洗两次),弃去流出液,下接80 mL鸡心瓶,放入固定架上待用;将1.2.1中待净化浓缩提取液移至TPT柱中,2 mL乙腈-甲苯(3∶1,v/v)溶液洗涤鸡心瓶3次,25 mL乙腈-甲苯(3∶1,v/v)洗脱;待所有液体收集完毕之后,取下鸡心瓶;旋转蒸发(45 ℃,70 r/min)至约0.5 mL,加入40 μL磷酸三苯酯,于35 ℃水浴中用氮气吹干,残渣加1 mL正已烷超声波溶解,经0.22 μm微孔过滤膜,滤液供GC-MS/MS测定。
1.2.4 基质效应计算 对于基质效应的评价,本文采用了较为常用的相对响应值法:基质效应(%)=B/A×100[19],A为纯溶剂中农药的响应值;B为样品基质中添加相同浓度农药的响应值。
1.3 检测条件
1.3.1 液相色谱-串联质谱条件 色谱柱:Agilent ZORBAX SB-C18柱(100 mm×2.1 mm,3.5 μm);柱温:40 ℃;进样量:10 μL。流动相A:0.1%甲酸水溶液;流动相B:乙腈;流速为0.4 mL/min。梯度洗脱程序:0~3.0 min,1% B~30% B;3.0~6.0 min,30% B~40% B;6.0~9.0 min,40% B;9.0~15.0 min,40% B~60% B;15.0~19.0 min,60% B~99% B;19.0~23.0 min,99% B;23.0~23.01 min,99% B~1% B;23.01~27.0 min,1% B。电离模式:电喷雾离子化,正离子模式;雾化气(氮气)压力:0.28 MPa;离子喷雾电压:4000 V;干燥气(氮气)温度:350 ℃;干燥气流速:10 L/min;采集数据方式:多反应监测(MRM)。目标化合物的离子对、碰撞电压等多反应监测(MRM)参数见表1。
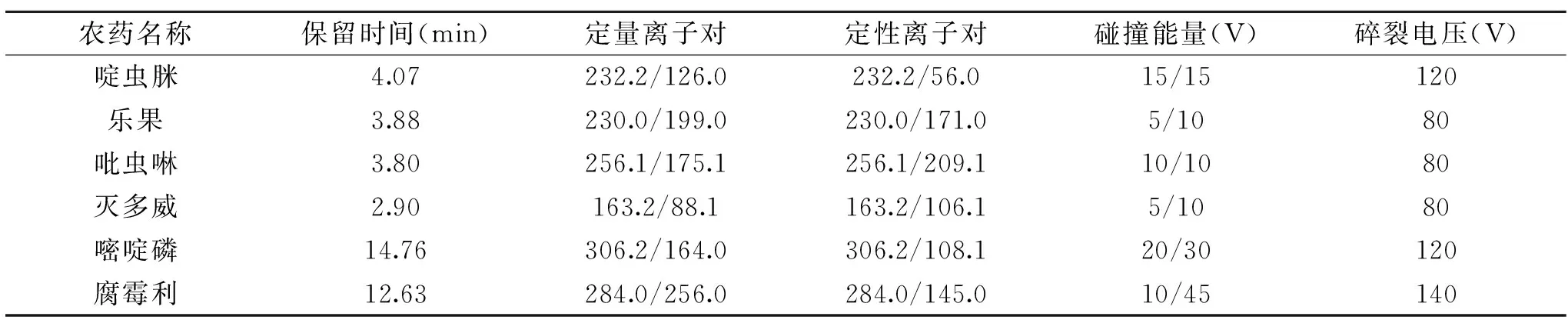
表1 LC-MS/MS测定6种农药的保留时间、离子对、碰撞能量、碎裂电压Table 1 Retention times,ion pairs,collision energies and fragmentation of six pesticides for LC-MS/MS
1.3.2 气相色谱-串联质谱条件 色谱柱:Agilent DB-1701毛细管柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气(纯度99.999%);流速1.2 mL/min;柱温起始温度40 ℃,保持1 min,以30 ℃/min速率升温到130 ℃,以5 ℃/min速率升温到250 ℃,以10 ℃/min速率升温到300 ℃,保持5 min;进样方式为不分流,0.75 min后打开分流阀,进样量1 μL,进样口温度290 ℃,传输线温度280 ℃。电离模式:电子轰击电离源(EI);离子源极性:正极性;电离能量:70 eV;离子源温度:230 ℃;溶剂延迟时间:6 min;采集数据方式:多反应监测(MRM)。目标化合物的离子对、碰撞电压等多反应监测(MRM)参数见表2。
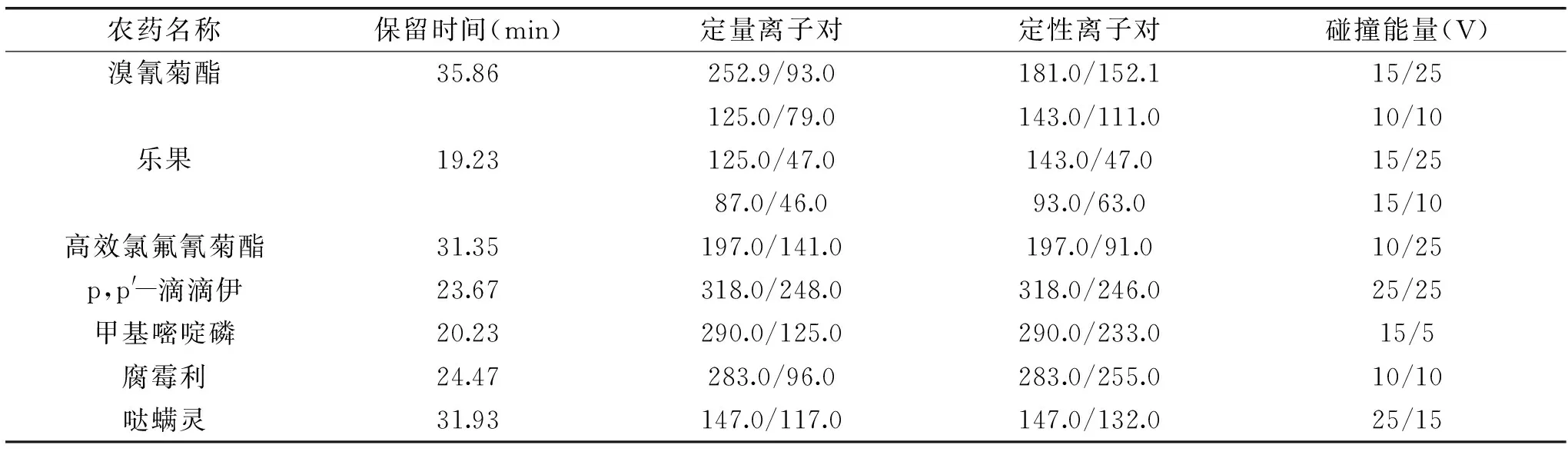
表2 GC-MS/MS测定7种农药的保留时间、离子对、碰撞能量Table 2 Retention times,ion pairs and collision energies of seven pesticides for GC-MS/MS
2 结果与分析
2.1 浸泡时间对农药提取效率影响的考察
茶叶样品中加入一定量乙腈溶剂,但在茶叶实际样品检测过程,由于样品均为茶叶粉末,加入乙腈提取液后立即均质提取,无法充分提取农药残留,本文着重考察了本方法中GC-MS/MS测定的7种农药在乙腈浸泡提取时间下农药残留的提取效率影响。
实验中采用含有溴氰菊酯、乐果、高效氯氟氰菊酯、p,p′-滴滴伊、甲基嘧啶磷、腐霉利和哒螨灵的茶叶标准物质(编号:19184,白茶)做浸泡提取效率实验,GC-MS/MS进行测定,对浸泡时间进行了优化。取7份阳性样品,加入乙腈提取溶剂,分别在0、30、60、120、180、240 min和浸泡过夜12 h后均质提取,提取含量相对于0 min时的相对含量值和时间关系见图1。结果可见,和未浸泡组比,乙腈浸泡30 min,溴氰菊酯、乐果、高效氯氟氰菊酯、甲基嘧啶磷和哒螨灵提取效率显著提高;从30~60 min,除溴氰菊酯的提取效率与浸泡30 min提取效率相比有所下降,其他6种农药在60 min提取效率均有明显提高,除了溴氰菊酯和p,p′-滴滴伊,另外5种农药在60 min时提取效率最高;茶叶样品浸泡60 min均质提取与直接均质提取相比,茶叶阳性样品中的7种农药的含量均有较大提高,综合考虑时间成本和提取效率,故本方法选择乙腈浸泡60 min后均质提取。本文针对文章中研究的7种农药提取效率进行优化,FAPAS能力验证样品中含有的农药多为茶叶样品常检出农药,所以针对样品农药的提取效率进行优化,对实际的检测工作会有一定的指导意义。
2.2 LC-MS/MS测定样品定容液的优化
在用LC-MS/MS对FAPAS茶叶标准物质(19184)进行测试的过程中发现,样品定容液的选择对LC-MS/MS测定农药的色谱峰形有一定的影响,特别是对极性较大农药的峰形有较大的影响。本文分别比较了乙腈-0.1%甲酸水溶液(2∶8,v/v)(a)、乙腈-0.1%甲酸水溶液(3∶2,v/v)(b)和乙腈-水(3∶2,v/v)(c)三种不同组成的定容液对啶虫脒、乐果、吡虫啉和灭多威这四种极性较大目标农药分离效果,四种农药的保留时间在2.90~4.07 min(见表1)。从图2可见,定容液对保留时间在2.90~4.07 min的大极性农药的峰形具有显著的影响,使用乙腈-0.1%甲酸水溶液(3∶2,v/v)(b)和乙腈-水(3∶2,v/v)(c)的定容液溶解样品时,保留时间在2.90~4.07 min出峰的农药,峰形较差,出现分叉峰。分析原因,可能是溶剂效应造成,由于样品溶剂为乙腈-0.1%甲酸水溶液(3∶2,v/v)和乙腈-水(3∶2,v/v)时溶剂的洗脱性太强,会导致样品溶液与流动相混合时,一部分样品随样品溶剂穿透分析柱(没有疏水保留),另一部分样品混入流动相,在分析柱上有保留,而本方法采用梯度洗脱的方式(见1.3.1梯度洗脱程序),在2.90~4.07 min流动相为乙腈-水(3∶7~2∶3,v/v)之间,定容液的极性与流动相极性相差较大,产生溶剂效应,可能是导致峰形变差的原因。而乙腈-0.1%甲酸水(2∶8,v/v)定容液极性与2.90~4.07 min流动相极性较接近,不会产生明显的溶剂效应,样品峰形良好,故本文方法LC-MS/MS选择乙腈-0.1%甲酸水(2∶8,v/v)作为定容液。

图2 4种农药在3种不同定容液下MRM谱图Fig.2 MRM chromatograms of four pesticides in three different solution注:a:定容液为乙腈-0.1%甲酸水溶液(2∶8,v/v);b:定容液为乙腈-0.1%甲酸水溶液(3∶2,v/v);c:定容液为乙腈-水(3∶2,v/v)。
2.3 基质效应
在GC-MS/MS和LC-MS/MS分析中,由于茶叶样品基质成分的存在,基质效应的存在不可避免。本次研究配制了50 μg/kg的茶叶基质的基质标准溶液以及同浓度的溶剂标准溶液,分别对两种仪器的基质效应进行考察。基质效应值在80%以下视为强基质抑制效应,在80%~120%之间视为弱基质效应,在120%以上视为强基质增加效应。通过实验发现,两台仪器测定的农药都表现出基质效应的影响,结果见图3。由于基质效应明显,实验采用基质匹配校准曲线对样品中的农药进行了定量分析,用以抵消基质效应的影响。

图3 两种方法测定茶叶中农药的基质效应评价Fig.3 Evaluation of matrix effects of pesticide in tea with the two methods
2.4 线性关系和定量限
按照1.2.1节方法处理阴性样品,获得空白基质样品。取不同体积的5 mg/L的混合标准溶液,加入空白基质样品中,按照1.2.3的定容方法分别定容液相色谱-串联质谱和气相色谱串联质谱检测样品。液相色谱-串联质谱结果显示,灭多威在10~200 μg/L,腐霉利在50~200 μg/L,其余4种在5~100 μg/L范围内呈现较好的线性关系,相关系数大于0.995(见表3),以信噪比(S/N)大于10且回收率和精密度较好的浓度点确定定量限(LOQ),其中灭多威为10 μg/kg,腐霉利为50 μg/kg,其余4种农药的LOQ为5 μg/kg。图4为空白基质中添加6种目标农药的MRM谱图,质量浓度均为各自的LOQ浓度。

表3 LC-MS/MS测定的6种农药的标准曲线、线性范围、相关系数、添加回收率、相对标准偏差和LOQTable 3 Linear equations,linear ranges,correlation coefficients(R2),recoveries,precisions (relative standard deviations,RSDs)and LOQs of six pesticides for LC-MS/MS

图4 LC-MS/MS测定的6种农药的基质标准溶液的MRM谱图Fig.4 MRM chromatograms of a matrix-matched standard solution of six pesticides for LC-MS/MS
气相色谱-串联质谱结果显示,溴氰菊酯在50~500 μg/kg,其余6种在10~300 μg/kg范围内呈现较好的线性关系,相关系数大于0.996(见表4),以信噪比(S/N)大于10且回收率和精密度较好的浓度点确定定量限(LOQ),其中溴氰菊酯为50 μg/kg,乐果和高效氯氟氰菊酯为10 μg/kg,哒螨灵为5 μg/kg,其他3种农药为0.5 μg/kg。图5为空白基质中添加内标TPP和7种目标农药的MRM谱图,质量浓度均为各自的LOQ浓度。

表4 GC-MS/MS测定的7种农药的标准曲线、线性范围、相关系数、添加回收率、相对标准偏差和LOQTable 4 Linear equations,linear ranges,correlation coefficients(R2),recoveries,precisions (relative standard deviations,RSDs)and LOQs of seven pesticides for GC-MS/MS
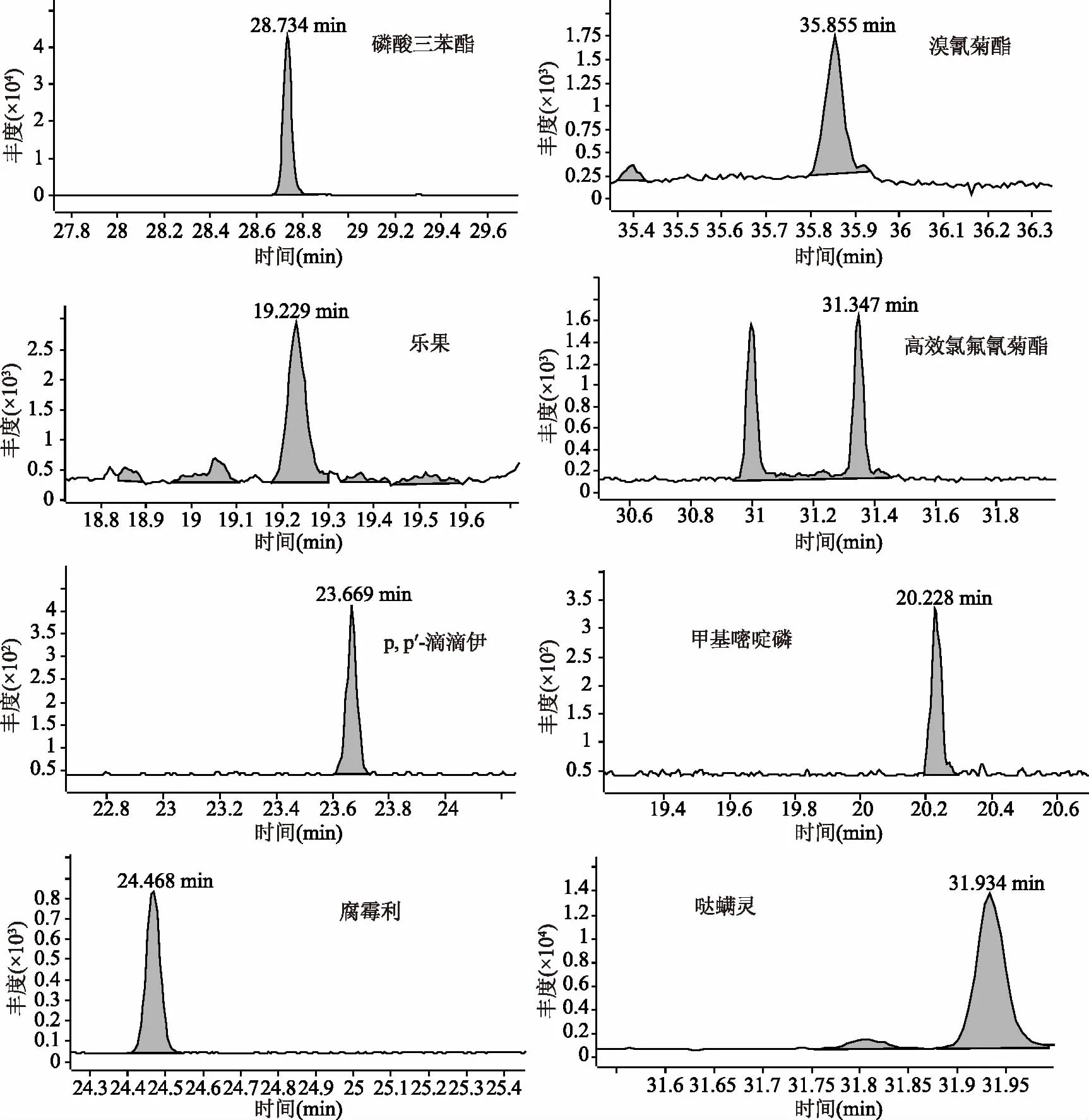
图5 GC-MS/MS测定的7种农药及内标的基质标准溶液的MRM谱图Fig.5 MRM chromatograms of a matrix-matched standard solution of seven pesticides and internal standards for GC-MS/MS
2.5 回收率和精密度
在空白茶叶样品中分别添加10、50、100 μg/kg 3个浓度水平的目标物进行回收率实验,液相色谱-串联质谱方法的回收率和相对标准偏差(RSD)见表3;在阴性茶叶样品中分别添加10、50、300 μg/kg 3个浓度水平的目标物进行回收率实验,气相色谱-串联质谱方法的回收率和相对标准偏差(RSD)见表4。
其中,乐果、甲基嘧啶磷和腐霉利三种农药GC-MS/MS和LC-MS/MS两种测定方法均能检测,对两种测定方法检测结果进行比对和偏差评估,检测结果比较见表5。

表5 GC-MS/MS和LC-MS/MS共检农药结果比较Table 5 Comparison of the results of common detection of pesticides by GC-MS/MS and LC-MS/MS
从表5可以看出,两种测定方法能够共检的3种农药测定值的RSD均小于7.1%,说明两种方法测定结果具有可比性和良好的一致性。
2.6 实际应用
将所建立的方法应用于FAPAS茶叶标准物质(19184)的能力测试,准确测定出本方法能够测定的8种农药并进行了准确定量,结果见表6。
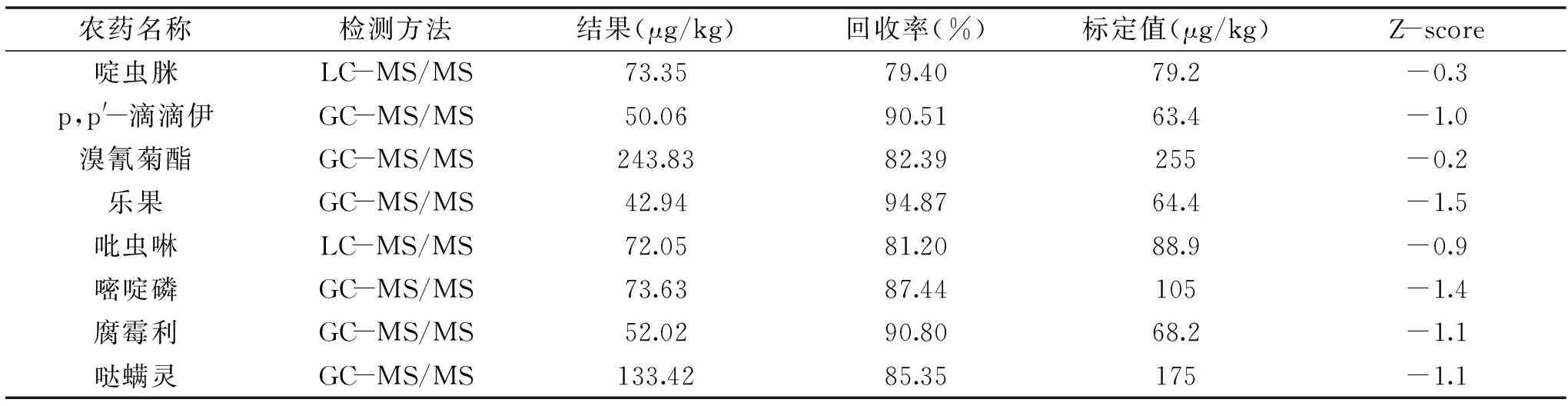
表6 FAPAS茶叶标准物质(19184)能力测试结果Table 6 Test results for FAPAS tea standard substance(19184)
3 结论
本文方法对茶叶样品在不同浸泡时间下农药提取效率进行了比较,通过乙腈浸泡提取时间的优化,更加有效、完全地提取残留的农药,对本文中所研究的大部分农药浸泡提取取得了较好的效果;通过对LC-MS/MS测定样品定容液的优化,改善了极性较大农药的峰形。本文建立了茶叶中啶虫脒、乐果、吡虫啉、灭多威、甲基嘧啶磷、腐霉利共6种农药残留的液相色谱-串联质谱(LC-MS/MS)测定方法和溴氰菊酯、乐果、高效氯氟氰菊酯、p,p′-滴滴伊、甲基嘧啶磷、腐霉利、哒螨灵共7种农药残留的气相色谱-串联质谱(GC-MS/MS)测定方法。该方法完善了茶叶中10种农药残留检测方法针对实际样品的检测,将建立的方法应用于FAPAS茶叶标准物质(19184)的能力测试,对该测试含有的8种农药进行了准确的定性和定量。虽然本次FAPAS验证提供的茶叶样品为白茶,但乙腈浸泡提取时间的优化主要针对茶叶里含有的农药,不同茶叶在基质效应上会存在一定差异,但对农药的提取效率是会有改善的。所以本文优化出的浸泡提取时间针对所研究的农药,在不同茶叶中均会有一定的参考价值。
