铁观音茶提取物对脂多糖诱导RAW264.7 细胞炎症反应的抑制作用及机制
2018-09-22蔡淑娴刘仲华
文 祎,王 振,蔡淑娴,刘仲华,*
(1.国家植物功能成分利用工程技术研究中心,湖南长沙 410128; 2.湖南省植物功能成分利用协同创新中心,湖南长沙 410128; 3.湖南农业大学园艺园林学院,湖南长沙410128)
近年来的研究表明,慢性、免疫病理性炎症对人体的伤害非常大,与很多疾病相关。日常饮食习惯、吸烟、肥胖、病毒感染等因素都可能会导致持续性低烈度系统炎症,这些炎症与心血管疾病、消耗性疾病、Ⅱ型糖尿病及肿瘤等疾病的发病危险率的显著升高密切相关,也是炎症性疾病如关节炎、哮喘等过敏症的病因。因此,致力于有效抑制病理性的炎症过程显得尤为重要。
铁观音品种是乌龙茶中的主要优良品种,素有“绿叶红镶边,七泡有余香”的美称[1]。随着现代社会的发展,饮用和品尝茶的消费者日渐增多,人们对茶的要求已逐渐从“温饱型”转向“美食型”和“保健型”。近年来,多项研究发现,茶多酚对治疗心血管炎症有很好的疗效,此外,茶多酚对骨关节炎、肠道炎、肾炎等[2]也具有显著疗效,其中表没食子儿茶素没食子酸酯(EGCG)生物活性最强,抗炎效果最佳。铁观音中富含茶多酚、茶氨酸、咖啡碱等多种活性成分,使得茶叶具备多种有效的保健功能[3-4],如降血脂、降血糖、防辐射、抗肿瘤等[5-7],其潜在功效机制除与抗氧化作用有关外,还与其抗炎作用密切相关[4]。国内外对于茶叶活性成分单体抗炎作用的研究颇多,可对于茶叶水提物的抗炎功能研究甚少。
为了更全面地了解安溪铁观音的抗炎保健功能,本实验以LPS诱导RAW264.7细胞建立炎症模型[8],并用吲哚美辛和不同浓度铁观音提取物处理,检测NO和IL-6的分泌情况,qPCR检测一氧化氮合酶(iNOS)、环氧合酶2(COX-2)、肿瘤坏死因子α(TNF-α)、单核细胞趋化蛋白1(MCP-1)、白细胞介素6(IL-6)mRNA相对表达,Western Blot检测炎症相关蛋白激酶(IKKβ),核转录因子κB抑制因子(IκB)、核转录因子κBp65(NFκB p65)及其磷酸化产物的相对表达,探究铁观音的体外抗炎活性及机制,为其防治炎症疾病、开发抗炎药物提供有效依据。
1 材料与方法
1.1 材料及仪器
RAW264.7小鼠巨噬细胞 中国医学科学院细胞中心;安溪铁观音 八马茶业股份有限公司;N,N-二甲基甲酰胺、甲醇、乙腈 国产分析纯;儿茶素、没食子酸、可可碱、茶碱标准品、LPS和吲哚美辛 Sigma公司;噻唑蓝(MTT)、qPCR引物 上海生工生物公司;DMEM培养基 Gibco公司;胎牛血清 BI公司;SYBR premix EX Taq试剂盒、RNA反转录试剂盒 日本TakaRa公司;IKKβ、IκB、p65、p-IKKβ、p-IκB、p-p65蛋白抗体 CST公司;NO检测试剂盒 碧云天试剂公司;总RNA提取试剂盒 全式金生物公司;IL-6ELISA试剂盒 博士德生物公司;HRP标记的二抗 Abcam公司;增强型ECL发光液 Engreen公司。
EL-131型旋转蒸发浓缩仪 Buchi公司;GAMMA1-20真空冷冻干燥机 CHRIST公司;紫外分光光度计、LC-2010AHT高效液相色谱仪 Shimadzu公司;opticlean-1300超净工作台 力康生物医疗科技控股有限公司;CO2培养箱 Nuaire公司;倒置显微镜 Leica公司;Rotor-Gene Q荧光定量PCR仪、Varioskan Flash多功能酶标仪 赛默飞世尔科技公司;Rotina380普通离心机 Hettich公司;精密电子天平 Starorius公司;FluorChem FC2化学发光凝胶成像系统 南京非同科学仪器有限公司。
1.2 实验方法
1.2.1 铁观音茶提取物的制备 称取铁观音茶样50 g,加入500 mL沸水水浴加热45 min,过滤后再加入250 mL沸水,水浴30 min,合并滤液经冷冻干燥30 h制成茶粉,-20 ℃保存备用。
1.2.2 铁观音茶提取物主要成分的测定 茶多酚的测定参照国家标准GB/T8313-2008;游离氨基酸的测定参照国家标准GB/T8314-2013;儿茶素组分、生物碱和没食子酸含量的测定采用HPLC检测法[9]。
1.2.3 细胞培养与分组 处理RAW264.7小鼠巨噬细胞系用DMEM培养基(含10%胎牛血清)培养传代,培养箱设置条件为37 ℃、5% CO2。将RAW264.7细胞接种于细胞培养皿上,培养24 h后进行分组处理,正常对照组:不做任何处理,正常培养24 h;炎症模型组:1 μg/mL脂多糖(LPS)持续刺激细胞24 h;阳性对照组:1 μg/mL LPS和20 μg/mL吲哚美辛[10]共同处理细胞24 h;铁观音茶提取物处理组:1 μg/mL LPS和不同浓度铁观音茶提取物(50、100、200 μg/mL)共同处理细胞24 h。
1.2.4 铁观音茶提取物对RAW264.7细胞活力的影响 RAW264.7细胞以1×104/孔的密度接种于96孔板,按上述分组给药,24 h后吸除上清液,每孔加入100 μL MTT(0.5 mg/mL)于培养箱内孵育4 h;再次吸除上清液,加入二甲基亚砜(DMSO)150 μL/孔于摇床上轻晃10 min,酶标仪检测吸光值(A490 nm)。根据公式计算细胞相对活力:细胞相对活力(%)=(处理组的吸光度/对照组吸光度)×100。
1.2.5 iNOS、COX2、TNF-α、MCP-1和IL-6基因表达的测定 提取各组细胞的总RNA,逆转录合成cDNA,荧光定量qPCR检测炎症因子iNOS、COX-2、TNF-α、MCP-1、IL-6mRNA相对表达,引物利用primer软件设计,并由上海生工生物技术公司合成,具体引物信息见表1。

表1 内参及目的基因荧光定量PCR反应的引物序列Table 1 Primer sequences of reference and target genes in qPCR reaction
荧光定量qPCR选用TaKaRa的SYBR premix EX Taq试剂盒,设置反应条件如下:95 ℃变性 10 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 20 s,重复反应40个循环;95 ℃ 30 s,55 ℃ 30 s,95 ℃ 30 s。每个标本均作三个复孔,复孔间的Ct值差异控制在0.5以内,选用2ΔΔCt法计算表达水平。
1.2.6 NO的分泌和IL-6的表达情况RAW264.7细胞系以1.5×105个/孔的密度接种于24孔板,按照上述分组处理细胞,24 h后收集细胞上清液200 μL/孔,按NO试剂盒和IL-6ELISA试剂盒说明操作,测定细胞上清液中NO和IL-6含量。
1.2.7 Western blot蛋白免疫印记分析 按上述分组处理细胞,48 h后收集细胞并RIPA裂解提取总蛋白,BCA试剂盒检测蛋白浓度并制成待测样品。用4.8%~10% SDS-PAGE胶电泳、湿转法转膜,5%脱脂奶粉封闭60 min,随后加入一抗(1∶1000)4 ℃孵育过夜,TBST洗涤三次后加二抗(1∶10000)于室温孵育1 h,再次充分洗涤后,加入200 μL ECL化学发光液,FluorChem FC2化学发光凝胶成像系统拍照,Image J软件进行条带灰度分析。
1.3 数据处理
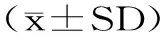
2 结果与分析
2.1 铁观音茶提取物中主要活性成分及组分含量
由表2可知,铁观音茶提取物中,茶多酚含量最高,达总量的59.27%,其次是游离氨基酸、生物碱。没食子酸和儿茶素是茶叶中多酚类物质的主要构成,铁观音茶提取物中没食子酸含量为0.58%,儿茶素组分含量有一定的差异,表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素没食子酸酯(GCG)、表没食子儿茶素(EGC)单体含量最高,其中EGCG达18.19%。咖啡碱是生物碱的主要组成部分,占水提物总量的9.79%,占生物碱总量的98.8%以上,茶叶水提物中几乎不含茶叶碱,可可碱含量甚微,主要原因可能是水提过程中咖啡碱极易浸出。
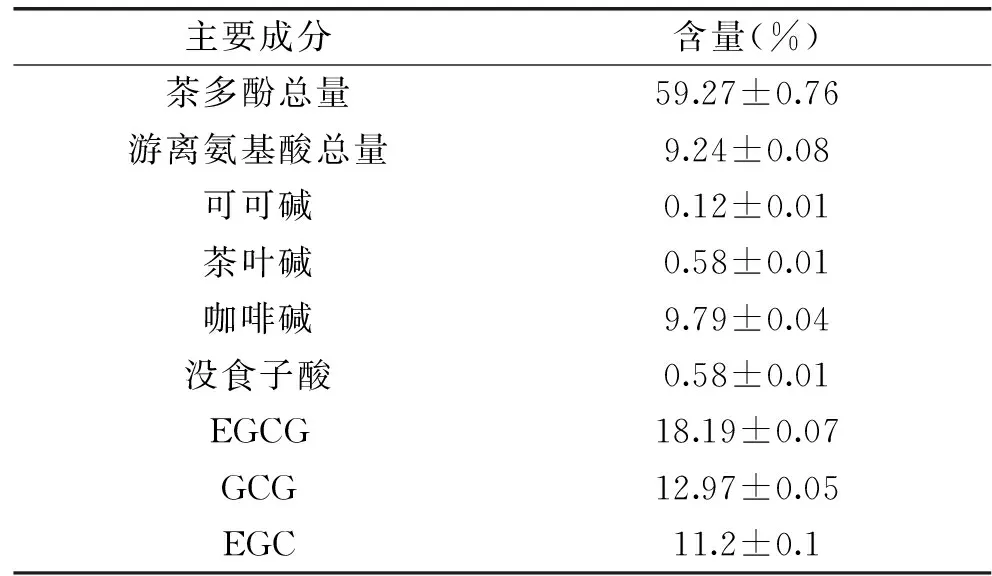
表2 铁观音茶提取物中主要活性成分及组分含量Table 2 Content of main active ingredients and components in Tieguanyin tea extract
2.2 铁观音茶提取物对RAW264.7小鼠巨噬细胞活力的影响
MTT法检测结果显示,铁观音茶提取物在50、100和200 μg/mL三个浓度剂量下,单独作用或与LPS共同作用处理24 h后对RAW264.7细胞的相对活力均无明显影响,表明在浓度范围内,铁观音茶提取物对细胞无毒性作用(图1)。

图1 不同浓度铁观音茶提取物 对RAW264.7细胞相对活力的影响Fig.1 Effect of Tieguanyin tea extracts on thecell viability of RAW264.7 cells
2.3 铁观音茶提取物对LPS诱导RAW264.7细胞中炎症因子的影响
LPS作为革兰氏阴性菌细胞壁的一种特有成分,能诱发细胞的炎症反应,在体外实验中多采用LPS诱导RAW64.7细胞作为炎症模型评价药物的抗炎活性[11]。诱导性一氧化氮合酶(iNOS)和环氧合酶-2(COX-2)是两个重要的炎症相关蛋白,在正常状态下几乎不表达,当炎症发生时,细胞被活化,诱导iNOS和COX-2基因和蛋白表达,加剧炎性损伤[12]。如图2所示,与正常对照组相比,模型组细胞中iNOS和COX-2 mRNA水平极显著升高(p<0.01);与模型组相比,阳性药物组和铁观音组均可明显降低iNOS和COX-2 mRNA的表达水平,对COX-2的表达影响呈剂量依赖性,然而铁观音茶提取物对LPS诱导iNOS转录水平升高的抑制作用极显著地弱于吲哚美辛(p<0.01)。

图2 铁观音茶提取物对LPS诱导RAW264.7细胞中 iNOS和COX-2 mRNA相对表达的影响Fig.2 Effect of Tieguanyin tea extracts on the mRNA expressions of iNOS and COX-2 in RAW264.7 cells after LPS stimulation注:模型组与对照组相比,##p<0.01;药物处理组 与模型组相比,*p<0.05,**p<0.01,***p<0.001。
小鼠巨噬细胞RAW264.7在LPS的诱导下激活,合成并释放出的大量炎症介质,产生的炎性相关因子如TNF-α、MCP-1、IL-6等相互促进,使得炎症反应进程加剧。如图3所示,与正常对照组相比,模型组细胞中TNF-α、IL-6、MCP-1mRNA水平极显著升高(p<0.01);阳性药物和50、100、200 μg/mL铁观音均可降低LPS诱导的TNF-α、IL-6、MCP-1mRNA表达水平升高,且铁观音茶提取物的作用效果呈剂量依赖性,铁观音高剂量组对IL-6和MCP-1mRNA水转录抑制作用优于吲哚美辛。本研究表明,铁观音茶取提物能够下调TNF-α、MCP-1、IL-6等炎症因子mRNA的表达,表明铁观音茶提取物能在基因水平抑制LPS诱导的巨噬细胞促炎因子的表达,具有很好的体外抗炎活性。
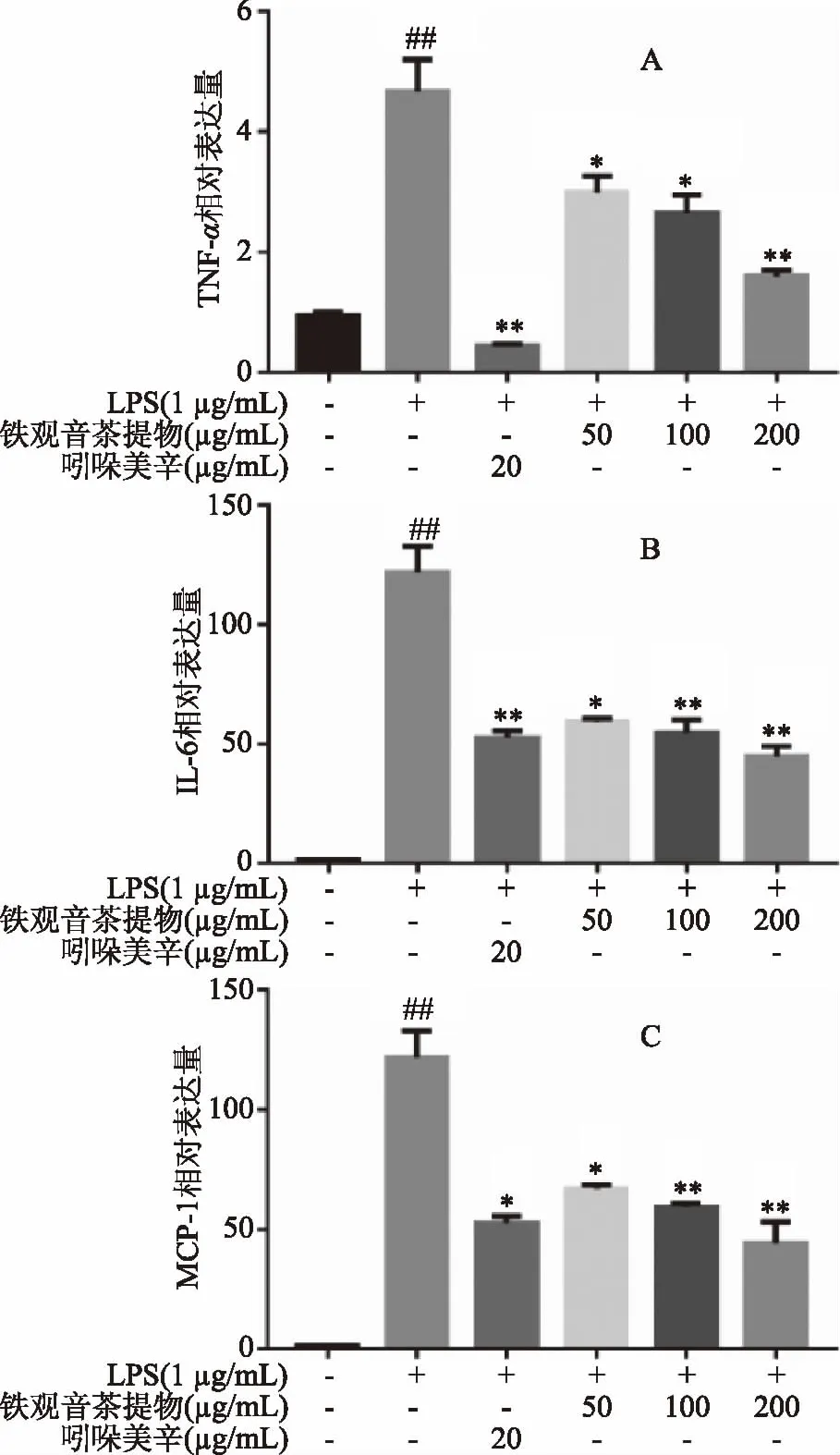
图3 铁观音茶提取物对LPS诱导RAW264.7细胞TNF-α、 IL-6、MCP-1mRNA相对表达的影响Fig.3 Effect of Tieguanyin tea extracts on the mRNA expressions of TNF-α,IL-6 and MCP-1 in RAW264.7 cells after LPS stimulation
2.4 铁观音茶提取物对LPS诱导RAW264.7细胞后NO和IL-6分泌表达的影响
NO是一种重要的炎症介导和调节因子,参与多种机体内的生理过程,如果长期处于高浓度状态会引发机体许多疾病;小鼠巨噬细胞RAW264.7在LPS的诱导下释放出的大量的促炎因子IL-6,IL-6的累积会使得炎症反应进程加剧。如图4所示,模型组细胞NO和IL-6的分泌均极显著高于正常组(p<0.01);与模型组相比,三个浓度的铁观音茶提取物均显著地抑制了RAW264.7细胞中NO和IL-6的分泌(p<0.05),且呈现出剂量依赖性,推测这可能与铁观音茶提取物能抑制环氧化酶信号途径的活化有关。

图4 铁观音茶提取物对LPS诱导的RAW264.7 细胞NO分泌及IL-6蛋白表达的影响Fig.4 Effect of Tieguanyin tea extracts on the secretions of NO and IL-6 in RAW264.7 cells after LPS stimulation
2.5 铁观音茶提取物对NF-κB炎症信号通路的影响
如图5(A)所示,经LPS(1 μg/mL)处理48 h后,细胞中IKKβ、IκB总蛋白无明显变化,而p-IKKβ和p-IκB相对表达量极显著升高(p<0.01),吲哚美辛和高浓度的铁观音茶提取物干预后,磷酸化产物p-IKKβ和p-IκB均极显著降低(p<0.01),说明铁观音茶提取物能抑制NF-κB信号通路的激活,为了验证这一点,继续检测p65和p-p65的蛋白表达,结果表明,高浓度铁观音茶提取物也能极显著抑制p65发生磷酸化作用(p<0.01),实验结果与茶叶活性成分抗炎的文献报道基本一致[13-14],且高浓度铁观音茶提取物的抗炎活性强于20 μg/mL的阳性药吲哚美辛。
图5 铁观音茶提取物对LPS诱导RAW264.7细胞后磷酸化IKKβ、IκB、p65相对表达的影响Fig.5 Effect of Tieguanyin tea extracts on the phosphorylation of IKKβ,IκB and p65 in RAW264.7 cells after LPS stimulation
3 讨论与结论
NO和IL-6是参与炎症反应的两个重要炎性介质,炎症发生时释放大量的NO和IL-6。NO的表达是通过其上游关键酶iNOS来控制的。本研究表明铁观音茶提取物能显著抑制LPS诱导RAW264.7 细胞NO和IL-6的释放(p<0.05),并进一步检测了铁观音茶提取物对NO的上游关键酶iNOS mRNA表达及促炎因子IL-6、TNF-α、MCP-1的mRNA表达的影响,结果表明,铁观音茶提取物对NO和IL-6等炎症因子的表达抑制是通过下调炎症相关蛋白iNOS和COX-2的基因表达和促炎因子IL-6、TNF-α、MCP-1的基因表达来实现的,且高浓度时抑制效果极显著(p<0.01)。
NF-κB信号通路是LPS刺激RAW264.7细胞产生炎症因子下游的一条重要通路,与促炎性酶如iNOS和COX-2等的表达及炎性细胞因子IL-6、TNF-α、MCP-1等的合成分泌密切相关。如图6所示,NF-κB是基因调控的炎症疾病中重要的核转录因子,蛋白家族包括p65、p50等,当NF-κB与NF-κB抑制蛋白IκB结合在一起时,细胞处于静息状态存在,细胞受到外界信号LPS刺激时,IκB发生磷酸化或泛素化被IκB激酶IKK降解,NF-κB核定位序列暴露,随之游离出来进入细胞核,并与其靶基因上游调控序列相结合,启动包括iNOS、IL-6、TNF-α、MCP-1、COX-2等炎症介质的转录与表达。
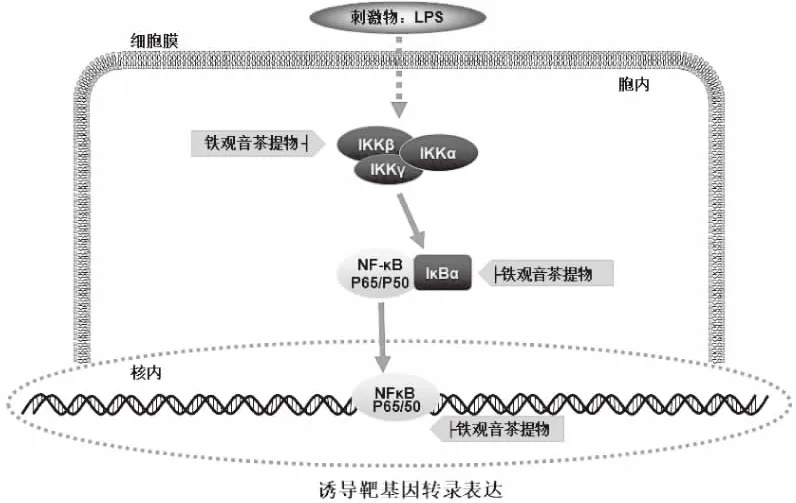
图6 铁观音茶提取物对NF-κB信号转导通路的调节作用Fig.6 Regulation of Tieguanyin tea extracts on NF-κB signaling pathways注:铁观音茶提取物┤指铁观音茶提取物具下调或抑制作用。 铁观音茶提取物可有效抑制IKK、IκB和NF-κB p65 磷酸化来阻断NF-κB的激活,使其发挥显著的抗炎功效。
铁观音茶提取物含有大量的茶多酚、氨基酸和生物碱,而这些活性成分在很多体外细胞实验和体内动物实验中,已被证实可通过抑制NF-κB通路的激活而表现出来一定程度的抗炎功效[8,15-16]。本实验发现,铁观音茶提取物也是通过抑制NF-κB信号通路发挥作用,即抑制上游蛋白IKKβ和IκB的磷酸化,减少NF-κB p65蛋白的激活,进而减少NF-κB p65与靶基因结合后产生释放各种炎症因子,从而发挥显著的抗炎作用,且高浓度铁观音茶提取物的抗炎活性强于20 μg/mL的阳性药吲哚美辛。
本论文只是单一的从体外方面研究了铁观音茶提取物的抗炎作用和机制,仍需有进一步的动物实验进行验证,且在分子作用机制的研究中未检测NF-κB p50等蛋白的表达和NF-κB核转位情况,因此还需进一步加深研究以便充分开发铁观音茶提取物的抗炎活性。综上所述,本实验探讨铁观音茶的抗炎作用,并初步阐明了其抗炎作用机制,这对今后炎症相关疾病的研究、防治及开发具有抗炎作用的药物等具有参考意义。
