适度破碎微藻细胞释放 功能性蛋白的技术研究进展
2018-09-22曾剑华石彦国辛嘉英
曾剑华,杨 杨,石彦国,辛嘉英,2,*
(1.哈尔滨商业大学,食品科学与工程重点实验室,黑龙江哈尔滨 150076; 2.中国科学院,兰州化学物理研究所羰基合成和选择氧化国家重点实验室,甘肃兰州 730000)
近年来,人口的激增增加了人们对能源、食品等资源的需求,诸如石油、天然气等不可再生资源面临着巨大的压力;微藻具有生长速度快、产量高及不占耕地等特性[1],且能缓解温室效应[2];在开发生物柴油能源方面具有广阔的前景,是不可再生资源替代品;同时微藻蛋白等活性物质作为保健品、药品和化妆品等行业的原料来源也具有很大潜力,因此微藻成为国内外研究热点[3-4];微藻的主要功效成分包括多不饱和脂肪酸、多糖、蛋白质等[5-8];而促进健康作用的大多数功能组分与蛋白质或肽相关[9];因此,具有广谱生物学特性如抗高血压、抗肿瘤以及治疗心血管疾病的微藻生物功能蛋白质和肽类备受关注[10-11]。
微藻细胞壁的结构和组成对胞内生物分子的释放和提取有重要影响[12-15]。例如,螺旋藻细胞壁是由肽聚糖组成,其稳定性比细胞壁由纤维素组成的微拟球藻和二形栅藻差,微藻破壁后蛋白提取率为74%;但是二形栅藻有双层细胞壁结构,细胞壁较坚固,其蛋白质得率最低仅为17%[16]。可见微藻细胞轻度破碎技术的选择与微藻细胞壁的结构特征有关。目标物质的数量和质量也与细胞破碎方式密切相关[15-18],为突破这一限制,首先必须采取适当的技术破碎细胞壁打开细胞膜,最大限度地释放目标物质。
此外,细胞破碎技术的选择除了考虑微藻复杂的细胞壁结构外,很大程度上还取决于目标物质的功能性质[19]。采取轻度细胞壁破碎技术,从微藻中获得可观的蛋白质提取率同时还能保持蛋白质的生物活性[20];由此,基于微藻的生物炼制技术可以实现将生物质转化为各种高附加值产品[21]。
微藻作为多种生物制品原料具有很大潜力,但其刚性细胞壁阻碍了胞内物质的有效释放,至今对轻度破碎微藻细胞释放蛋白质等活性物质尚无高效技术,因而微藻的商业化应用尚处于初级阶段[22]。目前,国内外多数研究致力于开发具有经济效益的微藻上游加工技术[23-24],微藻在生物燃料方面研究成果颇丰[25-26],而关于微藻轻度细胞破碎和生物功能蛋白质的回收方面报道还较少[12,27]。这也是微藻深加工利用的瓶颈所在;本综述探了微藻的轻度细胞破碎方法释放功能性蛋白质的最新进展和研究方向,对传统和新兴的轻度细胞破碎技术进行比对分析,提出今后可能的发展方向。
1 微藻概述
1.1 微藻的类型
微藻(microalgae)是一类单细胞生物,海洋和淡水均存在微藻,直径通常小于1 mm;根据生长规模,藻类分为两类:微藻类和大型藻类;根据营养方式可分为三类,即自养、异养和混合营养[19]。大多数微藻是自养的,在适宜的光照条件下,能利用二氧化碳和无机营养物质等进行代谢活动产生有机化合物,如碳水化合物、脂肪和蛋白质等[2-3]。异养与自养相反,它们不能固定碳,因此需要提供有机碳源,例如葡萄糖等,作为生命代谢能量来源;微藻的异养培养是高附加值化合物原料的主要来源[28]。大规模培养用于商业化的藻类称为商业微藻,包括四个微藻属,绿藻门(Chlorophyta)、红藻门(Rhodophyta)、定鞭藻门(Haptonema)和原生藻属(Catenella)[29]。
1.2 微藻的主要成分
微藻含有蛋白质、脂质、碳水化合物、色素、无机盐以及维生素等成分;主要成分为蛋白质、碳水化合物和脂质。表1为常见食物和藻类组成成分表。据研究显示,蛋白质是微藻生物量的主要成分(通常为干重的40%~60%),其次是脂质和碳水化合物。微藻具有合成所有类型氨基酸的能力,能提供人体所需的所有必需氨基酸,由此,微藻蛋白在某种程度上优于大多动植物蛋白。微藻蛋白在保健品、药品等行业的应用也越来越广泛[30]。
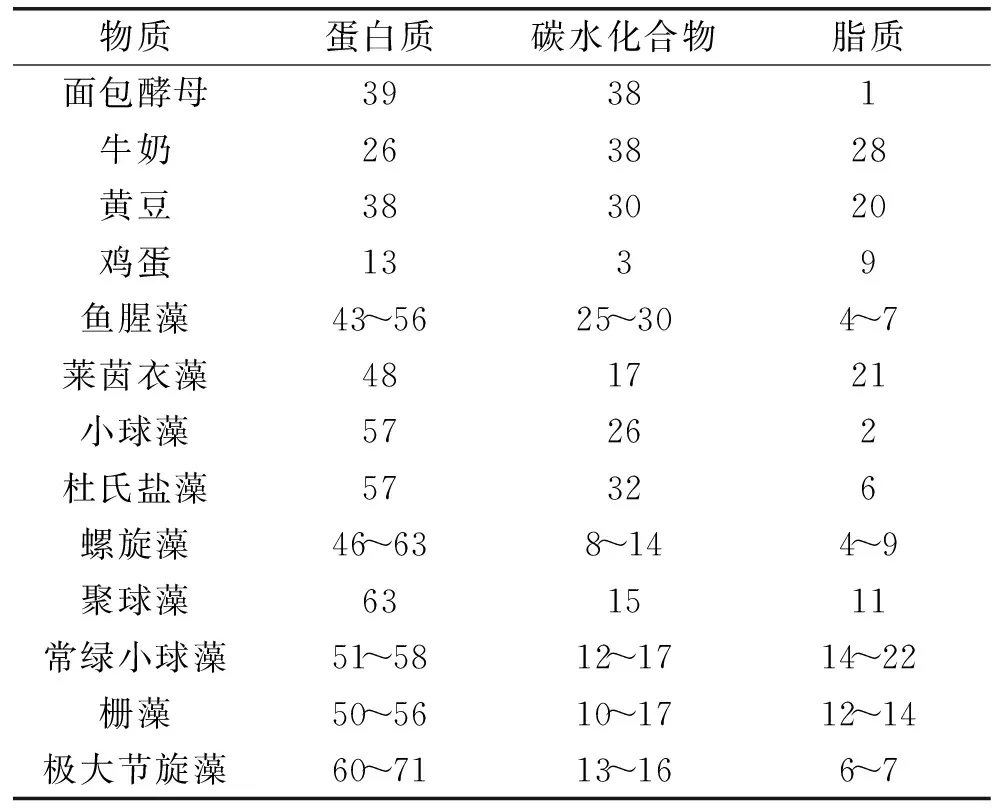
表1 常见食物和藻类组成成分(%,干重)Table 1 General composition of different algae and common food(%,DW)
1.3 微藻细胞壁
细胞壁是保持细胞完整性以及抵御入侵者和在恶劣环境下的主要保护屏障。结构复杂的细胞壁通常是由多糖(如纤维素)、果胶、甘露糖、木聚糖、矿物质(钙、镁或硅酸盐)、蛋白质(如糖蛋白)等组成,具有机械强度高且化学耐性强等特点[31]。藻类细胞壁的组成和结构是复杂多变的,从微小单层细胞膜到多层复合嵌套结构;了解藻类细胞壁结构性质对生物破碎具有重要意义,可以有针对性地选择适宜的轻度细胞破碎技术,以增大提取率和更好的保护目标产物的生物活性;但是大多数微藻细胞壁结构性质仍不是很清楚[32]。表2为4种常用微藻的细胞壁特征、主要成分及其主要用途。

表2 4种微藻细胞壁特征、成分及其主要用途[14,33]Table 2 Characteristics and components of four microalgae cell walls and their main applications[14,33]
2 微藻蛋白的功能及其应用
微藻蛋白具有抗氧化、抗高血压、抗肿瘤等多种功能,食品、保健品、药品和化妆品等行业具有广泛的应用前景。
微藻蛋白质在数量和质量方面与大豆、鸡蛋和鱼类等常规食品蛋白相当、甚至更好,且微藻蛋白的氨基酸含量均衡,而被认为是蛋白质的重要替补来源。目前,微藻蛋白以藻类生物质的形式或作为提取的蛋白质形式,已经用于食品和饲料中。如,螺旋藻、小球藻、杜氏盐藻等藻类蛋白作为食品添加剂已被美国食品药品监督管理局(FDA)认可[33];利用杜氏盐藻生产β-类胡萝卜素制成添加剂用于产蛋鸡的饲料中,可以使蛋黄颜色更鲜艳[34]。
微藻蛋白用于化妆品产品的开发也具有很大的发展潜力,目前关于螺旋藻、小球藻和杜氏盐藻等藻类蛋白水解产生的类菌孢素氨基酸(MAAs)的研究显示,(MAAs)可以减少紫外线对皮肤的伤害,表明MAAs具有一定的抗氧化作用[35-36]。
微藻蛋白不仅用于饲料、食品和化妆品行业,研究表明,由于蛋白质及其水解产物或浓缩物和肽产品能够抑制肾素、血管紧张素、醛固酮系统(RAAS)内的酶并降低血压[37]。此外,在紫外线照射皮肤成纤维细胞试验研究中,用小球藻蛋白衍生的肽混合物(5、10 mg/L)处理的皮肤细胞在72 h内显示出100%的细胞保护作用[38];小球藻蛋白质水解产生的五肽(Leu-Asn-Gly-Asp-Val-Trp)在体外过氧自由基和DPPH自由基清除实验,以及猴肾细胞中的细胞内自由基清除活性显示具有强烈自由基清除能力[39]。因此蛋白质、蛋白质水解浓缩物和肽产品具有抗氧化、抗高血压等功效,其在药品工业中的应用也越来越多。
基于微藻活性物质多种功能特性,微藻蛋白或将进一步用于抗病毒研究如埃博拉病毒、HIV病毒的研究。已有关于微藻代谢物用于HIV病毒的研究报道。例如Deniz等[40]研究显示,螺旋藻水提取物能抑制人T细胞系外周血单核细胞和郎格尔汉细胞中HIV-1 的复制。Matip等研究表明每日平衡膳食组合补充螺旋藻饮食已显著增加了CD4细胞和6个月后 HIV病毒量显著降低[41]。
3 微藻轻度破碎技术
微藻的生物降解受到刚性细胞壁的限制,为促进胞内物质释放,尤其是微藻生物活性物质如蛋白质、多不饱和脂肪酸、色素等的溶出,必须对微藻细胞壁进行降解甚至破碎。微藻是真核细胞,其细胞壁与原核细胞不同,细胞壁韧性对机械破碎和化学破碎具有相当大的抵抗力。加大机械或者化学破碎力度虽能促进胞内物质的释放,但是这势必影响微藻蛋白等活性物质的活性;同样机械破碎力度增大会增加能耗而增加经济成本;由此,轻度细胞破碎技术成了关键,既要最大限度释放胞内物质以获得最大回收率,又要保持微藻蛋白的生物活性,还要考虑技术的扩大及经济可行性。
在传统细胞破碎的方法基础上,基于提取胞内活性物质原则筛选出温和的轻度细胞破碎技术;根据细胞破碎技术发展将其分为传统现有技术和新兴潜在细胞破碎技术。从传统细胞破碎技术中挑选出珠磨法、高压匀浆技术、超声法、离子液体和酶解法的作为代表;选择流体空化技术、微流法、脉冲处理技术和阳离子聚合物涂抹法作为潜在的微藻细胞破碎技术代表。
3.1 现有温和、轻度细胞破碎技术
3.1.1 珠磨法 珠磨法一种机械细胞破碎方法,所用设备为球磨机,小球直径通常小于1 mm;经过搅拌器使得微藻细胞悬液与珠子之间充分混合,通过珠子与细胞之间的互相碰撞、剪切,造成细胞壁破裂促进胞内物质溶出[42]。珠磨法由于细胞破碎率高、通量高以及良好的温度控制而备受关注,且劳动力强度低、细胞破碎连续化程度高,易于工业化实施。市售设备最常见的设计如图1所示。球磨机轴可以携带不同设计(同心或偏心盘或环)的搅拌器,将动能输出到腔室中的小钢珠、玻璃珠或陶瓷珠[1]。

图1 球磨机阀座示意图Fig.1 Valve seat schematic of bead mill
细胞破碎之后,珠子可通过重力从搅拌溶液中分离。在处理热敏产品时,在中断过程中需要有效的冷却装置,防止蛋白质等活性物质变性失活。因球磨机研磨室配有冷却装置,其摩擦热可以通过冷却盘管去除,被认为是生物炼制的有效的轻度破碎技术。
目前,珠磨法主要用于研究微藻细胞的脂质提取,因而少有研究者关注珠磨法温和的细胞破碎条件[20]。迄今为止,使用珠磨机温和、轻度破碎微藻细胞壁释放微藻蛋白等活性成分的研究已有报道[42]。Safi等[43]在微拟球藻细胞破碎能耗及水溶性蛋白溶出的研究表明,珠磨法在20 min内细胞破碎率达到95%以上,蛋白质提取率为53%。值得注意的是,蛋白质释放的一级动力学常数(k=1.2 min-1)是细胞破碎动力学常数的6倍(k=0.21 min-1),表明细胞完全破碎不是完全释放细胞内蛋白质的先决条件;修正一阶动力学模型后的比能量输入为0.43 kWh/kg生物量。此外Postma等[44]关于用珠磨法破碎微藻细胞壁的珠粒直径大小研究表明,珠粒直径减小,蛋白质释放率呈增大趋势,能量呈下降趋势;当珠粒直径为0.4 mm时,小球藻破碎率达97%,蛋白质提取率最大,为57%,能耗为0.72 kWh/K WD。减小珠粒的尺寸将同时增加珠粒和细胞之间的接触面积,因此,细胞破碎将加速且能量输入降低。最新研究成果均比之前Postma[45]等用珠磨法得到小球藻蛋白质提取率(30%~42%)要高。
珠磨机虽然可以实现高效率的细胞破碎,也能连续生产化;但是当大规模应用时,该技术将消耗大量的能量。操作参数如转速、进料速度、珠子直径与用量以及参数之间的内在联系等也会对细胞破碎效率产生影响,从而影响细胞破碎过程的总体成本。
3.1.2 高压匀浆法(HPH) HPH法已广泛应用于乳制品行业以减少乳化脂肪微粒的大小以及灭菌处理,因此可应用于高浓度(20%~25%,w/w)的藻类糊剂[46]。HPH特别适用于具有刚性细胞壁的微藻细胞破碎;在高压匀浆阀座单元中,在高压室(150~400 MPa)细胞悬浮液被迫流过中心小孔,撞击冲击环,被迫改变方向从出口管流出;在阀座和冲击环的硬表面上冲击细胞形成湍流、高压剪切力,之后压力突然下降使得细胞内气泡瞬间的释放,同时伴随流速下降而引起气泡形成和崩溃的空化效应最终导致了细胞的破碎[46-47]。
HPH作为一种相对简单的微藻细胞破裂技术,已经广泛于微藻油脂的提取。Yap[47]等关于HPH用于微藻细胞破碎工业化的评估结果表明,在60 MPa、藻浆浓度25%(w/w)、三酰甘油(TAG)含量为30%的条件下,用高压匀浆机破碎微拟球藻,能耗与产出比为0.06(MJHPH/MJTAG)。Coons等[48]研究发现高压匀浆技术不适合微藻细胞破碎工业化应用。这两个研究结论相反,差别在于Coons等研究的藻浆浓度为4%,而Benjamin等人研究的藻浆浓度为25%。Benjamin等人研究还发现,随着藻浆浓度(<25% w/w)的增大,能耗呈下降趋势,这大大降低了高压匀浆的能量需求,其研究成果也为HPH工业化提取微藻脂质提供了有力的支持。
HPH很早就用于酵母细胞破碎和蛋白质回收[49];HPH作为轻度破碎技术用于微藻细胞破碎以及生物活性物质蛋白质释放的研究报道也越来越多。Safi[12]等对比了高压匀浆技术以及碱处理的方法提取五种微藻蛋白,结果显示,HPH处理后的蛋白提取率均高于碱处理,HPH处理后水溶性蛋白溶出率最大值来自紫球藻为88%,最小值来自红球藻为40%(27%);而碱处理后对应的蛋白溶出率分别为76%和27%;HPH处理对应的提取率分别为51%和41%。Safi[17]等通过手动研磨、超声处理、化学处理以及高压匀浆这四种技术对上述五种微藻进行细胞破碎,试验结果同样显示,高压匀浆技术拥有最高的蛋白质溶出率,最大值来自紫球藻90%,微拟球藻则为52%,最小值来自红球藻41%;三种微藻蛋白提取率分别为53%、25%和21%。这些结果均表明HPH是微藻细胞破碎最有效的技术。为进一步证实高压匀浆技是最适细胞破碎技术,Safi[43]等随后对微拟球藻细胞破碎的能耗以及水溶性蛋白释放进行研究,HPH细胞破碎率大于95%,蛋白质提取率则均在50%左右;HPH比能耗低至0.32 kWh/kg WD,该结果与Yap等[47]的研究结果相一致,为高压匀浆技术微藻细胞破碎工业化应用提供了有力的数据支撑。
为进一步提高HPH处理微藻细胞破碎后的蛋白溶出,可以使用组合技术手段,如将HPH和酶处理等相结合以提高水溶性蛋白质的提取率。
3.1.3 超声处理法 超声波处理技术由于在处理低剂量样品时操作简便、损失较少,在实验室已普遍应用于细胞破碎处理。超声波能用于破碎细胞壁归功于超声波产生的微尺度涡流和高效传质,以及气泡的生成、变大到最后的破碎形成的空化效应。超声波通过将微藻暴露于高强度的超声波而引起细胞破裂,致使液体介质细胞产生微小的不稳定的空化气泡,由于空化效应,气泡爆炸产生冲击波和能量,形成的高剪切力最终破坏刚性细胞壁并释放胞内物质[50]。
超声处理技术已被广泛用于促进黄酮、多糖[51-52]等生物活性物质的溶出,且均显示出良好的试验结果。由此,超声波处理技术被认为是一种有效的细胞破碎技术,进而被尝试应用于微藻细胞破碎,期望可以加大胞内物质的溶出;然而近来的研究结果表明,单独使用超声处理技术效果并不是很理想。Zuhair[53]等用超声提取微藻蛋白的结果显示,在1000 W条件下超声3 min,栅藻和莱茵衣藻的蛋白提取率能达到70%以上;其他藻类如微拟球藻和小球藻等效果较差,蛋白提取率在30%左右。该结果证实了,在大功率下超声能对微藻细胞进行破碎。
超声处理技术一般结合其他处理技术进行细胞破碎,从而获得更好的结果。如Ruilin-Zhang等[54]使用不同技术组合提取微藻蛋白的研究结果表明,单一使用超声技术在超声功率600 W,超声6 s,间隔9 s,处理30 min,蛋白质提取率为20%,远大于Lee等[52]对小球藻蛋白的提取率(<10%)。冻融技术和超声处理相结合,蛋白质提取率为23%;酶消化和超声提取结合,蛋白提取率为30%;醇提、酶消化、超声和均质提取组合,蛋白质提取率为72%。该结果远优于Safi等[43]小球藻蛋白提取率为50%的研究结果;也是近年来小球藻蛋白提取率的最高的研究成果。不同的组合显示了不同的蛋白质提取率,其机制尚不清楚,还有待于进一步研究。
3.1.4 离子液体处理法 细胞破碎可以由各种化合物如抗生素、螯合剂、离子液体、有机溶剂、次氯酸盐、酸和碱引起。
有机溶剂萃取黄酮、多糖、色素等活性成分是常用化学方法,如Ruilin-Zhang等[54]的用在固液比为1∶10 (w/v),通过醇提、以及碳酸钠提取24 h的研究结果显示,醇提蛋白质提取率为28%;结果高于机械处理所得的蛋白质提取率。然而有机溶剂通常会使得蛋白质发生不可逆转变性,因此处理过程要快,时间过长则导致失活。而离子液体处理蛋白质的变性是可逆的,且其能保持相对稳定的pH以及适宜的温度。
离子液体是传统溶剂的环保替代品,在0~140 ℃是液态的有机盐,由大的不对称有机阳离子和有机/无机阴离子组成。它们可以通过选择阳离子或阴离子成分来调整特定的溶解度、电导率、极性和疏水性。此外,离子液体还具以下独特性质:熔点低、挥发性极低、不可燃、热稳定性和化学稳定性高的特点;且能够将极性化合物溶解于非极性体系中[55]。这些特点使其成为常规溶剂的最佳选择,因此可将离子液体处理法用于适度破碎微藻细胞。
Lee等[56]将离子液体缓冲液配合超声处理破碎小球藻细胞提取和回收蛋白质结果显示,在单独使用3-(N-吗啉)丙磺酸胆碱-盐酸等离子液体缓冲液时,蛋白质回收率均低于10%;上清液的紫外谱图在650 nm处有吸收峰,表明离子液体缓冲液对蛋白质并不是高度选择转一性,叶绿素在其中起到主要的干扰作用。而当3-(N-吗啉)丙磺酸胆碱-盐酸等离子液体缓冲液与超声处理配合使用时,设定参数离子液体浓度为50 mmol/L、超声时间为30 s、超声功率为400 W以及藻浆浓度为6 g/L,蛋白质提取率为25.3% WD,蛋白质回收率达到95%。实验结果较好,所用的试剂相对于传统离子液体而言较便宜,且属于可再生资源;有研究表明,回收的离子液体还再次用于细胞破碎,效果与新配制的离子液体等同[57],而且其能力不会随着使用次数的加大而减少,这无异于给下游加工技术节约成本打开了一条新道路。但是如何回收3-(N-吗啉)丙磺酸胆碱-盐酸等离子液体也将成为一个问题。
3.1.5 酶处理法 酶由于处理条件温和、选择性高,同时也易于扩大生产规模,很早就被用于细胞破碎研究;但是酶处理成本相对较高,也不易于选择转一性很高的单一酶处理某一种微藻,这给微藻细胞破碎带来了一定的困难。
酶处理由于具有温和的技术条件以及良好的产出效果,被用于微藻细胞破碎及其蛋白质回收应用。Ruilin-Zhang等[54]用单一的纤维素酶处理小球藻提取蛋白质,结果显示,蛋白质提取率仅为17%,其效果低于溶剂以及超声提取。为进一步提高蛋白质提取率,将酶处理与机械处理技术相结合,得到酶处理与超声处理组合的结果最高,蛋白质提取率为30%;继续优化并增加组合得出,酶处理结合60%乙醇浸泡、超声和均质处理时,蛋白质提取率达到最大值72%。
而Zuhair[53]等用溶菌酶和纤维素酶处理各种微藻提取蛋白质,研究结果显示,溶菌酶处理16 h后的四种微藻蛋白质的回收率在79%~97%之间;显示出更高的产率,这可能是由于溶菌酶和纤维素酶的专一性水解微藻引起的。Sierra等[27]用酶处理莱茵衣藻提取蛋白质和脂质的最新研究结果显示,通过自溶酶处理的蛋白质提取率为95%;单一自溶酶处理效果优于超声处理。该研究为克服酶的高成本,利用原位酶生产自溶酶,不但降低成本,而且专一性高。这为酶处理的选择性提供了一条新思路。
在考虑酶处理成本问题上,除了利用原位酶生产具有高度专一性的酶外,还可以使用固定化酶,降低所需酶的量,并且减少下游过程成本。然而,影响酶处理微藻破碎效率的缺点之一是处理时间长,因此与机械或化学处理相比,生产能力较低。
3.2 温和、轻度细胞破碎新技术
由于微藻经济利用价值越来越显著,综合开发利用微藻胞内所有物质已成为趋势。近几十年来研究表明,现有的技术方法不足以满足或不适宜全面开发利用微藻的需求;因此寻求与开发新温和有效的微藻细胞破碎技术成为当前提取微藻生物活性物质的关键。目前已有一些新技术用于微藻细胞破碎,包括超临界流体法、微流法、脉冲处理技术和阳离子聚合物涂层膜破碎细胞。
3.2.1 流体空化法 超临界流体是指物质在高于临界温度和临界压力时形成的兼具气液两相性质的流体,因而具有良好的溶解特性以及扩散性。超临界流体技术被广泛地用于中药和天然产物活性物质的萃取[58]。传统的细胞破碎技术如高压匀浆技术、球磨法、超声处理等会在操作过程中产生大量能量或出现局部过热现象,这对提取生物活性物质是不利的;酶法处理则不可避免地引入杂质,增加了分离的工作量,而导致成本增加。而超临界流体细胞破碎技术则很好地避免了上述问题。超临界流体常用的有CO2、N2等;超临界流体破碎细胞是将高压CO2渗透到细胞内,突然降压使细胞内外压差急剧增大而膨胀破裂;对于细胞壁较厚的微生物,因CO2能破坏胞壁上的脂溶性成分,破碎后的细胞碎片较大,便于下游分离;同时在降压过程中流体体积膨胀、温度降低,可防止因升温引起生物活性物质失活。
Duarte等[59]用不同破碎技术提取酵母脂质的研究结果表明,超声辅助CO2超临界流体萃取酵母脂质的提取率为20%;但比Milanesio[60]单用超临界流体萃取酵母得到脂质提取率为10%的高。超临界流体细胞破碎技术与传统技术如有机溶剂萃取、机械破碎等方法相比提取率虽小,但是与传统技术手段相比还是存在一定的优势,如何进一步探索出更有效的超临界流体细胞破碎技术组合将是下一步研究的内容[61]。如Dierkes等[62]进行的一项实验中,超临界CO2流体能够有效地破坏淋球菌,使细胞内容物的释放。得到脂质和虾青素的产率在分别在72.3%~92.6%和80%~100%之间。如此高效的破碎能力将使得超临界流体作为适用于温和的细胞破碎技术具有极大的潜能。
3.2.2 微流化处理法 微流化处理法用于破碎微藻细胞是最近兴起的细胞破碎技术,微流化均质操作原理与高压均质不同[45];在微流化器中,两股细胞悬浮液高速撞击在固定表面,冲击时能量瞬间消散而导致细胞破裂;细胞破碎的率取决于初始细胞浓度、通过的次数和压力。因破碎室区域温度最高,细胞悬浮液在破碎室中停留只有25~40 s;将破碎细胞液浸入冰水浴中,可防止活性物质失活。
Cha等[63]用微流化处理小球藻提取叶黄素的研究结果显示,微流化处理提高了小球藻在消化过程中叶黄素胶束化效率,经68.96 MPa微流化处理后,电镜结果显示,小球藻粒径由3.56 μm下降到0.35 μm。经137.9 MPa微流化处理后,叶黄素胶束化效率提高三倍,且叶黄素稳定性不受微流化影响。结果显示,微流化处理法能极其有效地破碎小球藻,有效地提高了叶黄素的提取率。Cha[64]等在模拟微流化对小球藻类胡萝卜素的生物消化过程影响实验证实了其前期试验结果;在137.9 MPa微流化处理后微藻平均粒径从2463 nm下降至361 nm;玉米黄素和类胡萝卜素模拟消化率由原来未经处理的2.60%和1.69%分别提高到32.60%和18.19%。
这些结果均表明,微流化可有效地破碎小球藻细胞壁和提高玉米黄素和β-胡萝卜素等生活性物质的提取率。如Xia N等[65]通过酶辅助微流化制备大米蛋白,蛋白回收率高达81.87%,主要为谷蛋白且具有天然结构;这些结果表明,酶辅助微流化可能是非破坏性和选择性提取水稻谷蛋白的有效技术。这也为微流化处理微藻提取活性蛋白提供借鉴。
3.2.3 脉冲电场处理法 脉冲电场用于微藻细胞破碎的研究还在起步阶段;脉冲电场(PEF)或高强度电场脉冲(HELP)使用外部电场引起细胞膜或壁上的电场强度达到一定阈值后,电场诱导的张力诱导膜或细胞壁形成电穿孔,细胞的通透性增加,使胞内物质更容易释放出来[65]。电穿孔的大小和数量与电场强度和脉冲直接相关;且电穿孔的形成是不可逆的。PEF不仅破坏细胞壁,而且还影响细胞内的分子;如PEF处理过程温度升高而影响酶的活性,导致蛋白质等高价值物质消化率降低,从而提高脂质和蛋白质等物质的产率[1]。
张若兵等[66]用高压脉冲电场破碎小球藻的研究表明,高压脉冲电场强度和脉冲注入能量密度是影响高压脉冲电场处理效果的关键因素,而脉冲宽度、脉冲重复频率、电场极性对小球藻的处理效果影响不大。这与Lam等[67]研究脉冲电场处理效果的关键参数分析具有类似性。张若兵等人测试电场强度从2.5 MV/m增加到5.0 MV/m时,小球藻细胞破碎率从17.21%增加至83.29%;同样增加能量的输入细胞破碎率也增大到80%以上,细胞内叶绿素的质量浓度明显下降(未给定值),显示出脉冲电场处理有良好的的效果。但Lam等人用脉冲电场处理小球藻获取蛋白质的研究表明,即时输入高能量(珠磨法的100倍[42]),蛋白质提取率只有13%,远小于珠磨法的53%蛋白提取率,认为PEF处理微藻细胞无法释放足够量的蛋白质,而且PEF耗能大。Lam[68]等又进一步研究PEF微藻细胞破碎的处理能力,发现莱茵衣藻细胞壁突变体用PEF处理后水溶性蛋白质全部溶出,蛋白质最大提取率为37%,其效果与机械处理类似;而用PEF处理野生型莱茵衣藻蛋白提取率仅有11%左右。该实验的微藻处理后的电镜结果显示突变体用PEF处理前后细胞基本保持完整性;这证明PEF是一种较温和的细胞破碎技术;但是用PEF处理的提取率偏低,还有待于进一步研究,如结合酶处理先破碎细胞壁再进行PEF处理,或许能达到更好的提取效果。。
3.2.4 阳离子聚合物涂膜法 目前已有提出用阳离子聚合物破碎微藻细胞[1],如Yoo等[69]首先使用用阳离子聚合物的功能膜设计出一种新颖、轻度且高效的细胞破碎技术,从湿微藻中直接提取细胞内脂质。使用涂有带正电荷的叔胺聚合物的膜,来诱导具有两性的微藻细胞膜局部静电平衡与带负电荷的磷脂双层的扰动,透镜显示微藻的磷脂双分子层局部重排而引起的细胞破裂,微藻破碎率在25%左右。Zhengyi等[70]用热聚合物如聚-(N-异丙基丙烯酰胺-共-烯丙胺)和酶与微藻细胞悬浮液混合,细胞破碎率从22%增加至68%;脂质产率达到了59%。该研究还发现该聚合物可以协助酶破碎细胞壁或者能对酶起到保护作用,证实这种简单的先进技术能有效地促进了微藻细胞壁内含物的释放。
使用热聚合物的优点是在产品回收后,聚合物能进行简单有效的分离,还可重新使用,从而降低总成本。以上研究表明聚合物破碎微藻细胞壁提取蛋白将是一个很有前景的技术。
3.3 各种细胞破碎技术的优点与局限性
表3归纳了目前采用的各种微藻细胞破碎方法的优点和局限性,各技术方法的比较详见表3。

表3 各种细胞破碎技术之间的比较Table 3 Comparison of various cell disruption techniques
4 展望
微藻生物炼制的关键瓶颈是微藻细胞破碎,如何低成本、大规模、高效地提取微藻胞内活性物质(如蛋白质等)将是未来研究的关键。现有研究表明,细胞破碎技术之间的组合能有效提高蛋白质产率,如何将具有高细胞破碎率潜力的聚合物涂抹法和其他传统技术组合以提高细胞破碎率、蛋白质产率和降低成本,将是未来微藻细胞破碎的发展方向。未来的微藻细胞破碎应当基于目标产物特性,从细胞破壁原理出发采用组合破壁技术进行破壁提取活性蛋白;如珠磨法和酶法联合使用,先通过适度机械力破除酶作用位点障碍,在进行酶解提取,从而提高蛋白的产量和品质等。降低成本可从上游技术着眼:有研究显示用PEF处理莱茵衣藻细胞壁的突变体导致更高的脂质和蛋白质提取率;因此通过PEF诱导培养微藻细胞壁突变体,增大高附加值物质产量的同时减少能耗。在微藻培养过程中,通过控制微藻和细菌协同培养的相互作用,细菌能有效地提高微藻蛋白等高附加值活性物质的产率[71],其效果比在微藻培养过程中增设生物反应器还要显著;微藻与细菌的共生培养将是提高微藻生物产出的新方向。
权威·核心·领先·实用·全面
