不同来源蛹虫草核苷类成分分析*
2018-09-22李建平曾文波马小双
李建平,张 铁,曾文波**,马小双
(1.文山学院环境与资源学院,云南 文山 663099;2.文山学院文山州生物资源开发研究中心,云南 文山 663099)
蛹虫草Cordyceps militaris(Fr.)Link.,又称作北冬虫夏草,隶属于艳虫草科(Cordycipitaceae) 虫草菌属(Cordyceps),蛹虫草是其无性型蛹草拟青霉感染鳞翅目昆虫蛹形成的虫菌复合体[1-2],野生蛹虫草分布广[3],但是产量较低,无法满足市场的需求。目前,蛹虫草已经实现产业化、规模化培养[4],价格低至100元·kg-1。由于蛹虫草与冬虫夏草含有相似的化学成分[5],常被用作冬虫夏草的代用品。
蛹虫草具有补肾,恢复肝功能,调节人体免疫系统,抗肿瘤,抗氧化和调节心血管功能等多种药理功效[6-11],蛹虫草等虫草真菌含有水溶性核苷类成分、多糖、虫草酸和总黄酮等多种活性成分[12-13],其中核苷类成分主要包括尿嘧啶、腺嘌呤、尿苷、肌苷、鸟苷、胸苷、腺苷、2’-脱氧腺苷、2’-脱氧尿苷和虫草素等[14],腺苷具有减少心律,影响心肌收缩力,松弛血管平滑肌,抑制脂肪分解,减少肾血流量和肾素释放,减少儿茶酚胺释放,抑制中枢神经系统,增加cAMP等多种药理功效[15]。虫草素(cordycepin),即 3’-脱氧腺苷 (3’-deoxyadenosine),是1种核苷类似物,与腺苷结构相比,缺少3’-OH,但能参与如基因表达、嘌呤合成等生化反应,也能影响细胞周期、血小板凝集、炎症反应、肿瘤转移等生理、病理进程。研究表明,虫草素具有抗病原微生物、免疫调节、抗肿瘤等药理功效[16],此外,虫草素在对抗代谢紊乱、氧化损伤、治疗神经系统疾病等方面也具有较好的疗效[17]。肌苷是1种次黄嘌呤核苷制剂,能透过细胞膜进入到细胞内,可提高多种酶的活性,参与能量代谢和蛋白质合成。临床上常用来治疗缺血性心脏病,具有抗心律失常的功效[18]。
人工培养的蛹虫草于2009年被批准为“新资源食品”(后更名为“新食品原料”),是目前唯一可作为食品的虫草类真菌(Cordyceps-like fungi)[19]。蛹虫草现已成为十分常见的药食两用真菌之一,分为鲜品和干品,市面上售卖的主要是蛹虫草的干品,在超市和农贸市场一般都能购买到。经调查发现,蛹虫草产地众多,多数产品未标出其有效成分,没有统一的生产标准和产品质量标准,亟待开展蛹虫草相关标准研究。
本文收集了产自辽宁、吉林、黑龙江、内蒙古、陕西、广东、福建、云南、西藏、安徽、广西、湖北、江西等不同地区共计30个批次的蛹虫草样品,采用超高效液相色谱法(UHPLC)测定了其中的尿嘧啶、尿苷、肌苷、鸟苷、腺嘌呤、胸苷、腺苷、2’-脱氧腺苷、虫草素9种核苷类成分,使用SPSS软件对核苷类成分含量数据进行描述性分析和聚类分析,另外,采用中药色谱指纹图谱相似度评价系统(2012版),计算了30个蛹虫草样品核苷类成分相似度,为评价不同来源蛹虫草质量提供基础数据。
1 材料和方法
1.1 材料和试剂
购买产地明确的蛹虫草材料,样品来源、生产企业和商家详见表1。分别称取30 g左右蛹虫草,60℃烘干2 h,打粉过80目筛,备用。
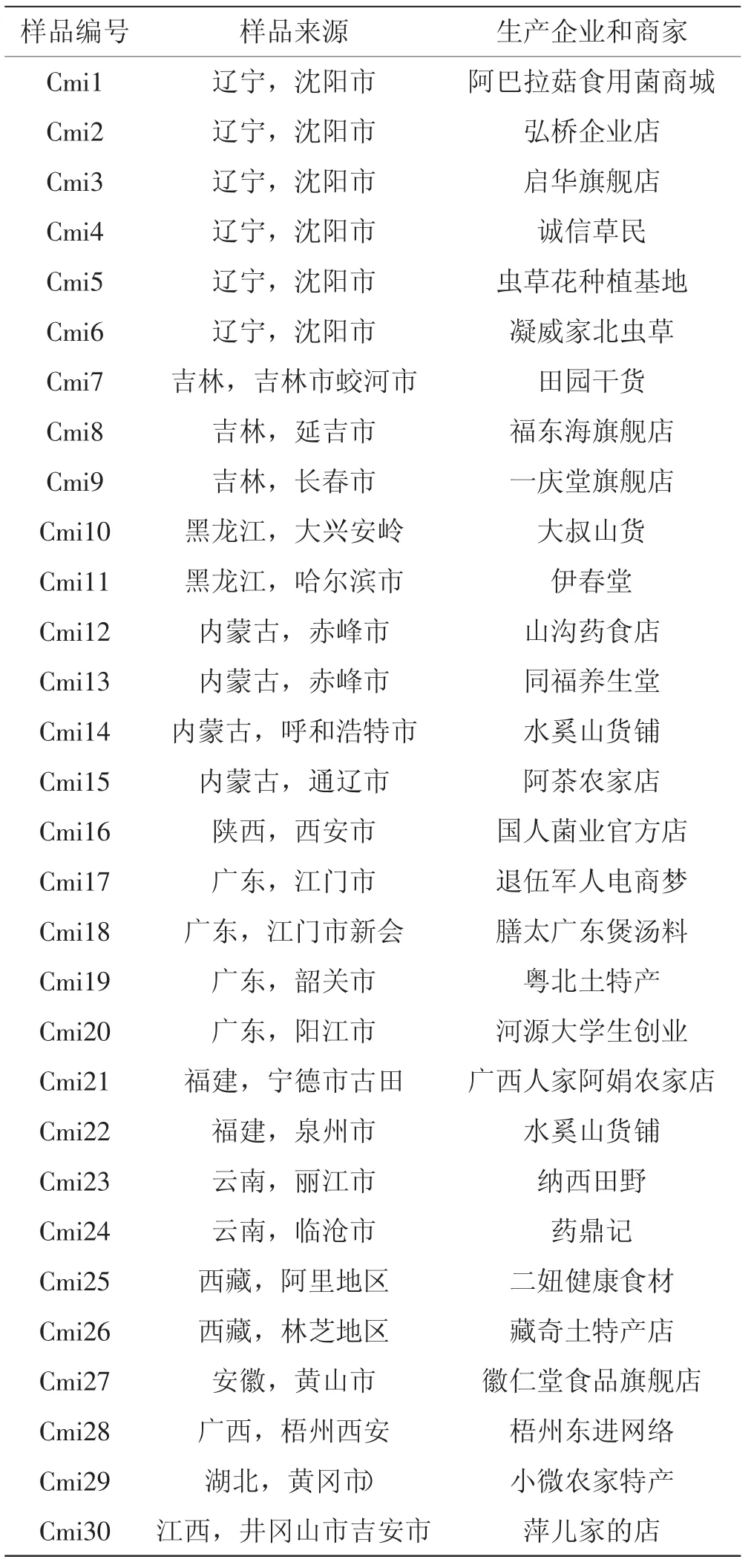
表1 蛹虫草样品来源Tab.1 The sources of Cordyceps militaris
尿嘧啶、尿苷、肌苷、鸟苷、腺嘌呤、胸苷、腺苷、2’-脱氧腺苷等标准品购自生工生物工程(上海)股份有限公司,纯度为98%以上;虫草素购自上海诗丹德生物技术有限公司,纯度为98%;甲醇,色谱纯,Merck KGaA Darmstadt,Germany;娃哈哈纯净水。其余试剂为国产分析纯试剂。
1.2 仪器与设备
热电ULTIMATE 3000超高效液相色谱仪(LPG-3400SDN四元梯度泵,WPS-3000SL自动进样器,VWD-3100可变波长检测器,TCC-3000RS柱温箱,Syncronis C18,1.7 μm,4.6 mm×150 mm 色谱柱,“变色龙”控制分析色谱工作站软件),赛默飞世尔科技(中国) 有限公司;SK5200超声波清洗器,上海科导超声仪器有限公司;50 g手提式高速万能粉碎机,温岭市林大机械有限公司;低速离心机(4 000 r·min-1),上海安亭科学仪器厂。
1.3 方法
1.3.1 色谱条件
流动相为甲醇-水(12:88);等度洗脱,流速0.4 mL·min-1;检测波长260 nm;柱温35℃。在该色谱条件下,尿嘧啶、尿苷、肌苷、鸟苷、腺嘌呤、胸苷、腺苷、2’-脱氧腺苷和虫草素等成分色谱峰均能较好地分离,见图1。
1.3.2 对照品溶液的配制
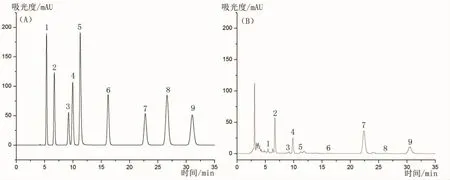
图1 蛹虫草核苷类成分UHPLC图谱Fig.1 UHPLC chromatograms of nucleosides in Cordyceps militaris
分别称取干燥至恒重的尿嘧啶、尿苷、肌苷、鸟苷、腺嘌呤、胸苷、腺苷、2’-脱氧腺苷和虫草素对照品各2 mg~5 mg,使用20%甲醇溶解并定容至50 mL。
1.3.3 标准曲线的绘制
分别吸取对照品溶液 1.0 μL、2.0 μL、4.0 μL、8.0 μL、10.0 μL,注入液相色谱仪中,按上述色谱条件测定峰面积,以标准品进样量(换算成标准品重量) 为纵坐标(y),峰面积为横坐标(x),求回归方程,详见表2。
1.3.4 蛹虫草供试液的制备
参考李建平和曾文波[20]的样品处理方法,制备蛹虫草样品供试液。精密称取0.150 g左右蛹虫草样品于15 mL离心管中,加入20%甲醇溶液3 mL,盖紧,混匀,超声处理60 min,放至室温,4 000 r·min-1离心15 min,将上清液转至10 mL容量瓶中,按照上述方法再处理2次,合并上清液,定容至10 mL得样品溶液,使用一次性注射器吸取样品溶液,用0.22 μm微孔滤膜滤过,即得供试液。

表2 核苷类成分的回归方程Tab.2 Regression equation of 9 nucleoside components
1.3.5 核苷类成分含量测定
将处理好的样品供试液,按照上述色谱条件,进样检测,进样量为3 μL,每个样品平行测定3次,根据标准曲线回归方程计算样品中的核苷类成分含量,取平均值。
1.3.6 数据分析方法
采用SPSS 19.0分析蛹虫草核苷类成分含量的基本统计量,包括最大值、最小值、平均值、标准差、变异系数等,并采用聚类分析对30个不同来源的蛹虫草样品核苷类成分含量进行分析。
采用中药色谱指纹图谱相似度评价系统(2012版),评价30个蛹虫草样品指纹图谱相似性。
2 结果与分析
2.1 精密度试验
精密吸取对照品溶液3 μL,按上述色谱条件连续测定5次,获得各成分峰面积,分别计算相对标准偏差。RSD 在 0.07%~0.45%。
2.2 稳定性试验
精密吸取对照品溶液3 μL,按上述色谱条件分别于2 h、6 h、12 h、24 h、36 h、48 h测定各成分峰面积,计算相对标准偏差,RSD在0.15%~2.25%,对照品在48 h内稳定。
2.3 重复性试验
分别称取样品(Cmi1) 0.1500 g共5份,按照1.3.4提及的方法处理得到的供试液,分别吸取样品供试液各3 μL,按上述色谱条件测定核苷类成分的峰面积,根据标准曲线将峰面积换算成对照品重量,计算出样品中各成分含量,并计算相对标准偏差,RSD 在 0.98%~3.42%。
2.4 加样回收率试验
精密称取核苷类成分含量已知的蛹虫草样品0.1500 g共3份,分别置于15 mL离心管中,按照上述方法,使用对照品溶液作为提取溶剂,处理得到的供试液,按上述色谱条件测定供试液中核苷类成分含量,计算尿嘧啶、尿苷、肌苷、鸟苷、腺嘌呤、胸苷、腺苷、2’-脱氧腺苷和虫草素的平均回收率 (n=3),回收率平均值在 96.93%~103.57%,RSD在 3.19%~5.83%。
2.5 核苷类成分含量
采用UHPLC法测定样品中尿嘧啶、尿苷、肌苷、尿苷、腺嘌呤、腺苷和虫草素等成分的含量,详见表3。
从表3可以看出,30个蛹虫草样品中,9种核苷类成分含量最高的是产自陕西西安市的Cmi16样品(10 294.16 μg·g-1),最低的是产自广东阳江市的Cmi20样品(4 488.36 μg·g-1),平均值为8 115.06 μg·g-1,变异系数为 15.33%,表明不同来源蛹虫草(组间)核苷类成分总含量差异较小。
2.6 描述统计量
将表3数据输入到SPSS软件中,计算9种核苷类成分含量的最小值、最大值、极差、平均值、标准差及变异系数(CV值),详见表4。
由表4可知,蛹虫草中尿嘧啶含量最小值为6.20 μg·g-1, 最 大 值 为 158.85 μg·g-1, CV 值 为72.03%;尿苷含量最小值为 578.30 μg·g-1,最大值为 2 848.38 μg·g-1,CV 值为 25.69%;肌苷含量最小值为 17.41 μg·g-1,最大值 274.09 μg·g-1,CV 值为50.03%;鸟苷含量最小值为 1 169.53 μg·g-1,最大值 3 513.22 μg·g-1,CV 值为 28.72%;腺嘌呤含量最小值为 14.56 μg·g-1,最大值 116.35 μg·g-1,CV 值为44.29%;胸苷含量最小值为0(未检出),最大值62.40 μg·g-1,CV 值为 57.91%;腺苷含量的最小值为 1 304.05 μg·g-1,最大值 2 893.37 μg·g-1,CV 值为 16.28%;2’-脱氧腺苷含量最小值为 5.60 μg·g-1,最大值 49.02 μg·g-1,CV 值为 35.76%;虫草素含量最小值为 821.67 μg·g-1,最大值 3 555.27 μg·g-1,CV 值为 39.51%。
结果表明,蛹虫草中9种核苷类成分含量高低依次为腺苷、鸟苷、尿苷、虫草素、肌苷、腺嘌呤、尿嘧啶、2’-脱氧腺苷、胸苷,其中,腺苷、鸟苷、尿苷和虫草素是蛹虫草中主要的核苷类成分,占到9种核苷类成分的96.03%;9种核苷类成分变异系数(CV值) 在16.28%~72.03%,由低到高依次为腺苷、尿苷、鸟苷、2’-脱氧腺苷、虫草素、腺嘌呤、肌苷、胸苷、尿嘧啶,这表明腺苷是9种核苷类成分中含量最高、最为稳定的1个成分,虫草素是4种主要核苷类成分中变异最大的成分。此外,各个核苷类成分的CV值均高于核苷类成分总含量的CV值(15.33%),表明不同来源蛹虫草核苷类成分总含量差异较小,但具体到各个核苷类成分则有较大的差异,这可能与其菌种和培养条件有关。

表3 不同来源蛹虫草核苷类成分含量Tab.3 Content of nucleosides in Cordyceps militaris from different sources
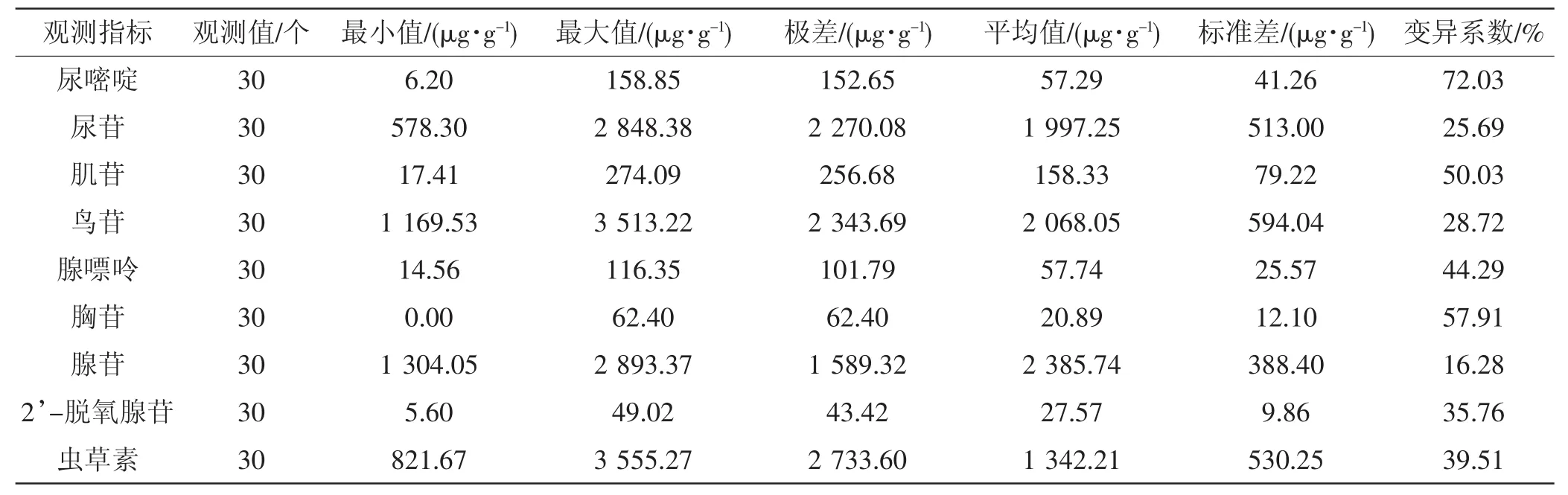
表4 不同来源蛹虫草核苷类成分含量分析结果Tab.4 The analysis on nucleosides in Cordyceps militaris from different sources
2.7 聚类分析
将表3数据输入到SPSS软件中,选择菜单中“分析—分类—系统聚类”,选择9种核苷类成分作为变量,样品编号作为标注个案,统计量选择合并进程表、相似性矩阵,绘制选择水平树状图,以聚类方法为组间联接,区间选择Pearson相关性,其他参数为默认值,绘制30个蛹虫草样品聚类树状图,见图2。

图2 不同来源蛹虫草核苷类成分聚类图Fig.2 Dendrogram of cluster analysis of nucleosides in Cordyceps militaris from different sources
由图2可知,样品Cmi1、Cmi2、Cmi3、Cmi4、Cmi5、Cmi6、Cmi9组成了分枝 A,其中,除了Cmi9产自吉林长春以外,其余6个样品均产自辽宁沈阳;分枝B由产自吉林延吉(Cmi7、Cmi8)、黑龙江 (Cmi10)、内蒙古 (Cmi11、Cmi12、Cmi13、Cmi14、 Cmi15)、 广 东 (Cmi18)、 福 建 泉 州(Cmi21、Cmi22)、西藏 (Cmi25、Cmi26)、安徽(Cmi27)、广西(Cmi28) 江西(Cmi30) 15个样品构成;分枝C由产自陕西(Cmi16)、云南(Cmi23)和湖北(Cmi29)的样品构成;分枝F包括产自广东(Cmi17、 Cmi20)、云南临 沧 (Cmi24)、 广 西(Cmi28) 4个样品;分枝 H由产自广东韶关(Cmi19) 的样品构成。分枝A与分枝B构成分枝D,依次与分枝C、分枝F相联构成分枝G,最后与分枝H相联形成树形聚类图。中国的分区图见图3。
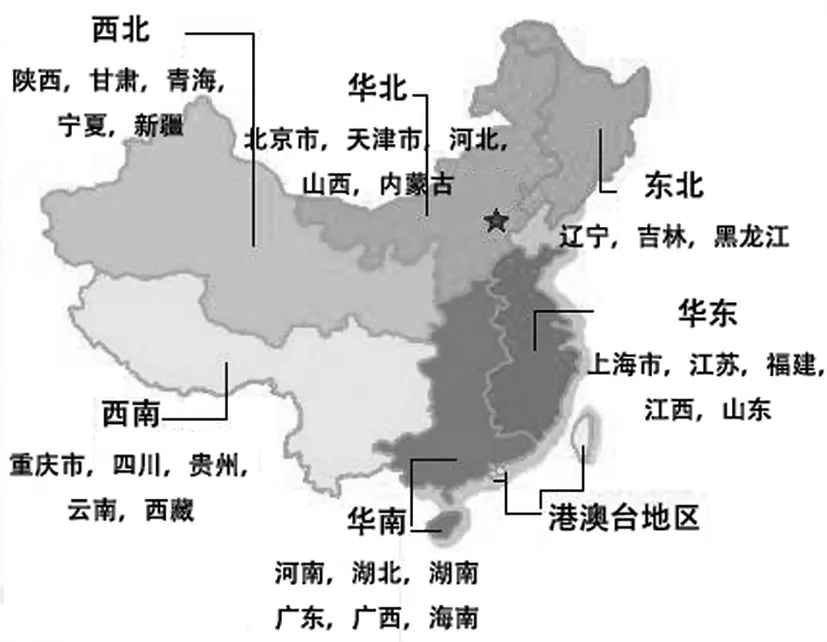
图3 中国分区图Fig.3 Geographical zoning map of China
根据中国的分区图,分枝A代表了以沈阳为主的东北来源的蛹虫草;分枝B和分枝C中的样品包括东北(3个)、华北(5个)、华东(4个) 华南(2个)、西南(3个)、西北(1个)15个样品,代表了由北至南过渡地带的样品;分枝F和分枝H全部由西南(1个)和华南(4个)的南方样品构成,代表了南方产地的蛹虫草样品,由图2可知,根据蛹虫草中9种核苷类成分含量生成的聚类图,能较好地反映其样品的来源,即蛹虫草中核苷类成分的含量具有一定的地理相关性。
2.8 指纹图谱相似度分析
使用中药色谱指纹图谱相似度评价系统(2012版)评价30个蛹虫草样品指纹图谱相似性。该软件的使用包括图谱导入、设置参照图谱(以平均数法作为对照指纹图谱的生成方法,设定时间窗宽度为0.3 min)、保留时间多点校正、谱峰自动匹配、生成对照图谱和相似度计算等几个主要步骤。根据峰匹配结果,选取峰图时间段为0~35 min,计算样品指纹图谱与对照指纹图谱的整体相似度。不同来源蛹虫草间相似度及其与对照指纹图谱相似度见表5。
由表 5 可知,样品间相似度在 0.69~0.99,两两比较相似度在0.90以上的比例为79.77%(347/435×100%=79.77%),30个样品与对照指纹图谱的相似度在0.84~0.99,结果显示不同来源蛹虫草核苷类成分相似度较高,但仍然存在一定差异。
3 讨论
本文测定了30个不同来源的蛹虫草样品中的9种核苷类成分,并比较了其指纹图谱的相似性,表明不同来源蛹虫草核苷类成分种类及其总量差异较小,样品间核苷类成分整体相似度较高,但仍然存在一定的差异,这可能是受菌种来源不同[21],不同产地培养条件的差异,如培养基成分、培养时间、温度、湿度、光照等多种因素的影响[22]。蛹虫草已经被批准为新食品原料,可应用到食品、保健食品和药品等多个行业,因此应从筛选优良菌株、优化培养条件等方面着手,制定蛹虫草行业标准,规范蛹虫草栽培和应用,进一步提高蛹虫草中有效成分含量及其质量的稳定性。

表5 不同来源蛹虫草核苷类成分指纹图谱相似度Tab.5 Results of similarity analysis of nucleosides in Cordyceps militaris from different sources
腺苷、鸟苷、尿苷和虫草素是蛹虫草中主要的核苷类成分,其中,腺苷的变异系数最小,表明腺苷成分较为稳定,可作为蛹虫草质量控制的主要指标之一;虫草素具有多种药理功效,是蛹虫草中重要的活性成分,也应作为1项重要的质量控制指标,但其变异系数较大,含量不稳定,这也可能是由不同厂家的菌种来源、培养条件、加工等方面的差异造成的。因此急需制定统一可靠的评价标准,确定人工蛹虫草的质量等级,保障人工蛹虫草的质量可控。
