小探头超声内镜联合多层螺旋CT术前预测胃黏膜下肿瘤切除方式的临床价值*
2018-09-20
(安徽医科大学第二附属医院 消化内科,安徽 合肥 230601)
胃肠道黏膜下肿瘤(submucusal tumors,SMTs)主要包括胃肠道间质瘤(gastrointestinal stromal tumor,GIST)、平滑肌瘤、神经源性肿瘤和脂肪瘤等,其中以GIST最常见,多发生于胃及小肠[1]。GIST有一定的侵袭及远处转移风险,国内共识指出目前GIST仍以外科手术切除或分子靶向药物治疗为主,手术目标是尽量争取R0切除[2]。随着消化内镜检查的普及,无症状GIST的检出率明显增加,对于直径≤2.0 cm GIST如何处理,存在不同观点。欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)指南建议,对于直径≤2.0 cm的上消化道GIST,可行内镜超声检查并随访[3]。国内共识对于小肠、直肠等部位的GIST则主张积极手术切除[2]。
SMT切除方式的选择则基于术前肿瘤来源层次判断、病理性质评估和预后判断等。然而,常规内镜及活检技术对于黏膜下层来源的病变,诊断不甚理想。超声内镜(endoscopic ultrasonography,EUS)尤其是小探头超声内镜(microprobe ultrasound,MPS)对SMT有很高的定位及定性诊断价值,为临床治疗方案的选择提供重要依据[4]。但MPS由于超声频率的限制,对于体积较大的SMT边界显示不佳,而多层螺旋CT(multispiral computed tomography,MSCT)能清晰显示肿瘤发生部位,判断病变是否腔外生长及周围淋巴结情况,与EUS优势互补。本文通过回顾性分析胃SMT临床病理、MPS联合MSCT等特征,探讨MPS联合MSCT检查术前诊断以及指导内镜切除方式选择的临床价值。
1 资料与方法
1.1 一般资料
选择2014年12月-2017年9月安徽医科大学第二附属医院消化内科经胃镜发现的胃SMT共40例。其中,男16例,女24例,年龄18~77岁,平均(54.0±14.2)岁。所有患者均完成MPS联合MSCT扫描。
1.2 主要器械和方法
1.2.1 主要器械 Olympus-XQ260电子胃镜、采用富士能SP702微型小探头,频率为20 MHz。
1.2.2 MPS检查 所有患者检查前5 min口服利多卡因凝胶,超声小探头经活检孔道送入至病灶处,采用注水充盈法及辅助翻转体位使超声小探头位于水中靠近病灶处观察,测量病变大小,记录生长方式、起源层次、回声和边界等声像学特征。
1.2.3 MSCT检查 所有患者禁食8 h以上,CT扫描前5 min内饮温开水1 000 ml以上充盈胃腔后行腹部CT扫描。
1.3 手术方式
基于MPS以及MSCT扫描特征选择内镜切除或者腹腔镜切除术。内镜切除术式如下:来源于黏膜层及黏膜肌层选择内镜下黏膜切除术(endoscopic mucosal resection,EMR),来源于固有肌层选择内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)或者黏膜下挖除术(endoscopic submucosal excavation,ESE),来源于腔内外哑铃型SMT选择内镜下全层切除术(endoscopic fullthick resection,EFR)切除。术前排除手术禁忌证并充分告知手术相关并发症风险、签署知情同意书。浆膜生长或者巨大SMT选择腹腔镜手术切除。
1.4 MPS及MSCT诊断准确率评估及随访
测量术后标本大小并送检病理检查,依据术后病理结果评估MSCT及MPS诊断准确率。术后定期随访复查胃镜,观察手术创面愈合情况及有无病变残留、复发,必要时行CT检查。
1.5 统计学方法
应用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,计数资料频数以率表示。计量资料用单因素方差分析(one-way ANOVA)比较组间差异,计数资料采用Fisher精确检验,P<0.05为差异具有统计学意义。
2 结果
2.1 MPS对胃SMT术前诊断价值
40例SMT,胃底21例(52.5%,21/40),胃体9例(22.5%,9/40),胃窦6例(15.0%,6/40),贲门3例(7.5%,3/40),胃角1例(2.5%,1/40)。MPS提示来源于固有肌层低回声占37例,黏膜下层3例。MPS诊断间质瘤36例,术后病理证实为间质瘤27例,平滑肌瘤7例,神经鞘瘤1例,异位胰腺1例,MPS诊断间质瘤准确率75.0%(27/36)。
胃底SMT 21例,MPS诊断间质瘤20例,术后病理间质瘤18例、平滑肌瘤1例,神经鞘瘤1例,胃底SMT MPS诊断正确率90.0%(18/20)。胃体SMT 9例,MPS诊断间质瘤9例,术后病理间质瘤6例,平滑肌瘤3例,胃体SMT诊断正确率66.7%(6/9)。胃窦SMT 6例,MPS诊断间质瘤5例、脂肪瘤1例,术后病理间质瘤3例,平滑肌瘤2例,异位胰腺1例,胃体SMT 诊断正确率60.0%(3/5)。贲门SMT 3例,MPS诊断间质瘤2例,平滑肌瘤1例,术后病理平滑肌瘤2例,脂肪瘤1例,MPS诊断正确率0.0%(0/2)。胃角SMT 1例,MPS诊断异位胰腺,术后病理胃腺肌瘤,MPS诊断正确率0.0%(0/1)。
2.2 MPS联合MSCT对胃SMT来源层次和生长方式的诊断价值
胃SMT MSCT特征为局部的类圆形或软组织密度影,边界清晰,体积较大者肿块表面不规则,部分见小片状或脐状凹陷,增强后轻至中度强化,部分呈渐进强化,密度尚均匀。基于MPS及MSCT,术前诊断胃腔内生长37例,胃腔内外生长2例,浆膜外生长1例,除外1例副脾外其余术后均获得证实,MPS联合MSCT对生长方式诊断符合率97.5%(39/40)。MPS提示来源于固有肌层低回声占37例,黏膜下层3例,除外1例副脾外,MPS联合MSCT术前对肿瘤来源层次判断符合率为97.5%(39/40)。39例获得术后病理,直径<3.0 cm者27例,MPS诊断正确率63.0%(17/27),MSCT诊断正确率29.6%(8/27);直径为3.0~5.0 cm者8例,MPS诊断正确率100.0%(8/8),MSCT诊断正确率75.0%(6/8);直径>5.0 cm者4例,MPS诊断正确率75.0%(3/4),MSCT诊断正确率50.0%(2/4);MPS联合MSCT诊断正确率71.8%(28/39)。见表 1。
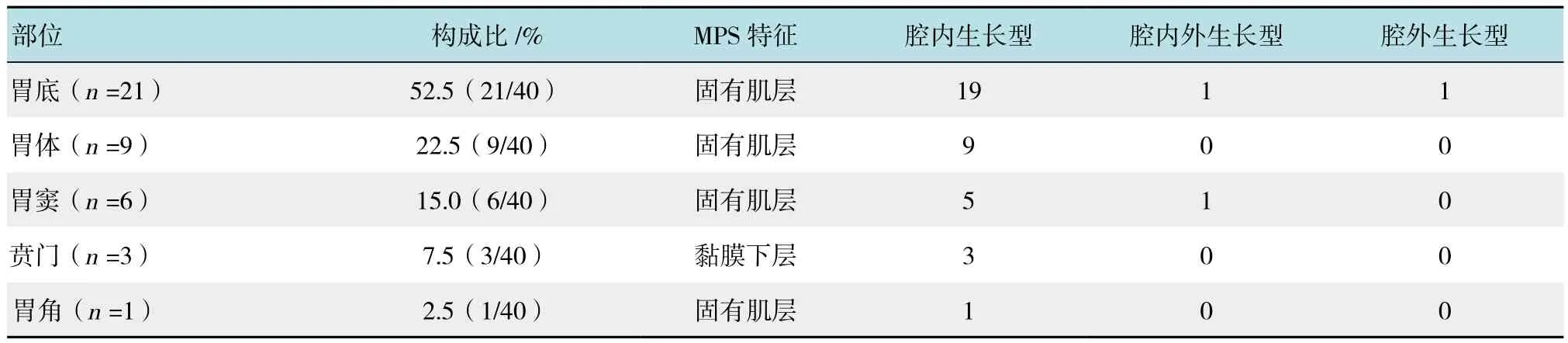
表1 胃SMT来源层次及生长方式Table 1 Tumor origin and growth mode of gastric mucosa
2.3 MPS联合MSCT对胃SMT切除术方式选择的指导价值
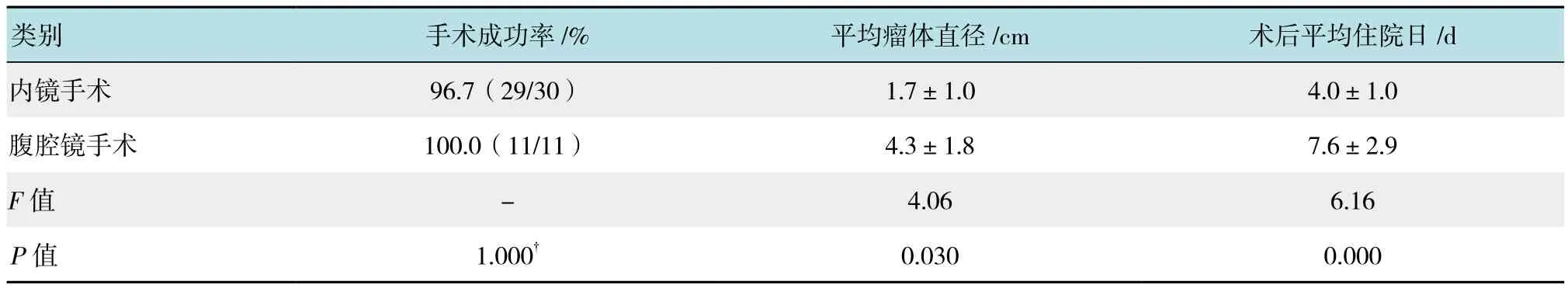
表2 胃SMT内镜与腹腔镜手术相关参数比较Table 2 Comparion of related parameters of endoscopic and laparoscopic resection of gastric SMT
如表2和附图所示,术前依据MPS联合MSCT特征选择内镜切除30例,28例成功切除瘤体,1例因术中证实副脾,征得家属意见后未切除,1例因术中出血中转腹腔镜切除。其中EFR术11例,ESE术13例,内镜黏膜下隧道切除术(submucosal tunneling endoscopic resection,STER) 4例,EMR术2例,内镜手术成功率96.7%(29/30)。内镜切除术后病灶大小0.5~5.0 cm,瘤体平均直径(1.7±1.0)cm,最大直径5.0 cm,瘤体直径<2.0 cm者占78.6%(22/28)。术前选择腹腔镜以及内镜切除术中转腹腔1例共11例行腹腔镜切除,手术成功率100.0%(11/11),平均手术时间,瘤体直径2.0~7.5 cm,平均直径(4.3±1.8)cm,最大直径7.5 cm。与腹腔镜手术比较,内镜切除瘤体大小明显小于腹腔镜手术(P<0.05),但是术后平均住院日明显短于腹腔镜(P<0.05)。

附图 胃SMT术前诊断及内镜切除术Attached fig. Preoperative diagnosis and endoscopic resection of gastric SMT
3 讨论
消化道SMT包括平滑肌瘤、间质瘤和脂肪瘤等以及黏膜下非肿瘤性病变如血管瘤、异位胰腺等。胃肠SMT以间质瘤多见,29篇研究共13 550名GISTs Meta分析显示,GIST发生于胃的最常见(55.6%),其次是小肠(31.8%),结肠6.0%,其他/多发占5.5%,食道仅占0.7%,其他信息不完善的占化2.0%[5]。本研究中,胃SMT主要位于胃底及底-体交界部,间质瘤占70.0%以上,其次包括平滑肌瘤、异位胰腺以及脂肪瘤等,与文献报道一致[6]。
根据美国国家癌症综合网(National Comprehensive Cancer Network,NCCN)的指南,所有大于2.0 cm的GISTs均应接受切除治疗。对于小于2.0 cm且EUS下无高危特征的GIST,建议进行内镜随访[7]。国内共识对于小肠、直肠等部位的GIST则主张积极手术切除[2]。针对GIST手术方式选择:GIST手术适应证、内镜下GIST切除的可行性和腹腔镜GIST手术的适应证等问题,经过近几年的临床实践和观察,越来越趋于达成共识。既往,外科手术切除是SMT的主要治疗方法,包括胸腹部开放手术以及腔镜下手术,但存在创伤大、并发症多等不足。而近年来,随着内镜治疗技术的不断革新如EMR、ESD、ESE、EFR及STER等内镜下切除术治疗消化道SMT的优越性逐渐显现。因此,根据术前评估肿瘤来源层次、大小和生长方式等来选择内镜切除方式显得尤为重要,涉及手术成功率、并发症发生率等安全有效性等问题。但单纯依赖于常规内镜难以评估SMT的来源层次以及瘤体大小等。
EUS是直视下的腔内超声技术,既能反应患者体腔内形态,又能对病灶进行实时扫描[8],弥补了常规胃肠镜检查的不足之处。EUS主要包括MPS及纵轴EUS两种。MPS能够清楚地显示消化道管壁的结构以及病变大小、内部回声、边缘和包膜等情况,对判断上消化道早期癌及进展期肿瘤浸润深度、病灶范围准确可靠[9]。但由于MPS口径小,相较于EUS,能够对消化道管腔狭窄部位进行检查[10]。此外,与EUS相比较,MPS有明显优势,能清楚显示胃底、胃角和胃窦小弯区等操作较困难的区域。许新芳等[11]认为,MPS对于胃黏膜下小于1.0 cm的肿瘤诊断准确率达92.1%,而病灶大于1.0 cm的诊断符合率明显低于EUS,需要其他手段确定黏膜下病变性质,对于大于3.0 cm的病灶边界显示欠佳,往往难以评估周围淋巴结转移及临近器官受累情况[12-13],影响诊断的准确性。本研究中,MPS对不同部位SMT诊断准确率存在差异,胃底SMT诊断准确率最高,而贲门、胃体和胃角等部位诊断准确率明显降低,考虑与胃底易于储存MPS检查所需的水媒介有关,也与瘤体来源层次、回声特征等能很好显示有关。采取MSCT扫描前大量饮水充盈胃腔后再行扫描,充分展开胃腔,能够很好地显示直径大于1.0 cm的胃SMT生长方式,联合MPS诊断瘤体来源层次以及生长方式准确率达97.5%,且相对于EUS而言,MPS联合MSCT扫描,费用低,对内镜操作者技术要求低,易于临床推广。
另一方面,术前MPS联合充盈胃腔MSCT扫描,能清楚显示瘤体来源、肿瘤大小和肿瘤生长方式,并指导内镜切除方式选择。本研究中内镜切除平均直径小于2.0 cm,但最大直径成功切除5.0 cm,主要切除方式是内ESE或者EFR,内镜切除成功率96.7%,术后随访均未见肿瘤复发转移等并发症,提示内镜能安全有效地切除小于2.0 cm胃SMT,且术后平均住院时间明显低于腹腔镜术式。但是直径大于3.0 cm以上,腹腔镜切除更具有优势。
综上所述,随着经自然腔道内镜切除术的出现,胃肠镜下切除范围从黏膜腔内进展到浆膜外腔,MPS联合MSCT对SMTs术前诊断以及手术方式选择具有重要指导价值,尤其对内镜切除术指导价值更大。
