shRNA干扰肾癌细胞株786-O和 OS-RC-2中 HIF-2α的表达对VEGF的影响
2018-09-17巩进伟段建敏卢建中杨宁强王培龙赵永录张效通张正潮范康武李朝明
巩进伟 ,段建敏 ,卢建中 ,李 烨 ,杨宁强 ,王培龙 ,赵永录 ,张效通 ,张正潮 ,范康武 ,李朝明
(1.陇南市第一人民医院,甘肃 陇南 746000;2.兰州大学第二医院,甘肃 兰州730030)
肾细胞肾癌(renal cell carcinoma,RCC)是我国泌尿系统常见恶性肿瘤之一,多起源于肾实质泌尿小管上皮系统,故又称肾腺癌(简称肾癌)。大多数患者早期缺乏特异性的临床表现,就诊时多出现转移,这也是肾癌患者死亡的主要原因。流行病学研究显示,RCC病死率约为40%,明显高于膀胱癌及前列腺癌,其发病机制至今未明确。据统计[1],2013年,美国有65 150例RCC患者得以确诊,13 680例患者死亡。确诊病例中,肾细胞癌占92%,肾盂癌占6%,肾母细胞瘤占1%。2005—2009年,肾癌患者数量以每年3.1%的速度增加,死亡率则以0.5%的速度下降,而我国以每年2.5%的速度递增,20%~30%的病例就诊时已出现扩散或转移,手术治疗后仍出现远处转移者占20%~40%[2]。20世纪50年代,肿瘤低氧概念在放射治疗实体肿瘤失败的病因研究中被提出,组织低氧是人类多种实体肿瘤的病理特征,实体肿瘤不能彻底通过放疗和化疗等手段根治,往往是由于瘤体存在适应低氧环境的肿瘤细胞。因此,肿瘤低氧靶基因的靶向治疗成为研究的焦点。低氧诱导因子系统的激活与人类RCC的发生发展关系密切。研究资料表明[2-3],低氧诱导因子 -2α(hypoxia inducible factors-2α,HIF-2α)降解可抑制肿瘤生长,是影响肿瘤生长的关键基因。近年来,肾细胞癌的生长、侵袭及转移被认为取决于血管生成。低氧诱导因子(HIFs)是一种缺氧应答调控因子,能诱导肿瘤血管生成血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)。VEGF 促进血管新生,为肿瘤的生长、侵袭和转移提供基础。本研究中,我们讨论在肾透明细胞癌(CCRCC)细胞株中运用RNA干扰技术特异性引起低氧诱导因子-2α基因干扰,观察常氧和低氧环境下低氧诱导因子-2αmRNA的表达及其下游基因VEGF的表达情况。
1 试剂与方法
1.1 主要试剂
786-O和OS-RC-2细胞株由兰州大学第二医院泌尿研究所提供,DH5α感受态细胞盒购自北京天根公司,HIF-2α单克隆抗体购自美国Abcam公司,VEGF-A购自Bioworld technology公司,鼠抗兔购自中杉金桥公司,质粒抽提试剂盒和Trizol购自生工公司,胎牛血清和RPMI1640培养基购自美国Hyclon公司,CoCl2购自美国Sigma公司,LipofectamineTM 2000和VybrantTMApoptosis Assay Kit购自美国Invitrogen公司,反转录试剂5X primeScriptRT Master Mix和Real Time PCR试剂SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)购自TakaRa公司。
1.2 HIF-2αshRNA设计及载体质粒构建、转化提取
根据NCBI提供的HIF-2α(NM_001430.3)的mRNA序列,应用Ambion公司提供在线设计siRNA工具,选择4条候选干扰片段。分别设计合成发卡样两端反向互补配对的寡核苷酸序列(见表1),同时合成互补链(反义链),其中正义链5’端引入BamHⅠ酶切位点,反义链5’端引入EcoRⅠ酶切位点,该重组质粒由广州复能公司合成。以空载体质粒作为阴性对照。shRNA干扰组:合成质粒后转化DH5α感受态细胞中,37℃轻摇培养1 h,取菌液接种于含50 μg/ml氨苄青霉素LB培养平板37℃培养过夜,挑取阳性单克隆进行扩增,按试剂盒说明书小量抽提DNA。
表1 免疫印迹法分析RNA干扰对786-O细胞和OS-RC-2细胞中VEGF 蛋白表达的影响(±s)
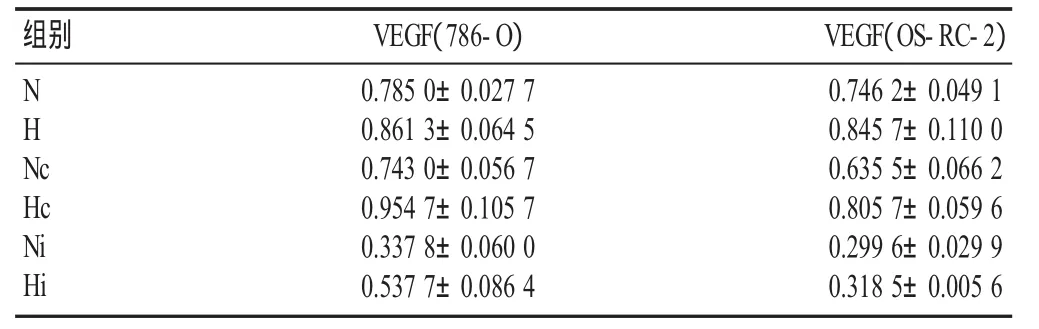
表1 免疫印迹法分析RNA干扰对786-O细胞和OS-RC-2细胞中VEGF 蛋白表达的影响(±s)
注:N:空白对照常氧组;Nc:阴性对照常氧组;Ni:重组质粒常氧组;H:低氧组;Hc:阴性对照低氧组;Hi:重组质粒低氧组
?
1.3 细胞培养,转染细胞
786-O和OS-RC-2细胞常规培养于含10%的胎牛血清,青、链霉素100 u/ml的RPMI1640培养基中。转染前一天,按每孔3×105~5×105个细胞数接种于2 ml不含抗生素培养基的6孔板中,转染时细胞可长至90%~95%融合。分别转染质粒,6 h后换培养基,常氧环境即细胞在含10%胎牛血清的完全培养基中培养。低氧环境模拟则用含150 μmol/L CoCl2的10%胎牛血清的RPMI 1640培养基中培养。
1.4 Real time-PCR法检测常氧和低氧环境下HIF-2αmRNA表达
空白对照组不做转染,阴性对照组转染空质粒,实验组转染shRNA。48 h后提取总RNA,反转录成cDNA,继而Real time-PCR 反应体系 SYBR®Premix Ex TaqTM II 2X 10 μl,引物各0.8 μl(上游引物:5′CATgCgCTAgACTCCgAgAACA3′,下游引物:3′gCTTTgCGAgCATCCggTA5′),用 GAPDH 作为内参照进行半定量(GAPDH 序列 1:5′gCACCgTCAAggCTGAGAAC3′;序列2:5′TGGTGAAGACGCCAGTGGA3′)cDNA 溶液 2 μl,补双蒸水至20 μl。每个样本同时设立3个平行管,每次反应均进行溶解曲线分析,以证实无特异性扩增。反应完成后,ΔΔct法分析HIF-2αmRNA表达量,菌液送Takara公司测序鉴定。
1.5 流式细胞术检测细胞凋亡
利用AnnexinV-PI双染色进行早期细胞凋亡检测,脂质体转染48 h后,收集对照组和实验组细胞,预冷PBS清洗,离心,弃上清液,分别加入 5 μl AnnexinV-FITC 和 5 μl PI,重悬后室温避光孵育15 min,上机检测。
1.6 Western Blot检测VEGF蛋白水平变化
脂质体转染细胞72 h后收集细胞,提取蛋白,BCA法563 nm处检测吸光度值,做标准曲线后计算蛋白质浓度。取20 μg蛋白进行SDS-PAGE电泳分离,转印PVDF膜,用含5%脱脂奶粉的TBST室温封闭1 h,分别加入1∶1 000稀释的VEGF-A兔单抗和1∶1 000稀释的GAPDH单抗,4℃孵育过夜。TBST洗涤,加入1∶1 000稀释的二抗孵育,最后避光滴加ECL发光试剂,染色1 min后曝光分析,重复实验3次,计算各样本灰度值与GAPDH内参灰度值比值,了解蛋白水平变化。
1.7 统计学处理
数据采用SPSS 18.0统计学软件处理,计量资料以均数±标准差表示,组间比较应用方差分析,P<0.05表示有显著性差异。
2 结果
2.1 shRNA对HIF-2αmRNA的表达及鉴定
采用Real time-PCR方法,以GAPDH为基因内参照,分析shRNA对 HIF-2αmRNA表达的影响,采用 ΔΔct法分析HIF-2αmRNA的表达情况。结果显示,shRNA的抑制率可达64.0%,与对照组差异显著(P=0.007)。将shRNA质粒送Takara公司测序(引物 5′CATgCgCTAgACTCCgAgAACA3),序列完全正确(见图1)。

图1 HIF-2αshRNA真核表达载体质粒测序结果
2.2 shRNA在常氧和低氧环境下对HIF-2αmRNA表达的抑制
采用Real time-PCR方法检测48 h后转染细胞HIF-2αmRNA表达情况,扩增曲线中ct值提示有良好的线性关系,溶解曲线未见杂峰,表明引物特异性高。定量分析结果显示,实验组在常氧环境下,786-O和OS-RC-2两种细胞中HIF-2αmRNA表达抑制率分别为61.5%(P=0.021)与72.3%(P=0.030),有显著性差异。对照组786-O细胞在低氧环境下较常氧环境下HIF-2αmRNA表达量增高,说明在低氧环境下HIF-2αmRNA表达更为活跃(P=0.04)(见图 2)。OS-RC-2细胞中 HIF-2αm-RNA的表达量无明显变化(见图3)。
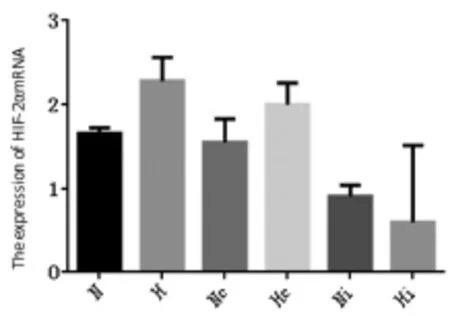
图2 实时荧光定量PCR检测786-O细胞中HIF-2αmRNA表达水平

图3 实时荧光定量PCR检测OS-RC-2细胞中HIF-2αmRNA表达水平
2.3 流式细胞仪测定分析细胞凋亡
流式细胞仪检测结果显示:HIF-2α干扰可促进细胞凋亡。我们检测到,与空载体组比较,实验组786-O和OS-RC-2细胞中HIF-2α基因在低氧状态下凋亡率升高,在常氧状态下没有明显的早期凋亡。说明在基因沉默且低氧条件下早期凋亡率会升高,分别为14.1%(见图4)和5.0%(见图5)。

图4 流式细胞仪检测786-O细胞凋亡

图5 流式细胞仪检测OS-RC-2细胞凋亡
2.4 shRNA抑制HIF-2α基因后VEGF蛋白的变化
采用Quantity one软件进行灰度值分析,数据以SPSS 18.0统计学软件进行处理,计数资料以均数±标准差表示(见表1),72 h后检测转染细胞VEGF蛋白表达量(见图6、7)。阴性对照组中低氧与常氧状态下786-O和OS-RC-2细胞中VEGF蛋白表达分别增加了 28.3%(P=0.037)、27.0%(P=0.029)。实验组常氧环境下以上两种细胞VEGF蛋白水平分别下降了55.4%(P=0.001)、54.7%(P=0.001),低氧环境分别下降了 28.3%(P=0.026)、48.4%(P=0.001)。分析结果显示:CoCl2诱导低氧可以促进两种细胞中VEGF蛋白的表达。HIF-2αshRNA可明显抑制CoCl2诱导的细胞表达VEGF。
3 讨论
3.1 HIF-2α和VEGF的结构与功能

图6 Western Blot检测786-O细胞中VEGF的表达

图7 Western Blot检测在OS-RC-2细胞中VEGF的表达
HIF-2α在多种实体肿瘤中表达,在RCC的发病机制中HIF-2α的作用得到深入研究。HIFs属于转录因子家族,是由一个不稳定的 α 亚基(HIF-1α,HIF-2α,HIF-3α)和稳定的 β 亚基(芳香烃受体核转运蛋白分子)组成的异二聚物功能转录复合物。HIF-2α为HIF族内因子,是由HIF-2α和HIF-1β亚基组成的异源二聚体,又称内皮PAS蛋白-1(EPAS-1)HLF。HRF和MOP2定位于染色体2p16-21,两者均为螺旋-环-螺旋(basic-helix-loop-helix,bHLH)PAS(Per/ARNT/Sim)结构蛋白族内成员,基本结构包括PAS结构域、bHLH结构域、反式活化结构域及入核信号。HIF-2是肿瘤耐受低氧环境的标志物,主要由HIF-2α和HIF-1β两个亚单位构成。α和β亚基构成了具有转录活性的异源二聚体。α亚基受氧浓度调节,表达不稳定,β亚基是结构性亚基,因非依赖性氧降解而在胞核内稳定表达。人类肿瘤的生长及转移依赖血管形成,新生血管的形成受以酪氨酸激酶受体(RTKs)为靶点的特异生长因子调控。VEGF和Flk/KDR RTK被认为是多种信号通路特异性血管内皮细胞因子的关键因子,包括实体肿瘤血管生成的途径或生理性血管的形成过程。抑制VEGF酪氨酸激酶信号通路可以阻断生长期肿瘤的血管形成,从而使肿瘤停止生长甚至退化。目前有大量促血管生成的因子及与之同源的受体被发现,VEGF最具代表性,它在生长因子中比较独特,尤其是在血管内皮特异性功能方面。目前已知VEGF因子包含VEGF、胎盘生长因子、VEGF-B、VEGF-C、VEGF-D及VEGF-E,这些分子都具有典型的规则间隔的模序,由8半胱氨酸残基(称为半胱氨酸结)组成,以二聚体糖蛋白的方式分泌内因子。这类糖蛋白属于一种生长因子结构的超级家族,包括PDGF-BB和TGF-β2。目前发现3种VEGF高度亲和同源内皮细胞受体:VEGFR-1/Flt-1、VEGFR-2/Flk/KDR和VEGFR-3/Flt-4,这些受体作为信号分子发挥着重要作用。胚胎发育过程中,位于内皮细胞的VEGFR-1和VEGFR-2作为细胞表面的酪氨酸激酶受体(RTKs),参与VEGF及其受体基因协调表达的模式证实其参与了胚胎发育时生理性血管形成过程。
3.2 肿瘤细胞中HIF-2α诱导VEGF的表达
作为已知最具潜能的、直接发挥作用的血管生成因子蛋白,VEGF是一种可弥散的内皮细胞特异的有丝分裂原、血管生成因子,可以增加血管通透性,在多种体内模型诱导显著的血管生成反应。在新生血管中,残存的内皮细胞具有VEGF依赖性[4]。目前认为,银屑病、黄斑变性、肿瘤生长等状况下体内病理性血管形成是由VEGF产生过多引起[5],培养细胞的恶性转化也会引起VEGF表达。Kieser等[6]通过动物实验证实,基因突变引起小鼠肿瘤抑癌基因p53和VEGF mRNA表达。毛细血管由既往存在的血管芽生式的过程被称为血管形成,该过程受数量众多的促血管形成和抗血管形成因子调控。肿瘤细胞不断需要新的血管来滋养其生长、转移。因此,肿瘤血管化是一个新生物由小的局限的肿瘤进展为大的肿物并形成转移能力的重要过程。肿瘤血管化可以分为两个时期:血管化前期(也称血管形成的开关期)及血管化期[7]。一旦肿瘤细胞进入向血管化的转化过程,便可以诱导内皮细胞及其他类型细胞表型发生变化。此时,无血管的肿瘤可以拥有血液供应,这意味着肿瘤生长速度加快,而无法血管化的肿瘤便会坏死或者细胞凋亡,完成血管化的肿瘤不仅进入快速生长期,而且其转移能力也显著增强。VEGF及其受体已被证实与许多实体肿瘤的血管形成关系密切。如肝癌、乳腺癌、结肠癌、膀胱癌、胃癌和前列腺癌。HIF-2α是肿瘤耐受低氧微环境生长的标志因子,目前已证实HIF-2α基因参与肿瘤的发生及进展。HIF-2α在肿瘤侵袭网络机制中处于上游位置,可促进下游VEGF表达,常氧环境下VEGF呈低水平表达,主要作用是维持血管密度。CoCl2应用于体外模拟细胞低氧环境,与二价钴离子可诱导细胞中HIF及其他相关调控基因的表达有关。由于二价钴离子可以置换PHD辅助因子等价铁离子阻止HIF-α被羟基化,同时影响pVHL结合HIF-αODD,因此,CoCl2可稳定细胞内HIF-α表达,钴原卟啉与氧的亲和力较差,可以脱氧状态封闭传感器使细胞缺氧,VEGF基因表达上调[7],模拟肿瘤低氧环境。
3.3 不同环境下两种细胞的转染率及转染后HIF-2αmRNA的表达量
shRNA在细胞中的抑制率明显优于siRNA分子的表达沉默效应,很多研究证实shRNA可以通过稳定转染的载体质粒,筛选稳转株后通过整合包装成反转录病毒或慢病毒载体,在细胞实验中能够稳定地抑制靶基因表达。本研究中,shRNA的表达质粒转染786-O和OS-RC-2细胞,特异性干扰HIF-2α表达,观察其对以上两种细胞的抑制效应。HIF-2α表达质粒对786-O和OS-RC-2细胞的转染率分别为42.0%和38.0%,转染48 h后可观察到显著变化。786-O细胞在常氧环境下抑制率为61.5%,与阴性对照组相比差异有显著性(P=0.021)。实验组低氧较常氧环境下HIF-2αmRNA的表达量增高,表明在低氧环境下,HIF-2αmRNA 表达更为活跃,差异显著(P=0.04)。OS-RC-2细胞的抑制率为72.3%,与阴性对照组相比差异有显著性(P=0.030)。实验组在低氧环境下较常氧环境下HIF-2αmRNA的表达量无明显变化。原因可能为受脂质体或质粒毒性导致细胞中HIF-2αmRNA表达量无明显差异。我们利用流式细胞仪观察到,阴性对照组在常氧环境下沉默HIF-2α基因,并没有引起786-O和OS-RC-2细胞凋亡,而低氧环境使细胞凋亡加快,说明在低氧环境下HIF不能发挥作用,不能满足细胞的正常生理活动,导致细胞发生程序性死亡。沉默HIF-2α基因后,786-O和OS-RC-2细胞凋亡率分别为14.1%、5.0%,原因可能是在常氧环境下,HIF-2α在沉默的情况下不能发挥作用,类似于在常氧环境下,HIF-2α自然的降解。然而,低氧环境下,HIF-2α细胞表达需要适应低氧诱导基因。Semenza等[8]认为低氧主要通过激活VEGF转录、提高VEGFmRNA稳定性上调VEGF表达,从而促进血管新生。对一些正常或者转染的细胞进行低氧处理后,VEGFmRNA的表达能力很快被可逆性地诱导出来。我们在前期实验研究中发现,HIF-2α和VEGF在正常膀胱组织中高表达,而在膀胱癌组织中表达较强,且两者的表达与肿瘤病理分级和临床分期密切相关。此外,HIF-2α表达与VEGF表达还呈正相关[9]。
3.4 不同环境下两种细胞VEGF的表达量
我们从蛋白免疫印迹结果中发现,低氧环境下VEGF蛋白超表达,即使沉默了HIF-2αmRNA的表达,低氧较常氧环境下VEGF蛋白表达水平仍较高,进一步证实细胞处于低氧环境下,HIF-2α仍可促进VEGF相关受体表达,使VEGF基因表达,VEGF蛋白增多。常氧环境下,利用α-酮戊二酸和铁作为辅因子,PHD羟基化HIF-2α中两个保守的脯氨酸残基(pro405,pro531),导致HIF-2α聚泛素化而被26 s蛋白酶体降解。实验组VEGF基因有明显的抑制作用,72 h后利用蛋白免疫印迹方法测得786-O和OS-RC-2细胞中VEGF蛋白表达在常氧环境下分别下降了54.5%、52.8%,在低氧环境下下降了27.6%、49.9%,证明HIF-2α基因可以调控VEGF基因表达。本研究结果表明,shRNA表达载体质粒构建成功,抑制下游基因VEGF,使VEGF蛋白表达量下降。由Peng等制作的一个独立的HIF-2α基因敲除模型中,在突变小鼠的卵黄囊和胚胎中可以观察到血管缺陷,来自纯合的HIF-2α敲入的胚胎干细胞(ES细胞)的肿瘤细胞出现生长加快和在异种移植试验中血管生成现象[10]。
目前,血管生成抑制剂已应用于临床,作为靶向药物治疗晚期肾癌获得国内外学者的一致认可,但是此类药物会产生一些不良反应,包括高血压、皮肤毒性(皮疹、手足综合征)、胃肠道反应(厌食、恶心、呕吐和腹泻)、肝功能损害以及血液毒性(中性粒细胞、血小板减少症)、乏力等,而其是否对血管完整性造成影响还需进一步临床观察。
