新型AMPA受体拮抗剂对脑梗死再灌注损伤的保护作用
2018-09-11石秋艳李冬梅王翠兰
许 位, 石秋艳, 孙 原, 李冬梅, 李 弘, 王翠兰
缺血性脑卒中涉及多种病理生理过程[1~3],其中兴奋性氨基酸大量释放是加重脑损伤的一个非常重要的环节,当脑动脉供血中断、能量代谢障碍,引起突触前神经末梢大量释放兴奋性氨基酸,同时由于兴奋性氨基酸的灭活、再摄取障碍及其受体的过度激活,使神经元兴奋性持续增高,引起神经元的损伤[4~6]。非竞争性AMPA受体拮抗剂他仑帕奈[7~10],因其水溶性好,更易透过血脑屏障(blood-brain barrier),能阻止Ca2+、Na+内流增加,从而增加细胞膜电位稳定性,阻碍兴奋性氨基酸谷氨酸大量释放而引起的AMPA受体过度激活,使神经元兴奋性降低,目前他仑帕奈处于3期临床试验阶段,主要用于抗癫痫治疗,它是否对缺血性脑卒中有治疗作用,国内目前还无相关实验研究。
本实验通过观察不同组的大鼠脑梗死体积、神经功能损伤评分、海马CA1区细胞形态变化,同时测定TAL亚组脑梗死周围区caspase-3阳性细胞及梗死皮质区域神经元存活数量,探讨他仑帕奈对大鼠急性脑梗死缺血再灌注损伤的保护作用及其可能机制。
1 材料与方法
1.1 实验动物与分组 60只SD雄性大鼠,清洁级,体质量约250~300 g,由中国人民解放军军事医学科学院卫生学环境医学研究动物实验中心提供[许可证号:SCXK-(军)2011-003],在实验室于安静环境中进行2~4 w适应性饲养,自由饮水,正常饮食。术前3 h禁食,自由饮水。实验前采用随机数字表法随机分组:假手术组(10只,Sham组)、模型组 (10只,MCAO组)、实验组(40只,TAL组)。根据实验组给药时间的不同将TAL组再分为TAL 0 h组、TAL 1 h组、TAL 3 h组、TAL 5 h组,每组10只大鼠。
1.2 制备动物模型 大鼠于术前禁食3 h,将水合氯醛(3.5 mg/kg)于大鼠内腹腔注射进行麻醉。采用改良Longa线栓法[11]制作大鼠急性缺血再灌注损伤模型,采用尼龙线栓(型号:2634-A4,北京西浓科技有限公司,中国)阻塞大鼠右侧大脑中动脉,制备MCAO(middle cerebral artery occlusion)模型。在阻断缺血2 h后,取出尼龙线栓,恢复血供。维持大鼠核心体温在36 ℃~37 ℃。假手术组大鼠除不将尼龙线栓插至大脑中动脉外,其余手术过程与其它组相同。
1.3 给药时间和剂量 大鼠MCAO模型制备成功后,实验组根据设定的不同给药时间点,通过大鼠尾静脉给予他仑帕奈(12 mg/kg)注射,假手术组和模型组给予等量生理盐水处理。
1.4 检测指标及方法
1.4.1 脑梗死体积 每组5只大鼠用于TTC染色,在给药24 h后断头处死大鼠,迅速取脑,去除低位脑干、小脑、嗅球等结构。将脑置于-20 ℃冰箱冻20 min。取出后自额极(Frontal pole)开始,做每间隔1 mm厚度脑冠状连续切片。切取完毕后,将脑片放置于37 ℃的2%2,3,5-三苯基氯化四唑(TTC) (上海精析化工) 0.01 mol PBS 溶液中,孵育25 min,严格避光处理。结束后在4%多聚甲酸溶液(pH7.4)中固定过夜。采用微距相机拍摄,获取图片,根据苍白区观察梗死灶范围,拍摄照片后,用Image-pro plus 6.0软件对所拍摄的图像进行分析(美国 Media Cybemetics公司),统计并计算脑梗死体积。脑梗死体积百分比=脑梗死体积/全脑体积,通过计算脑梗死体积来衡量脑缺血的严重程度。
1.4.2 神经功能损伤评分(Longa 评分标准) 0分:活动自如,没有明显的神经功能损伤症状;1分:提尾时对侧肢体伸展困难,不能完全伸展;2分:爬行时向对侧转圈;3分:爬行时向对侧倾倒;4分:不能自主行走,无意识;5分:死亡。所有大鼠均参与神经功能损伤评分。
1.4.3 HE染色 利用光学显微镜观察大鼠海马 CA1区神经元的形态变化。
1.4.4 免疫组化检测缺血半暗区 caspase-3的表达及梗死周围区的神经元 每组5只大鼠用于免疫组化,给药24 h后,立即处死断头取脑,制备石蜡切片,每份组织取4个切片,常规脱蜡至水,利用POD溶液阻断,之后用5%的山羊血清封闭,并及时行抗原热修复,PBS漂洗后依次滴加兔抗鼠单克隆 aspase-3抗体(1∶100,Affinity),兔抗NeuN抗体(1∶200,Miliipore),置于4 ℃整夜,使用0.01 PBS漂洗3次,每次10 min,滴加二抗:羊抗兔多克隆抗体(1∶100 北京中杉金桥生物技术公司),于37 ℃保持1.5 h,用PBS 漂洗后进行DAB显色。平均每张切片取5个视野,观察并计数每个视野中表达caspase-3阳性细胞及皮质存活神经元的数量,并得到平均数。
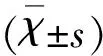
2 结 果
2.1 脑梗死体积及神经功能损伤评分结果 Sham组未出现梗死灶;与Sham组相比,MCAO组及TAL组出现不同程度梗死灶(P<0.05);与MCAO组相比,TAL0 h、TAL1 h、TAL3 h及TAL5 h组脑梗死体积可见明显减降低(P<0.05)。TAL5 h组较TAL0 h、TAL1 h、TAL3 h给药组大鼠脑梗死体积增大(P<0.05)。在TAL组中、TAL0 h、TAL1 h、TAL3 h、TAL5 h时间点的神经功能损伤评分均好于MCAO组(P均<0.05,见表1)。
2.2 实验各组大鼠海马CA1区神经元形态变化 大鼠海马CA1区,采用HE染色进行观察神经元变化,Sham组神经元形态无明显变化,整齐排列,分布致密,细胞核圆形或椭圆形,细胞质透明,核仁清晰可见;而在MCAO组中,大鼠CA1区神经元出现皱缩,变性变化且排列紊乱,组织间出现明显水肿,胞核出现固缩变化,呈现坏死变化。在TAL组中,大鼠海马CA1区神经元与MCAO组相比,神经元变性坏死的数量减少,组织水肿及神经元形态变化减轻(见图1)。
2.3 实验各组大鼠缺血半暗区caspase-3的表达结果 根据免疫组化结果,在Sham组中可见极少量的细胞caspase-3表达为阳性(2.00±0.71),在MCAO组中(80.40±3.85),在TAL组给药的各个时间点中caspase-3表达为阳性的细胞出现明显增多。而TAL组各个给药时间点中细胞caspase-3表达为阳性数量均较MCAO组明显下降(P<0.05),并且TAL5 h给药组中(59.80±4.15)与 TAL0 h组(24.60±4.39)、TAL1 h组(32.60±3.36)及TAL3 h组(45.00±6.08)相比,表达caspase-3阳性细胞数出现增加(见表2、图2)。
2.4 实验各组大鼠脑皮质区神经元存活数量情况 本实验利用NeuN免疫组织化学的方法标记皮质区神经元的细胞核。根据免疫组化结果,Sham组中大鼠脑皮质含有大量存活的神经元且排列紧密(447.40±13.52),与Sham组相比,MCAO组 (154.00±10.93)梗死皮质区存活的神经元数量明显降低(P<0.05),而在TAL组各个给药时间点大鼠脑皮质存活的神经元均较MCAO组明显增高(P<0.05),且在TAL0 h组(3268.60±11.39)、TAL1 h组(245.60±11.18)及TAL3 h组(219.40±11.91)中尤为明显(见表2、图3)。
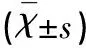
表1 各组大鼠Longa 评分、脑梗死体积的比较
与Sham组相比△P<0.05;与MCAO组相比*P<0.05;与TAL5 h组相比#P<0.05
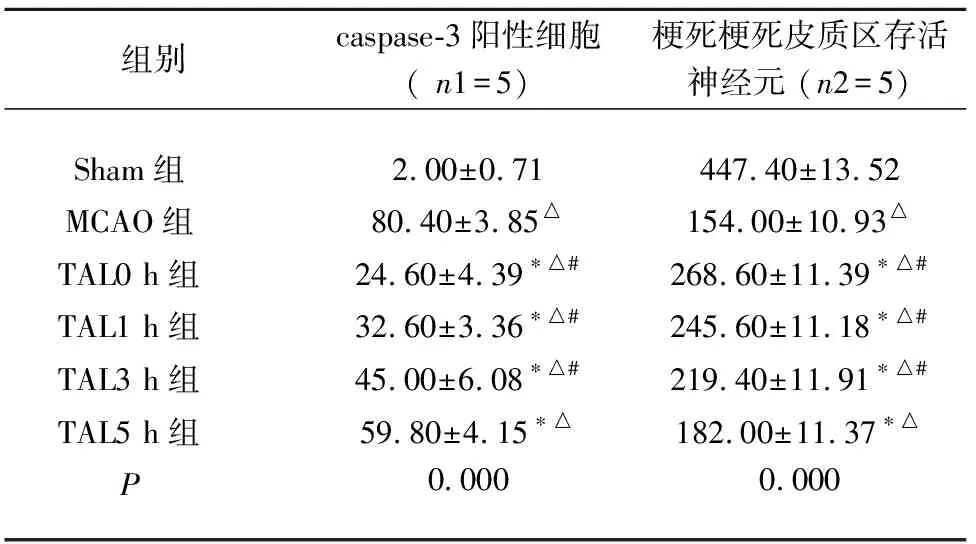
表2 各组大鼠脑缺血半暗区caspase-3阳性细胞和脑梗死皮质神经元数量
与Sham组相比△P<0.05;与MCAO组相比*P<0.05;与TAL5h组相比#P<0.05
3 讨 论
兴奋性神经递质Glu受体[12~14]包括代谢型及离子型受体两大类,离子型受体有3个亚型:AMPA受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionicacid-receptors)、NMDA(N-methyl-D-aspartate receptors)以及KA(kainate receptors,KA)受体。其中AMPA受体属于化学-门控性离子通道受体,它由GLUR1、GLUR2、GLUR3和GLUR4 4个亚基组成,在哺乳动物中枢神经系统中广泛存在,研究发现,AMPA受体主要介导快速兴奋性突触传递,诱发突出后电位(excitatory-postsynaptic potential,EPSP),而AMPA受体的激活不仅可引起长时程抑制(long term depression,LTD),而且可解除Mg+对神经递质与NMDA受体结合的阻碍而引起Ca2+内流增加,触发Ca2+依赖的蛋白激酶先关第二信使,使膜性质发生变化,引起长时程增强效应(long-term potentiation,LTP)的产生,引起一系列细胞病理生理变化,这对神经元的整合及可塑性有很重要的影响,其结构与功能的稳定性对学习、认知及记忆等方面具有重要的作用。
同时研究还发现[15,16],阻断谷氨酸受体能够显著降低或者抑制癫痫样活动的发生,从而减少癫痫样放电的持续时间,相比于阻断NMDA受体,这种效果在阻断AMPA受体后更为显著,大量基础实验与临床研究已经证实[17],AMPA受体在癫痫的同步发病过程中起到重要的作用,在各种动物模型及体外研究中,都表明AMPA受体可以作为潜在的神经保护作用点,目前其已经成为治疗癫痫发病的重要靶点。由于缺血再灌注脑损伤和癫痫发作密切相关,近年来,一些研究者推测,抗癫痫药物对缺血再灌注脑损伤同样是有效的。本次实验结果显示,非竞争性AMPA受体拮抗剂他仑帕奈能够减轻大鼠神经功能损伤,减小脑梗死体积,抑制细胞凋亡,大鼠脑梗死皮质区存活神经元数量增加,从不同角度反映了他仑帕奈确实对缺血再灌注脑损伤后具有神经保护作用,并且在缺血再灌注后前5 h给药治疗效果最佳。
那么这种新型的AMPA非竞争性受体拮抗剂在治疗缺血再灌注损伤具体的机制是什么?许多学者认为,如果能够干预兴奋性神经毒性过程、抑制兴奋性级联反应,可能为缺血再灌注脑损伤治疗提供新的思路。在脑部局部供血中断,局部血流急剧下降,能量供应障碍,ATP合成大量减少,Na+-K+-ATP酶活性降低,大量兴奋性神经递质谷氨酸大量释放,同时再摄取及灭活障碍,使谷氨酸在细胞间质大量积聚,AMPA受体过度激活,而且过度兴奋AMPA受体对Na+通透性增高,细胞膜电位发生变化,使Ca+、Cl-顺着电位差大量内流,引起细胞水肿,大量自由基生成,引起神经元急性期及迟发性损伤甚至死亡[18]。那么他仑帕奈则以AMPA受体为靶点,使神经元的兴奋性降低,减轻由谷氨酸介导的神经元损伤,这可能是他仑帕奈挽救梗死皮质区存活神经元的主要机制之一。其次,许多实验已经证明[19],他仑帕奈主要作用于AMPA受体亚基家族中(GluR1~4 )GluR2亚单位,其中GluR2决定该受体是否对Ca+具有通透性,其他3种亚单位单独或共同存在构成的AMPA受体对Ca+具有通透作用,而当GluR2存在与其它亚单位共同构成受体结构时,那么AMPA受体对Ca+的通透性减低,并具有外向整流的作用,从而稳定细胞膜电位的稳定性,减少细胞膜去极化作用,而当GluR2这一亚单位缺乏时,则会增加Ca+的通透性,引起钙超载、自由基大量生成、细胞凋亡等一系列病理生理过程。在分子水平,同样能够反映GluR2亚基变化。
近年来,一些动物研究发现[20,21],在急性缺血再灌注损伤24 h后,位于缺血再灌注损伤区特别是大鼠海马CA1区GluR2mRNA表达水平明显降低,而GluR1、GluR3的mRNA表达水平却增加,细胞膜对Ca+的通透性增加,引起细胞水肿坏死,同时研究还发现,若增加AMPA受体各亚基的稳定性,阻止各亚基被修饰或调整,那么神经元损伤程度将降低。在AMPA受体4个亚基中,GluR2相比与其它3个亚基在急性缺血损伤后稳定性最差,而非竞争性AMPA受体拮抗剂他仑帕奈对GluR2的亲和力最强,能够阻止其在缺血再灌注损伤后被修饰或丢失,从而增加GluR2亚基的稳定性,能使Ca+的通透性降低,减少对神经元的损害。同时另外一些研究已经证明[22],非竞争性AMPA受体拮抗剂相比与传统的竞争性受体拮抗剂对神经元缺血再灌注损伤具有更好的优势:一方面,其水溶性更高,且能更易通过血脑屏障,对急性缺血再灌注损伤的神经元保护更为有利;另一方面,其不需要与兴奋性氨基酸形成竞争关系,从而阻断急性缺血再灌注时高浓度的谷氨酸对神经元的损伤作用。
本次实验结果显示,他仑帕奈能够减少caspase-3(半胱氨酸蛋白酶-3)的表达水平,减少细胞的凋亡,增加梗死周围区神经元的存活数量,对神经元缺血再灌注脑损伤有很好的保护作用,而这与他仑帕奈抑制神经元的病态兴奋性密切相关。
根据上述:非竞争性AMPA受体拮抗剂他仑帕奈对缺血再灌注脑损伤具有很好的保护作用,可能与他仑帕奈阻止急性缺血缺氧时高浓度的谷氨酸对AMPA受体的过度激活、抑制神经元的病态兴奋性、阻止神经元的进一步损伤、减少细胞凋亡、增加缺血半暗区神经元的存活数量等有关。而且本次实验显示他仑帕奈的治疗作用呈现一定的时间依赖性,随着时间延长,神经保护作用则会减弱。

图1 各组大鼠海马CA1区神经元形态变化(HE×400)

图2 各组大鼠缺血半影区caspase-3阳性细胞表达情况(免疫组化×400)

A:Sham组;B:MCAO组;C:TAL0 h;D:TAL1 h组;E:TAL3 h组;F:TAL5 h组
图3 实验各组大鼠梗死皮质区存活的神经元数量 (免疫组化×200)
