复发脑淀粉样血管病相关性炎症1例报告
2018-09-11闫现芳
闫现芳, 刘 宇
脑淀粉样血管病(CAA)在老年人中发病率较高,病理特征为β淀粉样蛋白的异常沉积[1]。脑淀粉样血管病相关性炎症(CAA-I)是其罕见的可治疗的临床亚型,危险因素为APOE4基因。头部MRI呈现可逆的皮质或皮质下白质高信号,免疫抑制治疗有效。我们收治1例复发的CAA-I患者,基因检测示APOEε4/ε4型,重复激素治疗有效。现报道如下。
1 临床资料
患者,女性,63岁,因“发作性头痛14 m余,再发并加重1 d”于2017年11月13日入院。14 m前无明显诱因出现发作性头顶部胀痛,于我院诊断为脑病待查:肿瘤相关性?风湿免疫相关性?经验性强的松30 mg口服,头痛消失,1 m后自行停药。1 d前头痛再发,较前剧烈,伴恶心呕吐,当地市人民医院头部CT怀疑蛛网膜下腔出血,遂来我院。既往有“一氧化碳中毒病史”,无明显后遗症。入院查体:血压111/52 mmHg,意识清楚,精神尚可,记忆力稍差,四肢肌力、肌张力正常,双侧腱反射对称,病理征未引出,脑膜刺激征阴性。MMSE评分(文盲):24/30分。辅助检查: 2016年9月(WB)抗着丝点抗体阳性(+)。肿瘤相关抗原19-9: 37.58 U/ml(参考值:0.01~37),肿瘤相关抗原72-4:41.67 U/ml(参考值:0~6.9),铁蛋白:346.30 ng/ml(参考值:13~150)。2017年11月13日复查(WB)抗着丝点抗体阳性(+);肿瘤相关抗原72-4:11.69 U/ml,铁蛋白:252.9 ng/m。常规抽血检查未见明显异常。腰穿测颅压210 mmH2O,细胞学示淋巴细胞数升高,蛋白定性阳性,定量:1171.0 mg/L(正常值:150~450 mg/L)。余病毒全套、自身免疫性脑炎相关抗体、副肿瘤等阴性。APOE基因测序ε4/ε4基因型。初次发病时头部MRI(见图1)(2016年9月21日)可见双侧额顶颞枕叶多发片状白质高信号,左侧额叶病变区MRS不支持典型肿瘤性病变。复发时头部MRI(见图 1)(2017年11月14日)示颅内片状异常信号及SWI上多发微出血灶病变数目增多。MRA示轻度动脉粥样硬化。MRV无异常。增强扫描未见强化信号。诊断为CAA-I,予以250 mg甲强龙阶梯减量治疗,头痛消失。院外强的松60 mg口服,每周减5 mg减至20 mg长期维持。随访1 m症状未复发。复查头部MRI(见图2)(2018年1月17日)示异常白质高信号消失,SWI示多发微出血未见明显变化。
2 讨 论
CAA-I平均发病年龄(67岁)较CAA(76岁)年轻[2],临床症状不具有特异性[3],主要表现为[4]认知障碍(48%)、癫痫(32%)和头痛(32%)。男性患病率(55%)略高于女性[2~5]。发病机制可能为血管内Aβ沉积引发的特异性自身免疫反应。有报道在部分患者血清中查到ANCA阳性,本例患者(WB)抗着丝点抗体阳性(+),提示CAA-I临床过程可能有自身免疫反应的参与[6,7]。
影像学表现在CAA-I患者的诊断及鉴别诊断中起重要作用,表现为T2WI或Flair相上单发或多发片状或融合的可逆的白质高信号,病灶多不对称,软脑膜明显强化。SWI 80%以上表现为微出血[4]。部分患者行脑血管造影示轻度大脑中动脉或者大脑前动脉的小分支血管狭窄[3,8,9]。2011年Chuang等[3]指出脑活检是其诊断金标准。2016年Auriel等[10]在其基础上提出了基于临床和影像学表现的“很可能的CAA-I”的诊断标准,提出对该类患者可经验性行免疫抑制治疗。如3 w内对激素不敏感仍需活检病理证实。本例患者63岁,慢性病程,以头痛为主要表现,记忆力稍有下降,头痛症状与颅内出血灶无关。MRI示双侧大脑半球多发非对称性白质高信号融合成片,SWI示颅内散在多发皮质、皮质下微出血灶;MRA和MRV大致正常,增强扫描未见强化信号。既往有CO中毒史,但时间较长,暂不考虑与本次发病相关。肿瘤标志物较高,复查后有所下降,影像学检查等可排除肿瘤相关性脑病。符合“很可能的CAA-I”诊断标准。
CAA-I患者血生化检查特异性不高,在脑脊液表现为蛋白质升高(71%),细胞数增多(45%)[3]。Piazza等人[6]发现急性期脑脊液中Aβ抗体浓度升高;淀粉样蛋白示踪PET检测可用来评估追踪脑内血管壁异常沉积的Aβ情况[11]。高达80%的CAA-I患者携带ε4/ε4基因,单纯CAA患者仅为5%,暗示ε4/ε4基因对血管Aβ的免疫应答具有更特异性的作用。有学者认为ε4/ε4基因型患者,即使无病理结果也可诊断为CAA-I。本例患者血清生化学无特异性,脑脊液检查示淋巴细胞数增多,蛋白阳性,与文献报道相符。APOE基因提示为ε4/ε4基因型,有力支持其为CAA-I的诊断。遗憾的是所在单位无法行Aβ相关抗体的检测。
免疫抑制治疗有效。急性期大剂量皮质类固醇冲击治疗,缓解期激素维持[2,8,12,13],效果不佳可联用其他免疫抑制剂[14,15]。一般用药1~3 w临床症状出现缓解,停药或减量时症状可能复发或加重[3,13,16]。复发多见于首发症状后3 m~8 y,重复免疫治疗同样有效[17]。鉴于CAA-I可能为机体对Aβ沉积的自身免疫反应性疾病,理论上讲免疫抑制治疗可加重Aβ沉积,从而加重脑淀粉样变的症状。本例患者在初次发病时经验性小剂量激素治疗效果明显。用药1 m后自行停药,13 m后头痛复发,程度较前剧烈,头部MRI示病变范围增大,并且出现了新发病灶。重复激素治疗仍效果显著。随访1 m复查头部MRI T2相病灶消失。对激素反应敏感反过来也为诊断提供了支持证据。SWI改变不明显,不除外随访期短所致。
现对CAA-I的认识逐渐增多,但患者难以接受脑活检,可能造成漏诊与误诊。建议对临床怀疑的CAA-I患者推广行SWI筛查、APOE基因检测,有条件时争取淀粉样蛋白示踪PET检查,同时寻求更便捷的检测方法。对符合“很可能的CAA-I”患者经验性使用激素或免疫抑制治疗,并注意免疫抑制治疗带来的可能的病情加重,行个体化治疗。

初次发病时(2016年9月21日) T2加权相(A)示双侧额顶颞枕叶长T2信号;SWI(B)示多发片状低信号影;MRS(C)示左侧额叶病变区不支持典型肿瘤性病变。复发时MRI(2017年11月14日)T2加权相(D)示多发长T2信号范围增大; Flair相(E)呈高信号。SWI(F) 见多发弥漫性点片状低信号灶数目增多
图1 首次发作和复发时头部MRI
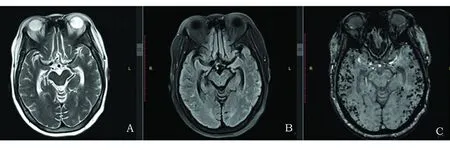
1 m后MRI(2018年1月17日)示相同序列T2相(A)和Flair相(B)白质高信号消失,SWI(C)无明显变化
