Th17通过NF-κB和P38调控急性脑梗死大鼠炎性损伤的实验研究
2018-09-11田嘉莹盛宝英姜尧佳李丛言
田嘉莹, 盛宝英, 韩 凤, 姜尧佳, 李丛言, 毕 胜
急性脑梗死是目前致残率、病死率最高的疾病之一,因其易复发、预后差等特点引起了人们的重视[1]。急性脑梗死后可引起缺血中心区和周围区神经元损伤,其致病机制之一是全身炎症反应综合征。然而需要特殊强调的是脑内的强炎性反应引起脑组织病灶区的损伤比缺血本身更严重[2]。因此,恢复及保持脑梗死后机体免疫系统功能的正常对脑梗死患者具有重要的临床意义。
辅助性T细胞17( T helper 17 cells,Th17)是最近新发现的一群独特的CD4+辅助性T细胞亚群。相关研究认为,炎症反应及自身免疫性疾病中Th17细胞发挥着至关重要的作用。研究表明,急性脑梗死患者缺血部位Th17浸润、活化后可有效透过血-脑脊液屏障、高表达颗粒酶 B、导致神经元损伤并分泌多种细胞因子,参与自身免疫应答[3]。本实验通过观察Th17及其效应分子的动态变化,确定其在急性脑梗死发生发展中的免疫调节作用。以期为急性脑梗死后炎症反应的有效控制降低脑损伤程度提供可靠的理论依据。
1 材料和方法
1.1 实验试剂 BCA蛋白定量试剂盒(BOSTER,Prod:AR0146),兔源β-Actin 单克隆抗体(Cell signaling,13E5),兔源NF-κB P-65多克隆体抗(Affinity,AF5006),兔源p-P38 单克隆抗体(Cell signaling,D3F9)。
1.2 急性脑梗死大鼠模型构建 按照常规方法-线栓法[4]通过手术制备大脑中动脉闭塞 (middle cerebral artery occlusion,MCAO)模型。水合氯醛腹腔注射麻醉,剂量为300 mg/kg。颈部正中纵行切开,暴露左侧颈总和颈外动脉,分离迷走神经以防损伤。阻断颈总动脉的近心端下微血管血流后,在颈外动脉远心端和近心端之间插入普通尼龙线栓,使一侧大脑中动脉闭塞。120 min后拔出线栓,缝合、消毒。假手术组仅分离颈总动脉,随即缝合切口。
1.3 实验动物及分组 8~10周龄的雄性SD大鼠,体重250~300 g,共20只,由哈尔滨医科大学动物中心提供。随机分为3组,MCAO 24 h、72 h和假手术组,5只/组。
1.4 模型评价 模型制备后24 h,动物应清醒。随即采用Bederon[4]等的方法通过神经功能评分确定模型是否构建成功。 计分方法如下:(1)提大鼠尾巴,观察右前肢内收、内旋情况,根据轻重程度,评分为1~3分。4分:大鼠身体右侧旋转。(2)大鼠肌张力评定:借助金属网,通过向后轻拉大鼠尾巴观察双侧前肢肌张力,根据轻重程度,评分为0~2分。(3)借助光滑平面,观察侧向推挡阻力。0分:两侧推无显著差别;1分:右侧明显弱于左侧;2分:向右推大鼠向右侧倾倒。(4)大鼠左上眼睑下垂且分泌物增多,评为2分。总分10分。以上评分相加为最后得分,大于3分属于造模成功,低于3分直接剔除。
1.5 外周血Th17细胞数量的检测 制备流式细胞仪样品,三色标记Th17细胞:抗CD3-FITC单克隆抗体、抗CD4-PE单克隆抗体和抗IL-17A-APC单克隆抗体,另设阴性对照管。流式细胞仪专用染色管中加入EDTA抗凝血0.1 ml,红细胞裂解液裂解3次,3%FCS洗涤3次后加入CD3-FITC单克隆抗体、抗CD4-PE单克隆抗体抗体孵育30 min进行表面染色,3%FCS洗涤后加入固定透膜剂孵育,随后加入抗IL-17A-APC荧光抗体进行细胞内染色。流式细胞仪(FACSCalibur,美国B&D公司)检测,应用FACSCELLQUEST软件,每个样品分析10000个细胞,以阴性对照为参考,将对照管所示的非特异荧光的99%以上作为本底扣除,以二维点阵图显示,记录Th17细胞的百分率。
1.6 Western blotting检测大鼠脑组织中NF-κB P65和p-P38表达水平 动物脱臼处死,取出大脑,冰冻的PBS清洗组织表面血液,取梗死部位大脑组织,置于玻璃匀浆器内,加蛋白裂解液均浆后BCA法测蛋白浓度,上清液-80 ℃保存。适量蛋白上样后行聚丙烯酰胺凝胶电泳,湿转后5%脱脂奶粉室温下封闭1 h,分别加NF-κB p65 (1∶1000)、p- P38(1∶1000) 和β-actin抗体,4 ℃ 孵育过夜,室温下HRP标记的二抗(1∶10000)孵育1 h,ECL化学发光法显影。采用 Image-J图像分析软件,计算各指标相对于内参的相对吸光度值。
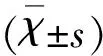
2 结 果
2.1 大鼠外周血中Th17细胞数量变化 与假手术组(Sham)相比,急性脑梗死大鼠出血24 h(MCAO 24 h)和72 h(MCAO 72 h)组外周血中Th17细胞数量均明显增加(P<0.01);与MCAO 24 h组相比,MCAO 72 h组外周血中Th17细胞数量增加,有统计学意义(P<0.05)(见图1)。
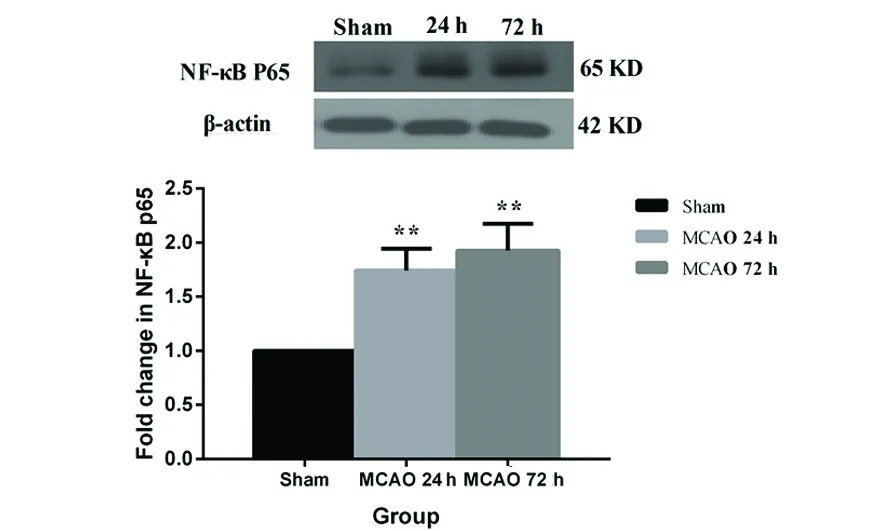
2.2 大鼠脑组织中NF-κB P65蛋白表达变化 与Sham组相比,MCAO 24 h和72 h组脑组织中NF-κB P65蛋白表达明显增加(P<0.01);但是脑梗死后的时间并没有明显影响脑组织中NF-κB P65蛋白的表达(P<0.05)(见图2)。
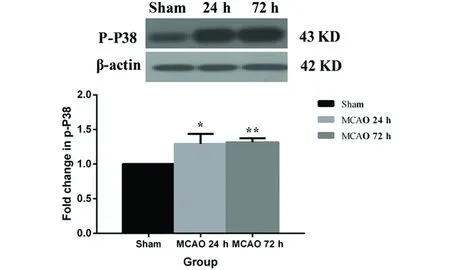
2.3 大鼠脑组织中p-P38蛋白表达变化 与Sham组相比,MCAO 24 h和72 h组脑组织中p-P38蛋白表达明显增加(P<0.05,P<0.0,1);但是脑梗死后的时间并没有明显影响脑组织中p-P38蛋白的表达(P<0.05)(见图3)。

与Sham组比较**P<0.01; 与MCAO 24 h组比较#P< 0.05
图1 急性脑梗死大鼠外周血中Th17细胞数量变化
与Sham组比较**P< 0.01
图2 急性脑梗死大鼠脑组织中NF-κB P65蛋白表达变化
与Sham组比较*P< 0.05,**P< 0.01
图3 急性脑梗死大鼠脑组织中p-P38蛋白表达变化
3 讨 论
感染并发症在脑梗死患者中的发生率约为21%~65%[5,6],是脑组织损伤的主要诱因,与脑梗死患者的临床结局和长期预后密切相关[7]。然而,关于脑梗死后机体如何发挥抗感染免疫调节机制,迄今为止仍然存在大量未知领域。相关研究表明,CD4+T细胞亚群之间的相互作用是免疫调节平衡作用的关键因素之一。CD4+T细胞的免疫失调在急性脑梗死的发生、发展中具有重要作用。然而,Th17作为致炎性细胞因子IL-17的主要来源,是否参与了急性脑梗死后炎症反应导致的继发性脑水肿和脑损害,目前尚无定论。
相关研究证明,Th17可能参与了颈动脉粥样硬化的发生/发展,脑梗死患者外周血的Th17比例及IL-17水平越高,颈动脉斑块越大[8]。然而动脉粥样硬化是急性脑梗死发生的主要原因。Shichita等研究发现,急性脑梗死发生后出血周围的脑组织中大量T细胞浸润,并且脑组织的损伤及神经功能的缺失与IL-17和IL-23水平升高密切相关[9]。由此可见,Th17不仅参与了急性脑梗死的发生,而且在急性脑梗死后继发性脑水肿和脑损伤的病理过程中也占有重要一席。本实验结果发现,与假手术组相比,急性脑梗死大鼠外周血中Th17细胞数量明显增加,并与出血时间呈正相关(见图1)。相关文献报道,脑出血后血肿周围组织在发病24~72 h炎症反应及组织损伤最为严重。与本实验结果相一致,Th17在外周血中的增加与脑组织炎症反应及损伤时间上一致,进一步证实急性脑梗死后Th17参与了脑组织的炎症反应。Th17细胞及其分泌的细胞因子在炎症反应及自身免疫性疾病等方面发挥重要作用。IL-17作为Th17的特征性/效应性细胞因子,与受体结合后通过活化MAPK(丝裂原而活化蛋白激酶)和NF-κB(核因子κB)激活多种免疫细胞(包括树突状细胞、单核细胞、成纤维细胞),尤其是中性粒细胞,诱导多种促炎性因子调控固有和特异性免疫应答引起组织炎性细胞浸润并导致组织破坏[10]。为了明确Th17是如何参与急性脑梗死大鼠脑部免疫细胞的活化和诱导,在本实验中检测了p-P38和NF-κB P65蛋白的表达。实验结果发现,两种蛋白的表达趋势与Th17在外周血中的百分比完全一致。由此证明Th17细胞可通过调控NF-κB和P38的活化调控急性脑梗死大鼠脑部炎症反应。
卒中后的免疫炎性反应对机体来说是一把双刃剑。根据卒中后缺血发生的时间长短、免疫细胞的种类和数量或者小胶质细胞的活化程度等来评定免疫细胞是发挥损伤性作用还是保护性作用[11]。因此我们发现,如果脑梗死发生后的免疫炎性反应能够进行人为调控,诱导免疫炎性反应适度从而对机体产生保护性作用,达到操控脑梗死的临床过程和预后。本实验发现在急性脑梗死后发生的炎性反应与Th17细胞密切相关,因此临床上可以通过调控IL-17的水平改善卒中后的炎性反应,为其后发生的脑水肿和脑损伤提供新的治疗途径。
