绵羊伪狂犬病病毒的分离鉴定及其gD基因序列分析
2018-09-10齐新永鞠厚斌葛菲菲杨德全周锦萍
齐新永,鞠厚斌,葛菲菲,刘 健,杨德全,周锦萍,王 建
(上海市动物疫病预防控制中心,上海 201103)
伪狂犬病病毒(Psudorabies virus,PRV)属于疱疹病毒科,但与其他疱疹病毒不同,其宿主范围广,包括牛、山羊、绵羊、猪、猫、狗等家畜和经济动物如狐、貂等35种动物。猪是伪狂犬病病毒的自然宿主和最常见的易感动物,仔猪主要以呕吐、腹泻、体温升高、呼吸困难、神经症状为特征,成年猪以流产、死胎、繁殖障碍为特征。除猪以外,其他动物都表现发热、奇痒及脑脊髓炎的典型症状。目前伪狂犬病已经发展成为一种世界范围内的疫病,每年给养猪业所造成的经济损失高达几十亿美元。2011 年以来,我国部分地区爆发猪伪狂犬病疫情,许多猪场免疫 Bartha-K61 疫苗后仍频繁爆发此病[1-3]。对此次疫情的流行株研究发现,病毒的抗原性已发生了较大变异,流行株的主要保护性抗原基因 gB、gC、gD 和 gE 基因与以前报道的毒株相比发生了基因插入、缺失或点突变,被认为是 PRV 变异株,并被划分为基因 II 型谱系[4-6]。与传统毒株相比,变异株对猪的致病力和在猪群中的传播能力明显增强[7]。其中gD糖蛋白为病毒增值所必需,介导病毒与靶细胞的稳定结合,参与病毒感染的吸附和穿入过程[8],同时gD糖蛋白也是 PRV 主要的免疫原性蛋白,能刺激动物机体产生中和抗体,gD基因序列的变化可能会导致其功能结构上的变化。本研究以上海市郊区某羊场发现的1例疑似绵羊伪狂犬病病例,对该疑似病例进行了病毒分离鉴定,并对分离株gD基因进行PCR扩增、测序和核苷酸序列分析,旨在了解上海市绵羊伪狂犬病病毒的毒株来源和分子生物学特性,为羊伪狂犬病的防控奠定基础。
1 材料与方法
1.1 病料样品采集与处理 采集上海市郊区某羊场的病死羊脑组织,用灭菌剪刀剪碎,按1∶5的比例加入灭菌PBS,研磨后反复冻融3次,5000×g离心15 min,上清液保存在 -70℃备用。
1.2 主要细胞和试剂 BHK-21细胞株由上海市动物疫病预防控制中心保存;猪伪狂犬病病毒单抗由中国动物疫病预防控制中心馈赠;FITC-兔抗鼠IgG购自北京鼎国昌盛生物技术有限责任公司;猪伪狂犬病病毒荧光定量PCR检测试剂盒购自北京生科尚科技有限公司;pMD18-T Vector载体和感受体 E.coli JM109由本中心保存;Taq DNA 聚合酶购自大连TaKaRa公司;DNA Marker 和 DNA 提取试剂盒购自天根生化科技(北京)有限公司公司。
1.3 病毒分离与传代 将保存的上清液解冻后加青霉素、链霉素各1000IU,37℃作用1 h后,经0.22 μm滤膜过滤除菌。取1 mL 滤液接种于单层的 BHK-21细胞,盲传3代,观察细胞病变(cytopathic effect,CPE)。
1.4 病毒形态观察 用移液器吸取解冻的第3代病毒细胞培养液滴在覆盖有Formvar膜的铜网上,静置1 min 左右,用滤纸从铜网的边缘吸去液体。当铜网上的样品尚未完全干燥时即行染色,吸取 2% 磷钨酸水溶液滴在铜网上,约3~5 min。用滤纸吸取染液,干燥后用 JEM-2100电镜观察病毒粒子的形态。
1.5 实时荧光定量 PCR 检测 将出现细胞病变效应(cytopathic effect,CPE)的BHK-21细胞培养液反复冻融3次,再将细胞培养液分装保存至-70℃备用,采用PRV荧光定量PCR试剂盒对收获的细胞培养液进行PRV检测。
1.6 间接免疫荧光抗体试验indirect(immunofluorescence assay,IFA) 取BHK-21细胞悬浮液2 mL加入腔式载玻片,于37℃、5%CO2温箱中培养24 h;弃掉原细胞培养液,无菌PBS洗3次,再加入1 mL PCR检测阳性的病毒液,37℃、5%CO2温箱中作用1 h;吸掉病毒液,加入细胞维持液继续培养24 h,弃掉维持液,再用PBS洗3次,然后用预冷丙酮固定腔式载玻片上的细胞培养物,PBS洗涤3次,加入500 μL以1∶100稀释的猪伪狂犬病病毒单抗,湿盒内37℃孵育1 h,再用PBS洗涤3次后同FITC标记的兔抗鼠IgG抗体在37℃ 孵育30 min,最后用PBS洗涤3次,荧光显微镜下观察。同时设置加入PBS的细胞培养物做阴性对照。
1.7 家兔接种试验 将盲传3代的病毒细胞液稀释至5×103.0TCID50/ mL,用于家兔攻毒试验。将家兔分为3组:颈部皮下注射组(3只)、滴鼻组(2只)、对照组(2只)。颈部皮下注射组和滴鼻组接种剂量均为0.2 mL,对照组注射生理盐水 0.2 mL。攻毒后观察家兔的发病情况并做好记录。
1.8 基因引物的设计与合成 根据 GenBank 收录的PRV Kaplan 株(GenBank登录号:AJ271966.1),利用引物分析软件Primer Premier 5.0 设计1对的特异性引物扩增gD基因。P1:5'-ATTTGAATT CCCCAGGTTCCCATAC-3';P2:5'-CTTGAAGC TTGGCAGAGGTCGTAC-3'。在上下游引物中分别引入 EcoRⅠ和Hind Ⅲ 酶切位点,扩增产物大小为1579 bp。引物由上海桑尼生物科技有限公司合成。
1. 9 病毒DNA的提取及PCR扩增 将分离株接种到BHK-21单层细胞,当细胞病变达到约50%时收集细胞,参照 QIAGEN 公司病毒核酸提取试剂盒说明提取病毒核酸。利用上述引物扩增gD基因片段。反应总体积(50μL):P1、P2引物各2 μL,2×GC Buffer25 μL,dNTP12.5 μL,DNA模板7.5 μL,Taq DNA 聚合酶1 μL。反应程序:95℃预变性5 min;95℃预变性50 s,58℃退火1 min,72℃延伸1.5 min,进行30个循环;72℃延伸10 min。
1.10 gD基因的克隆和测序 回收纯化后的 DNA 片段,按照 pMD18-T Vector 载体系统操作手册的方法连接到载体上,并转化到 E.coli JM109 的感受态细胞内,然后按常规方法涂含有Amp、IPTG 琼脂平板上,挑取白色菌落,提取质粒。用 EcoRⅠ和 HindⅢ酶切,电泳鉴定阳性重组质粒。阳性重组质粒送上海桑尼生物科技有限公司进行序列测定。
1.11 gD基因的序列分析 应用Lasergene v7.1 DNAStar 软件对分离株的gD基因序列进行分析。根据 GenBank收录的国内外经典的PRV毒株gD基因的核苷酸序列,以及上海市动物疫病预防控制中心2010~2015年间分离的PRV毒株gD基因的核苷酸序列构建gD基因进化树。本地区参考毒株上海市动物疫病预防控制中心2010年以来从临床病例中陆续分离鉴定并保存,毒株如下:SH-03-2010、SH-04-2010、SH-13-2012、SH-14-2012、SH-01-2013、SH-04-2013、SH-03-2014、SH-05-2014、SH-01-2015;GenBank 收录的国内外经典的PRV毒株:FZ(中国/2005/FJ477296)、Ea(中国/1990/KU315430)、La(中国/年代不详/ AY174090)、Hubei(中国/1998/AF092447)、Min-A(中国/2002/AY169694)、BJ/RD(中国/2013/KF017274)、HLJ8(中国/2013/KT824771)、HN1201(中国/2012/KP722022)、HNB(中国/2012/KP722022)、ZJ01(中国/2012/KM061380)、JS2012(中国/2012/KP257591)、Becker(USA/年代不详/JF797219)、Kaplan(Hungary/年代不详/KJ717942)、Bartha(Hungary/年代不详/JF797217)、NIA3(United Kingdom/年代不详/KU900059)、Hercules(Greece/2010/KT983810)、Namyangju(South Korea/1987/GQ325660)、Kolchis(Greece/2010/ KT983811)、Dul34gfp(Germany/年代不详/JQ809329)、Dul34pass(Germany/年代不详/ JQ809330)。
2 结果
2.1 细胞病变观察 BHK-21细胞接种病料12 h后出现空洞,细胞变圆,24 h出现明显的拉网病变,48 h细胞脱落(图1A)。阴性对照的BHK-21细胞界限明显, 大小均一,呈均匀致密的单层(图1B)。
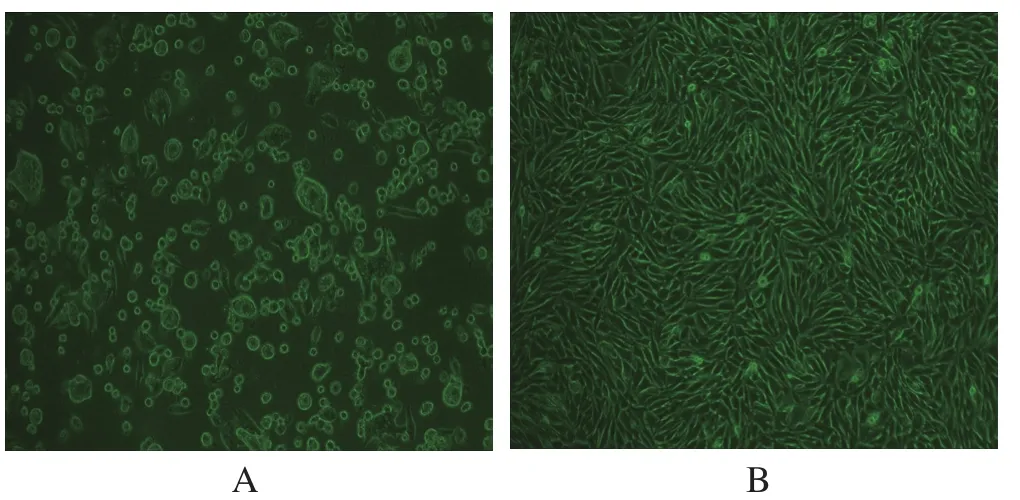
图1 BHK-21 细胞接种病料后出现的细胞病变(200×)Fig.1 Cytopathic effect of BHK-21 cells inoculated with tissue samples(200×)
2.2 电镜观察结果 将分离株细胞培养液滴在Formvar膜的铜网上负染后,在电镜下观察到大小约150 nm左右、圆形有囊膜的病毒颗粒(图2),囊膜表面有呈放射状排列的纤突,其长度约6 nm 左右。
2.3 间接免疫荧光抗体试验结果 病料接种BHK-21细胞,IFA 检测结果显示,细胞的胞浆和胞核呈现明显的特异荧光(图3A),证明病毒液接种细胞能与 PRV 单抗特异性结合,进一步证实所分离的病毒为伪狂犬病病毒,并将其命名为SH1311毒株;未接种的BHK-21 细胞未见绿色荧光(图3B)。
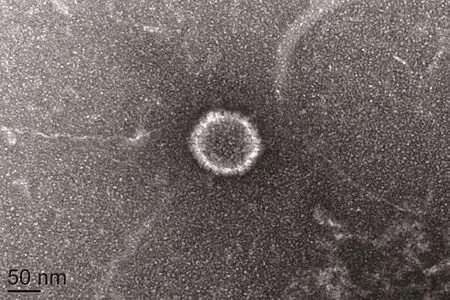
图2 病毒粒子的电镜观察(Bar=50 nm)Fig.2 The morphology of virus particles under electron microscope(Bar=50 nm)
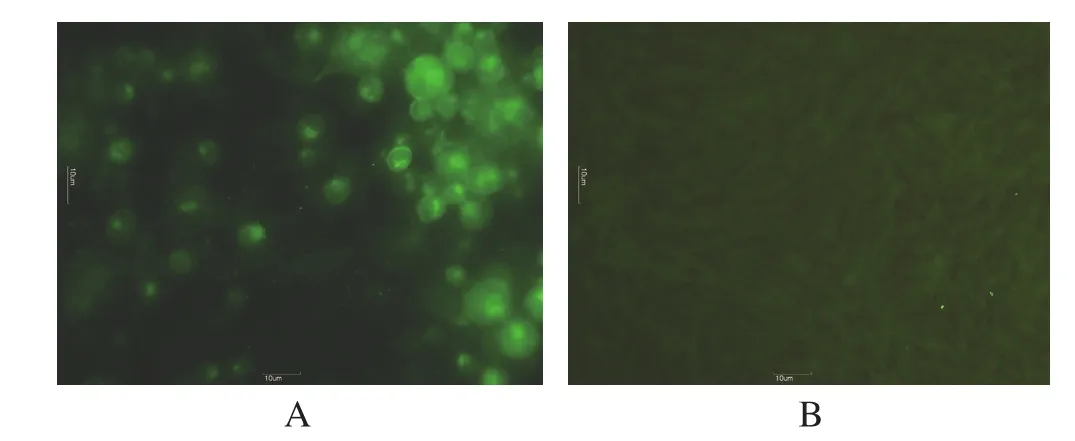
图3 接种病料的BHK-21细胞的IFA检测(200×)Fig.3 IFA result of BHK-21 cells inoculated with tissue samples(200×)
2.4 荧光定量PCR检测结果 对2份BHK-21细胞培养物进行伪狂犬病病毒荧光定量PCR检测,均呈现阳性信号,见图4。
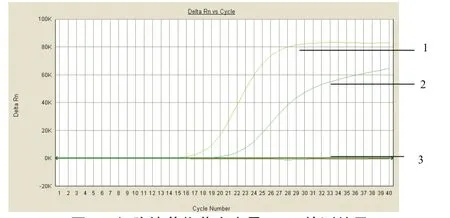
图4 细胞培养物荧光定量PCR检测结果Fig.4 qPCR results of BHK-21 cell cultures
2.5 家兔接种试验结果 将盲传 3 代的病毒细胞液通过颈部皮下注射和滴鼻接种家兔。48 h后均发病,表现为精神沉郁、食欲减退、呼吸加快,并出现局部奇痒症状,用力撕咬接种点,引起局部脱毛、皮肤破损出血。严重者出现角弓反张,4~6 h后病兔衰竭死亡。对照组家兔无任何异常表现。
2.6 SH1311 分离株gD基因的扩增 以在BHK-21细胞上培养的SH1311分离株细胞液所提取的基因组 DNA为模板,进行gD基因PCR鉴定。扩增产物大小与预期片段1579 bp相符(图5)。
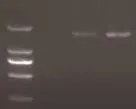
图5 SH1311分离株gD基因的PCR鉴定Fig.5 PCR amplification for gD gene of SH1311 strain
2.7 gD基因的DNA克隆测序 将PCR扩增产物克隆至pMD18-T Vector 载体,对重组质粒进行EcoRⅠ和Hind Ⅲ 双酶切鉴定,证明载体插入了目的基因。对重组质粒双向测序结果显示,该序列全长1579 bp,包含一个完整的开放阅读框,为1209 bp,G+C含量为74.77%,编码402个氨基酸组成的多肽。
2.8 gD基因核苷酸序列分析 应用Lasergene7.0软件中的MegAlign将 SH1311分离株和上海市2010~2015年分离的9株 PRV毒株gD核苷酸序列以及 GenBank上已登录的国内外其他21株PRV的相应序列进行比对分析。结果显示,SH1311分离株与上海市2012~2015年分离的7株 PRV gD 核苷酸序列均为1209 bp,编码402 个氨基酸残基,同源性为99.8%~100%,其中与SH-01-2013株、SH-05-2014株PRV亲缘关系最近,同源性为100%,但与上海市2010 年分离的2株 PRV相比,在815~821nt的位置插入6个碱基(2个氨基酸),同源性只有80.5%(图6)。与国内其他省市分离的毒株如 ZJ01、BJ/RD、Fa、HLJ8、HN1201、HNB、JS-2012、La、Min-A、Hubei、FZ株以及国外的 Becker、NIA3株亲缘关系较近,同源性为 99%~99.9%。除此之外,和其他毒株的亲缘关系都比较远,同源性为79.9%~80.8%。
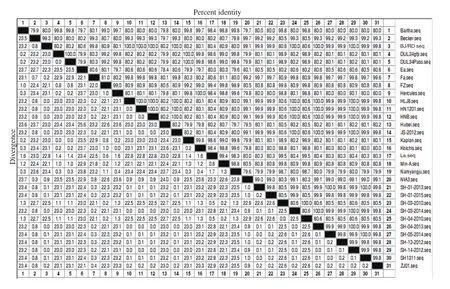
图6 SH1311分离株与参考毒株间 gD 基因的同源性比较Fig.6 Sequence homology of gD gene of SH1311 and other reference strains
2.9 gD基因进化树分析 为进一步了解 SH1311分离株 gD 基因的遗传特性和相互的亲缘关系,利用MEGA7.1对gD基因构建了系统进化树(图7)。结果显示,SH1311 分离株与上海市2012~2015年间分离的7株猪伪狂犬病毒以及国内JS-2012、HNB、HN1201、HLJ8、BJ/RD、ZJ01毒株属于同一个进化分支。
3 讨论
PRV 是危害猪、羊、牛以及很多野生动物的一种重要病原体,猪是该病毒的主要宿主。多年来,欧美许多国家的养猪业通过猪场净化措施已根除了PR,但在我国许多养猪场,PR一直散发或流行。特别是2011年以来,新发的PR流行毒株在基因和蛋白水平上发生了变异,进而导致现有疫苗保护率降低,疫病难以防控。除了猪感染发病以外,羊伪狂犬病的报道也逐渐增多[9-12]。本研究对发病羊的脑组织进行病毒分离,分离株通过家兔攻毒试验、IFA和荧光定量 PCR 检测证实是伪狂犬病毒,将其命名为SH1311毒株。将该毒株细胞培养液负染后在透射电镜下观察,病毒粒子符合伪狂犬病病毒的形态学特征。对SH1311分离株的gD 基因进行测序和序列分析,结果表明该分离株与上海市2012年以来分离的猪 PRV 毒株的gD基因的同源性最高,为99.8%~100%,其中与SH-01-2013株、SH-05-2014株同源性为100%。而与 2010 年上海市流行毒株相比,同源性只有80.5%。gD 基因进化树显示,SH1311 分离株与上海市2012~2015年间分离的7株猪伪狂犬病毒以及国内 JS-2012、HNB、HN1201、HLJ8、BJ/RD毒株属于同一个进化分支,亲缘关系最近,而与欧美分离的毒株以及韩国的流行毒株都处在不同的分支上。这与gD基因变异具有一定的地域性有关[13],即距离较远的地区分离到的毒株,核苷酸同源性较低,反之则同源性较高,这也是SH1311 分离株与上海市最近几年分离的毒株同源性最高的原因之一。
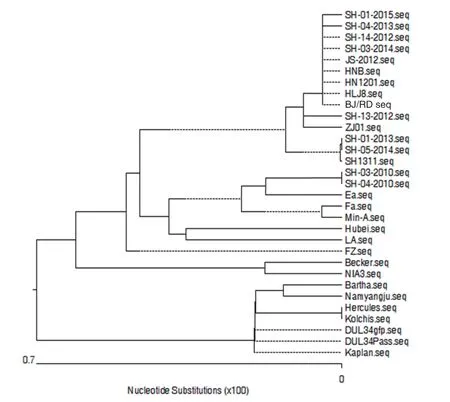
图7 PRV gD基因进化树分析Fig.7 Phylogenetic analysis of PRV gD gene
利用DNAStar软件对从上海市2010年以来收集的 PRV 毒株以及GenBank上已登录的国内外其他22个 PRV 毒株gD基因核苷酸序列进行分析发现,gD基因内部在802~837 nt 处有一个C(A)GGCCC重复高变区,这一区域被称为 gD 基因重复高变区[14],正是这一重复高变区的核苷酸缺失或插入使得PRV gD基因在1194~1215 nt间出现变化,导致编码的氨基酸为399~405 个不等。而SH1311 分离株及上海市2012~2015年间分离的7株猪伪狂犬病病毒,与2010年的上海市流行毒株相比,正是在gD 基因重复高变区插入了C(A)GGCCC六个碱基,使它们之间的同源性只有80.5%。研究结果表明,SH1311 分离株很可能是最近几年在上海市猪场流行的猪伪狂犬病病毒株。为了进一步证实上述观点,笔者到现场进行了流行情况调查,发现该羊场与一家猪场相邻,仅一墙之隔。据调查,在绵羊发病前,相邻的猪场曾经发生过疫病,目前来看,这种疫病可能是猪伪狂犬病毒传染给附近的绵羊,引起绵羊发病。
羊伪狂犬病毒对羊是高度致死性,发病羊死亡率高达100%,本研究对 SH1311 分离株的核苷酸序列分析为羊伪狂犬病的防控提供了参考。虽然该病不像猪伪狂犬病危害那样严重,但因为发病羊病死率很高,因此兽医界需要高度重视并加强对该病的研究,防止野毒在家畜和野生动物之间的传播。
