鸡IRF7原核表达及多克隆抗体制备
2018-09-10许默儒邵红霞叶建强秦爱建
朱 敏,王 琳,许默儒,钱 琨,3,4,邵红霞,4,叶建强,4,秦爱建,3,4,5
(1.扬州大学 省部共建教育部禽类预防医学重点实验室,扬州 225009;2.扬州大学 江苏省动物预防医学重点实验室,扬州 225009;3.江苏省人兽共患病学重点实验室,扬州 225009;4.江苏省动物重要疫病与人兽共患病防控
协同创新中心,扬州 225009;5.教育部农业与农产品安全国际合作联合实验室,扬州 225009)
干扰素是一类具有抵抗病毒感染、调节机体免疫功能、抗肿瘤等多种功能的细胞因子,是机体免疫防御系统的重要组成部分[1]。干扰素包括两类:Ⅰ型干扰素(IFN-α、IFN-β)和Ⅱ型干扰素(IFN-γ),Ⅰ型干扰素由多种细胞在病毒感染时产生,Ⅱ型干扰素由T细胞和天然杀伤性细胞产生[2]。
干扰素调节因子7(interferon regulatory factor 7,IRF7)是在I型IFN基因的转录激活中起着重要作用的IRF家族成员,在诱导和激活抗病毒因子、诱导IFN的产生、调节细胞的生长、激活免疫细胞、炎症反应、凋亡、分化等方面发挥着重要的作用[3-5]。IRF7的N端是具有保守的DNA结合结构域,C端包含多个调控结构域:信号反应结构域、组成性激活结构域、病毒激活结构域、抑制结构域[6,7]。在大多数细胞类型中,IRF7的表达水平都非常低[8]。IRF7主要在免疫系统中表达,如淋巴细胞、脾细胞、胸腺细胞、树突状细胞等,即IRF7是一种特异于淋巴组织的因子[9]。IRF7存在于细胞浆中,其表达不是组成型的,IRF7的活性主要通过蛋白水平调节,IFN、LPS或病毒感染处理细胞后可诱导IRF7的表达[7]。研究鸡IFN信号通路,离不开对IRF7作用的深入研究,但是由于目前尚无鸡源IRF7抗体,给研究鸡IFN信号通路带来巨大瓶颈。
本研究从鸡淋巴细胞中获得IRF7基因,构建原核表达载体,将原核表达蛋白产物作为免疫原免疫小鼠,并用本实验室保存的真核质粒pcDNA3.1-chIRF7-rIgG进行鉴定,成功获得鸡IRF7多抗,为进一步研究IRF7在诱导IFN信号通路中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 载体细胞和实验动物 原核表达载体pCOLDTF、真核表达质粒pcDNA3.1-rIgG、pcDNA3.1-chIRF7-rIgG、大肠杆菌BL21(DE3)和DF1细胞均由本实验室保存;pcDNA3.1-rIgG由本实验室构建,该质粒是在真核表达载体pcDNA3.1(+)中插入了兔IgG,具体兔IgG序列参考吴晓平[10]论文;BALB/c小鼠由扬州大学比较医学中心提供。
1.1.2 试剂 PrimeScriptTMRT reagent Kit with gDNA Eraser购自TaKaRa公司;总RNA小量制备试剂盒购自AxyPrep公司;胶回收试剂盒购自QIAGEN公司;T4 DNA连接酶、限制性内切酶Kpn I、EcoR I购于赛默飞世尔科技公司;转染试剂Trans-IT1购于Mirus公司;FITC标记山羊抗鼠IgG全分子抗体、FITC标记山羊抗兔IgG全分子抗体、HRP标记山羊抗鼠IgG全分子抗体、HISTOPAQUE-1083均购于Sigma公司;RIPA Buffer细胞裂解液购自Cell Signaling Technology公司;质粒小提试剂盒、抗HIS标签鼠单克隆抗体、ECL化学发光显色液购于北京康为世纪公司。
1.2 方法
1.2.1 鸡淋巴细胞cDNA的获得 采取2月龄SPF鸡抗凝血3 mL,用PBS 1:1稀释,将其缓慢加入到6 mL HISTOPAQUE-1083淋巴细胞分离液中,500×g离心20 min,将中间层白色絮状物淋巴细胞吸出。根据AxyPrep总RNA小量制备试剂盒操作说明提取鸡淋巴细胞总RNA,并用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒说明书进行反转录,获得鸡淋巴细胞cDNA。
1.2.2 鸡IRF7基因PCR扩增 根据GenBank中公布的鸡IRF7基因的序列,利用DNAStar设计合成引物。上游引物:5'-CGGGGTACCATGGCAGCACTGGA CAGCG-3' (引入KpnⅠ酶切位点),下游引物:5'-CCGGAATTCGTCTGTCTGCATGTGGTATTG CTC-3'(引入EcoRⅠ酶切位点),以鸡淋巴细胞cDNA作为模板进行PCR扩增。PCR程序:95℃预变性5 min;94℃变性1 min,58℃退火1 min,72℃延伸2 min,35个循环;72℃延伸10 min,4℃保存,PCR产物进行1%琼脂糖凝胶电泳检测,回收纯化目的条带,-20℃储存。
1.2.3 原核表达载体的构建 将pCOLD-TF原核表达载体和IRF7目的片段经EcoRⅠ和KpnⅠ双酶切,将载体和目的片段分别进行胶回收后按1:3的比例用T4 DNA连接酶连接过夜,将过夜后的连接产物转化BL21,转化后的BL21涂布含氨苄青霉素的LB平板,置于37℃培养箱培养过夜,挑取单菌落培养,按质粒小提试剂盒操作说明提取质粒后进行双酶切鉴定,鉴定的阳性质粒送南京华大基因技术有限公司测序,将测序正确的质粒命名为pCOLD-TF-chIRF7。
1.2.4 IRF7重组蛋白的诱导表达及Western blot鉴定 取含pCOLD-TF-chIRF7重组质粒和空载体的BL21阳性菌1:100分别接种于含氨苄抗性的2YT培养基中,225 r/min、37℃振荡培养至菌液OD值约为0.6~0.8时,加入IPTG至终浓度为0.25 mmol/L,150 r/min、16℃诱导20 h。收集菌体加入PBS进行超声破碎,5000×g 离心15 min,各取100 ng上清和沉淀蛋白样品,加ddH2O定容至20 μL,并各加入5 μL的5×SDS Loading Buffer煮沸5 min后冰浴2 min进行SDS-PAGE鉴定,分析目的蛋白的表达情况。Western blot试验:首先采用5%的浓缩胶和12%的分离胶,按实验室常规程序进行SDS-PAGE分析。然后将分离胶转印到硝酸纤维膜上。转印后硝酸纤维膜用5%的脱脂乳37℃封闭3 h,一抗为抗HIS标签鼠单克隆抗体,37℃孵育1 h ,PBST洗3次,二抗为HRP标记山羊抗鼠IgG(H+L),37℃孵育1 h,PBST洗4次,ECL化学发光显色液显色后观察结果。试验同时设计空载体菌对照。
1.2.5 小鼠免疫 将SDS-PAGE胶中的目的蛋白(大小约107 kDa处)条带切下并脱色,抽真空隔后加入PBS,腹腔注射5 w龄的雄性BALB/c小鼠,10 d免疫1次,第3次免疫后7 d采集小鼠尾静脉血清进行激光共聚焦和Western blot试验。
1.2.6 真核表达质粒pcDNA3.1-chIRF7-rIgG转染DF1细胞 将处于对数生长期的DF1细胞用胰酶消化,接种于24孔细胞板中,放于37℃、5%CO2培养箱中培养,待细胞铺满细胞板70%~90%,将质粒pcDNA3.1-chIRF7-rIgG、pcDNA3.1-rIgG分别转染DF1细胞,转染过程按照转染试剂Trans-IT1说明书操作。
1.2.7 激光共聚焦分析 真核表达质粒转染DF1细胞48 h后,用3%的多聚甲醛固定20 min,0.25%Triton X-100室温作用5 min,2%BSA室温封闭30 min,然后用原核表达蛋白产物免疫的鼠血清(1:100)37℃孵育45 min,PBS清洗4次,再用FITC标记山羊抗鼠IgG(1:200)37℃避光孵育40 min,PBS清洗5次,最后经DAPI染细胞核10 min,PBS清洗1次,设阳性、阴性对照,在激光共聚焦显微镜下观察结果。
1.2.8 Western blot分析 真核表达质粒pcDNA3.1-chIRF7-IgG转染DF1细胞48 h,用PBS清洗1次细胞,用细胞刮将细胞刮下,4℃、500×g离心5 min,用RIPA Buffer重悬细胞沉淀,同时加入蛋白酶抑制剂。置于冰上充分裂解30 min,裂解后1500×g离心10 min,收集上清。取20 μL裂解蛋白上清加入5×SDS Loading Buffer煮沸5 min后冰浴2 min进行Western blot分析。一抗为原核表达蛋白产物免疫的鼠血清(1:100),37℃孵育1 h ,PBS洗3次,二抗为HRP标记山羊抗鼠IgG(H+L),37℃孵育1 h,PBS洗4次,ECL化学发光显色液显色后观察结果。
2 结果
2.1 鸡IRF7的PCR扩增结果 按上述方法,将鸡淋巴细胞进行RNA提取,通过反转录,然后PCR扩增,产物经琼脂糖凝胶电泳分析,结果在1473 bp左右处有特异性条带(见图1),大小与预期相符合。
2.2 成功构建chIRF7原核表达载体 将PCR产物直接克隆至pCOLD-TF,构建pCOLD-TF-chIRF7重组质粒,双酶切产物经琼脂糖凝胶电泳分析,在5770 bp处出现一条特异性条带,为pCOLD-TF载体。在1473 bp处出现一条特异性目的条带(见图2),大小与预期相符合,测序结果证实原核表达载体构建成功。
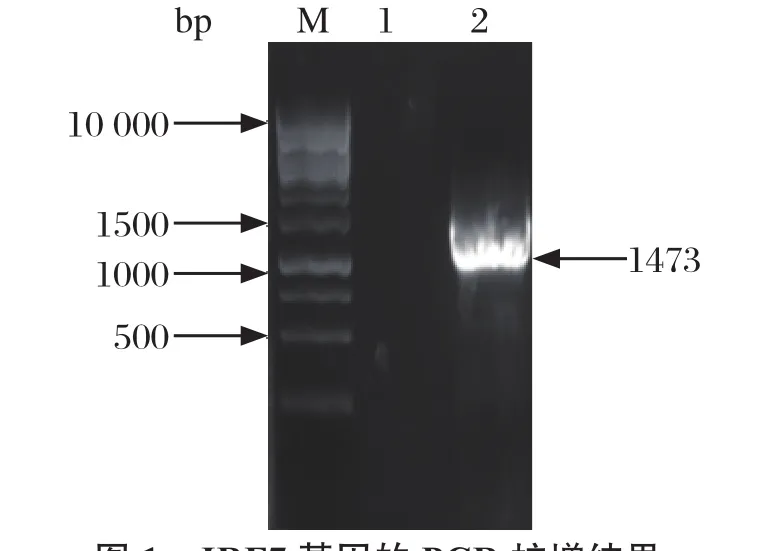
图1 IRF7基因的PCR扩增结果Fig.1 Amplification of IRF7 gene by PCR

图2 pCOLD-TF-chIRF7双酶切鉴定结果Fig.2 Restriction enzyme analysis
2.3 chIRF7融合蛋白的表达及鉴定结果 将IPTG诱导的重组菌体超声破碎后进行SDS-PAGE和Western blot试验,SDS-PAGE结果显示,与对照组空载体相比,pCOLD-TF-chIRF7重组表达菌上清和沉淀中均出现目的条带,大小约为107 kDa。而对照组上清和沉淀在107 kDa处均未出现目的条带,而只在52 kDa处出现特异性空载体His标签蛋白(见图3)。Western blot结果显示,pCOLD-TF-chIRF7原核表达蛋白均能与抗His标签抗体反应,且在107 kDa处出现特异性条带,而对照组上清和沉淀出现52 kDa标签蛋白条带(见图4)。pCOLD-TF-chIRF7原核表达蛋白主要在破碎菌体上清中表达。
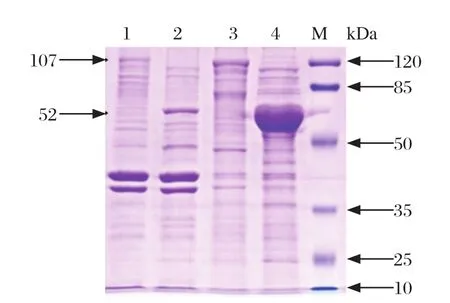
图3 pCOLD-TF-chIRF7诱导表达Fig.3 Expression of pCOLD-TF-chIRF7 induced by IPT G
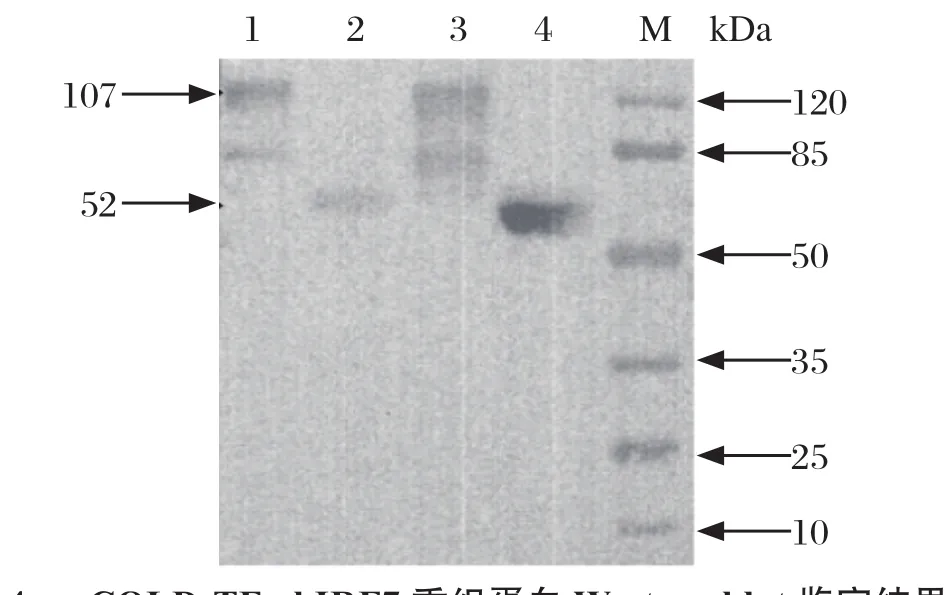
图4 pCOLD-TF-chIRF7 重组蛋白Western blot鉴定结果Fig.4 Identification of pCOLD-TF-chIRF7 recombinant protein by Western blot
2.4 激光共聚焦证明抗chIRF7抗体可以识别真核细胞中chIRF7表达产物 利用真核重组质粒pcDNA3.1-chIRF7-rIgG转染DF1细胞,进行激光共聚焦实验,结果显示,转染pcDNA3.1-rIgG的DF1细胞,用原核表达蛋白产物制备的阳性鼠抗chIRF7血清(1:100)检测DF1细胞无绿色荧光。而转染pcDNA-chIRF7-rIgG的DF1细胞,FITC标记山羊抗兔IgG(阳性对照)和原核表达蛋白产物制备的鼠抗chIRF7血清(1:100)可以识别DF1细胞中的chIRF7,出现明显的绿色荧光,用阴性鼠血清对照检测,结果细胞无绿色荧光(见图5)。结果表明用原核表达的chIRF7产物,可以诱导小鼠产生抗鸡IRF7多克隆抗体。
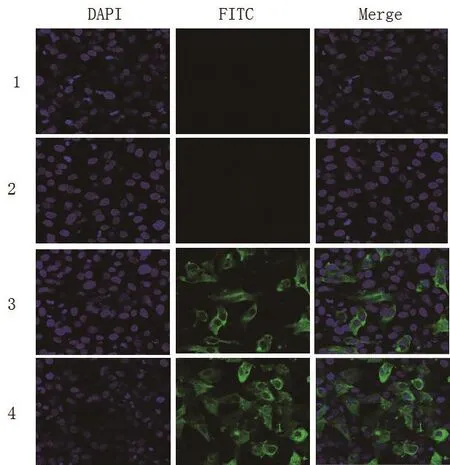
图5 多克隆抗体与真核表达蛋白反应的激光共聚焦鉴定Fig.5 Reaction analysis of polyclonal antibody and prokaryotic expressed protein by Confocal Laser
2.5 Western blot鉴定 将转染pcDNA3.1-chIRF7-rIgG的DF1细胞裂解产物,用原核表达蛋白产物制备的鼠血清进行Western blot检测,结果显示,转染pcDNA3.1-chIRF7-rIgG的细胞裂解产物在分子量约为79 kDa处呈现特异性条带(见图6),大小与预期相符合,鼠血清与真核表达的蛋白发生特异性反应,进一步证明用原核表达的chIRF7产物,诱导小鼠产生了抗鸡IRF7多克隆抗体。
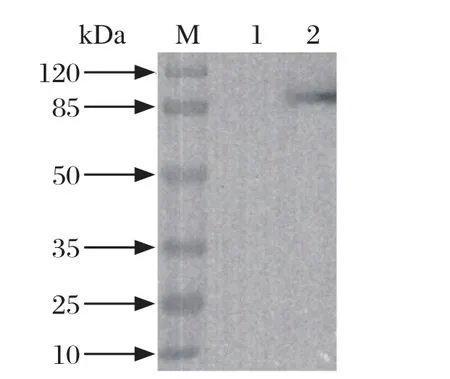
图6 真核表达蛋白与多克隆抗体反应的Western blot鉴定Fig.6 Reaction analysis of polyclonal antibody and prokaryotic expressed protein by Western blot
3 讨论
IRFs是一类结构特征相对保守、对IFN基因表达起调控作用的多功能转录因子,能够参与天然免疫和适应性免疫调控[11]。机体通过相关分子模式识别受体识别来自不同病原体的病原相关分子模式,将信号传递给下游接头分子,引起一系列的级联反应,激活信号通路中的IRFs,最终产生细胞因子、IFN、炎症因子,诱导抗病毒应答[5]。
目前已经发现10个IRFs成员,IRF7是IRFs家族的重要成员,在病毒感染后诱导I型IFN的产生过程中起着重要作用。有报道称,用病毒感染敲除IRF7基因的小鼠,诱导产生IFN的能力明显减弱,由此可见,IRF7在病毒感染诱导IFN生成的过程中发挥了至关重要的作用,是宿主抵御病毒感染和机体免疫防御反应中的一个重要因子[12-14]。IRF7在肿瘤方面也有参与,能抑制肿瘤细胞生长,诱导肿瘤细胞凋亡[15]。近年来对IRF7在IFN信号途径中的作用研究取得了较大进展,但有关鸡IRF7对IFN产生的调控机制、胞内病毒识别途径、如何激活IRF7等方面的研究少有报道,存在瓶颈的关键问题就是因为实验工具的缺乏。
本研究利用分离鸡淋巴细胞并获得其cDNA,从中扩增IRF7基因,构建原核表达载体pCOLD-TF-chIRF7,将原核表达蛋白产物免疫小鼠制备鸡IRF7多克隆抗体,通过不同方法分析鉴定,结果成功获得抗鸡IRF7多克隆抗体,为进一步完善IRF7在干扰素通路的具体形态和了解IRF7的生物学功能提供了生物材料。
