活化蛋白激酶C受体1影响柔嫩艾美耳球虫子孢子入侵细胞的初步研究
2018-09-10赵宗平朱顺海韩红玉赵其平
赵宗平 ,朱顺海 ,黄 兵 ,韩红玉 ,赵其平 ,吕 凌 ,2,陈 婷 ,严 茗 ,2,董 辉
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点实验室,上海 200241;2. 上海师范大学生命与环境科学学院,上海 200234)
球虫病是鸡场中最普遍、造成损失最严重的疾病之一,并呈世界性分布[1]。据统计,全世界每年因球虫病造成的直接经济损失高达20亿英镑[2]。目前,控制球虫病主要依靠抗球虫药物和活疫苗的使用[3],但由于球虫耐药性的产生,药物残留问题日益受到关注以及活疫苗潜在散毒等问题的产生,迫切需要寻找新的防治手段来控制球虫病。鸡球虫的生活史包括细胞外和细胞内的发育繁殖阶段,其中子孢子是球虫从体外入侵宿主细胞建立感染的第一个阶段,而裂殖子是球虫在宿主体内入侵细胞继续完成发育的关键阶段。阻断子孢子/裂殖子入侵宿主细胞,是防治球虫病的一种有效方法。由此,分离鉴定与球虫子孢子/裂殖子入侵宿主细胞相关的关键分子,对研制新的抗球虫药物和疫苗均具有重要意义。
鸡球虫隶属于顶器复合门,其子孢子/裂殖子都有一个由极环(poly ring)、棒状体(rhoptry)、微线体(microneme)、类锥体(conoid)、致密颗粒(dense granules)、微孔(micropore)、膜下微管(subpellicular microtubute)等细胞器构成的顶复体(apical complex),这些细胞器所分泌的蛋白在虫体入侵宿主细胞过程中扮演了重要的角色。近年来,国内外学者对球虫入侵宿主的机制进行了大量的研究,也鉴定出了一些与球虫入侵相关的基因/蛋白,例如表面蛋白(surface antigens)、微线体蛋白、棒状体蛋白和顶体膜抗原(apical membrane antigen)。但迄今,已有研究主要集中在虫体入侵相关基因的研究,鲜有与子孢子入侵相关的宿主细胞蛋白的报道。
在前期实验中,本实验室利用iTRAQ技术研究了宿主细胞感染柔嫩艾美耳球虫(Eimeria tenella)子孢子后蛋白质组学的变化,获得了一批与子孢子入侵相关的宿主蛋白。本研究选取其中一个高表达蛋白—活化蛋白激酶C受体1(receptor for activated C kinase 1,RACK1)进行克隆与表达,并研究其转录水平和蛋白翻译水平在子孢子入侵后的变化以及其抗体对子孢子入侵能力的影响,为深入了解球虫子孢子的入侵机制提供理论依据。
1 材料和方法
1.1 材料 柔嫩艾美耳球虫(资源编号:CAAS2111 1611),pGEX-6P-1和pET28a载体由中国农业科学院上海兽医研究所动物原虫病创新团队保存;宿主菌TOP10、BL21(DE3)感受态细胞、DNA Marker(DL2000)、2×Taq PCR Master Mix、琼脂糖凝胶回收试剂盒、质粒小提试剂盒、RNeasy® Mini Kit试剂盒、PCR产物纯化试剂盒购自QIAGEN公司;Trizol、反转录试剂盒、限制性内切酶Sal I和EcoR I、SYBR® Premix Dimer EraserTM购自大连TaKaRa公司;鼠源GST标签抗体、RIPA裂解液购自上海碧云天生物技术有限公司;T4 DNA连接酶购自美国Promega公司;Cocktail 蛋白酶抑制剂、羊抗鼠IgGCy3二抗购自Sigma公司,GST·BindTMResin 购自Novagen公司。
1.2 实验方法
1.2.1 cDNA模板的制备 取50 mg鸡的新鲜肌肉组织剪碎,放进2 mL EP管,加入Trizol,按照说明书步骤提取总RNA,取少量总RNA进行琼脂糖凝胶电泳鉴定其完整性,利用紫外分光光度计测定浓度。符合要求后,使用反转录试剂盒制备cDNA。
1.2.2 pGEX-6P-1-RACK1原核表达质粒的构建与鉴定 根据已发表的RACK1的mRNA序列(GenBank登录号:NM_001004378.2)进行引物设计(片段大小为1002 bp)。上游引物:5'-GCGAATTCATGAC GGAGCAGATGACCCTC-5',下游引物:5'-GCGT CGACCCTCATCTGGTTCCAATGGT-3',上下游引物分别引入EcoR I、Sal I酶切位点(下划线处)。以鸡肌肉的cDNA为模板,进行RACK1基因的扩增。PCR反应条件:94℃预变性3 min;94℃ 变性30 s,58℃ 退火30 s,72℃延伸 2 min,40个循环;72℃延伸 10 min。用1.5%琼脂糖凝胶电泳检测PCR产物,切胶回收目的片段。回收的基因片段和载体pGEX-6P-1质粒分别经EcoR I和Sal I双酶切后回收目的片段,用T4 DNA连接酶4℃连接过夜。将连接产物转化至感受态细胞TOP10中,并涂布于LB固体培养基上,于37℃培养箱中培养8~12 h,挑取单克隆菌落培养,菌液经PCR和双酶切鉴定后,送至生工生物工程(上海)股份有限公司进行测序。
1.2.3 RACK1-GST重组蛋白的表达与纯化 将测序正确的pGEX-6P-1-RACK1表达载体转化至大肠杆菌BL21(DE3)感受态细胞中进行诱导表达。挑取单克隆菌落接种到LB液体培养基内,37℃、180 r/min振荡培养至OD值达到0.6~0.8时,加入IPTG至终浓度为0.05 mmol/L,培养12 h后,4℃、10 000×g离心15 min,收集菌体沉淀,超声裂解。裂解液于4℃、10 800×g 离心10 min,上清和沉淀经SDSPAGE分析,确定上清中有目的蛋白的表达。使用GST·BindTMResin 对上清中的RACK1-GST目的蛋白进行纯化。
1.2.4 RACK1-GST纯化蛋白的验证 取部分纯化后的蛋白进行Western blot验证。全湿法电转移至PVDF膜上,5%脱脂乳4℃封闭过夜;PBST洗涤5次,加入鼠源GST标签一抗,37℃孵育2 h;PBST洗涤5次,加入1:10 000稀释的荧光羊抗鼠二抗,37℃孵育1 h,PBST洗涤4次,再经PBS洗涤1次后,用Odyssey双色红外激光成像系统进行拍照。
1.2.5 重组蛋白RACK1-GST多克隆抗体的制备 2月龄新西兰大白兔每只皮下注射0.2 mg乳化的RACK1-GST重组蛋白(蛋白:弗氏完全佐剂=1:1)。之后隔2 w免疫注射0.2 mg与弗氏不完全佐剂1:1乳化的RACK1-GST重组蛋白进行加强免疫,此后每隔1 w加强免疫1次,免疫3次。终免7 d后收集分离血清。
1.2.6 子孢子的收集与纯化 柔嫩艾美耳球虫孢子化卵囊按剂量为2.0×104个/只,接种14日龄无球虫的雏鸡,收集接种后6~8 d粪便中的卵囊[4],在28℃的生化培养箱中通氧进行孢子化。待卵囊孢子化率达到90%以上时,用饱和食盐水漂浮法进行纯化。纯化好的卵囊沉淀中加入少量PBS,混匀后加入含有玻璃珠的离心管中,漩涡震荡3~5 min。镜检发现有大量孢子囊释放且卵囊破壁率达到95%以上时,960×g 离心8 min,沉淀用HBBS缓冲液重悬,转移至三角形锥形瓶中,向其中加入0.5%的胰蛋白酶和5%的鸡胆汁[5],混匀后置于41℃水浴锅中消化至95%以上的子孢子逸出,用砂芯漏斗过滤纯化子孢子,收集滤液,离心。子孢子沉淀用PBS洗涤3次后,计数。
1.2.7 细胞样品的收集 复苏液氮冻存的鸡胚成纤维细胞(DF-1),在细胞状态最好时消化细胞并计数。DF-1细胞(3×105个细胞/孔)接入6孔细胞培养板中,加入完全培养基DMEM(10%胎牛血清+1%双抗)37℃、5%CO2培养箱中过夜培养24 h。每孔接入6×105个新鲜的子孢子,置于41℃、5%CO2培养箱中培养,同时设置未感染子孢子的DF-1细胞作为对照组,在接种后24 h、48 h、72 h,分别取出部分细胞样品置于-80℃保存备用。
1.2.8 子孢子感染对RACK1转录水平影响 收集不同感染时间点的细胞样品,利用Trizol试剂盒提取细胞总RNA。用DNase I去除总RNA中的gDNA。参照RNeasy® Mini Kit说明书纯化总RNA,用M -MLV逆转录酶试剂盒进行第一链cDNA的合成,用QIA quick® PCR 试剂盒纯化cDNA, 纯化产物按1:10稀释作为RT-qPCR的模板。用 Primer Premier 5.0软件对RACK1基因进行引物设计,上游引物:5'-ACCTCACCACAGGAACCACCAC-3',下游引物:5'-TGGCGGTTGTCGGAGGAGAAG-3'。以β-actin作为内参基因,上游引物:5'-CACCACA GCCGAGAGAGAAAT-3',下游引物:5'-TGACC ATCAGGGAGTTCATAGC-3'。用SYBR® Premix Dimer EraserTM试剂盒进行RT-qPCR反应,反应体系为(20 μL):cDNA 1 μL、SYBRR Premix Dimer Eraser(2×)10 μL、ROX Reference DyeII 1 μL、无RNase水6 μL和10 mmol/L正向和反向引物各1 μL。扩增条件:95℃预变性30 s;95℃变性5 s, 60℃退火30 s。每个样本3个重复。将目的基因mRNA的Ct值进行2-∆∆Ct[∆∆Ct=(Ct目的RNA-Ct内参)处理组-(Ct目的RNA-Ct内参)对照组)]转换,表示处理组各样本的表达量相对于对照组的倍数,之后运用SPASS 21.0及GraphPad Prism 5软件进行单因素方差分析,检验水准α=0.05。
1.2.9 子孢子感染对RACK1蛋白翻译水平影响 取不同感染时间点的细胞,用预冷的PBS洗涤3次,10 800×g 离心10 min;弃上清,沉淀中加入100 μL RIPA裂解液及1% cocktail蛋白酶抑制剂,置于冰上裂解30 min,轻轻地反复吹打裂解液,避免产生气泡;4℃、10 800×g 离心15 min,吸取上清液即为细胞总蛋白,BCA法测定细胞总蛋白浓度,以内参基因β-actin作为参照调整蛋白样品上样量,全湿法电转移至PVDF膜上,5%脱脂乳4℃封闭过夜;PBST洗涤5次,加入兔源RACK1多抗(1:100稀释),37℃孵育2 h;PBST洗涤5次,加入1:10 000稀释的荧光羊抗兔二抗,37℃孵育1 h,PBST洗涤4次,再经PBS洗涤1次后,用Odyssey双色红外激光成像系统进行拍照。运用Image J软件进行图片条带灰度值分析。
1.2.10 RACK1抗体对子孢子入侵细胞能力的影响 参照碧云天ProteinA+G agarose说明书,对兔抗RACK1-GST多抗进行纯化。DF-1细胞(2×105个/孔)接入24孔细胞板,同时梯度加入纯化的兔抗RACK1-GST多抗或正常IgG,使其终浓度为每孔100 μg/mL、200 μg/mL、300 μg/mL、400 μg/mL,与培养基共孵育细胞,37℃、5% CO2培养箱中培养24 h。新鲜收集的子孢子经CFDA SE细胞增殖与示踪检测试剂盒标记[6],以4×105个/孔加入细胞,于41℃、5% CO2培养箱中培养12 h。胰酶消化细胞收集细胞,PBS清洗,利用流式细胞仪检测子孢子的入侵情况。同时设置无抗体孵育细胞的子孢子感染组作为对照组,所有实验设置3个重复。参考文献[7]进行入侵率统计计算。
2 结果
2.1 RACK1-GST重组蛋白的表达与纯化 以鸡肌肉的cDNA为模板,用所设计合成的特异性引物扩增出1条目的条带,大小为1002 bp,利用BLAST进行序列同源比对,发现其与已知的RACK1同源性为99%,证明成功克隆该基因。RACK1编码317个氨基酸,理论分子量为35 kDa。对表达重组蛋白菌液的沉淀和上清进行SDS-PAGE分析,结果显示在上清和沉淀中均有61 kDa目的蛋白存在,其中pGEX-6P-1载体约为26 kDa,RACK1蛋白约为35 kDa(图1)。用GST-Bind柱对上清中的重组蛋白进行纯化,可获得较纯的RACK1-GST蛋白(图1)。

图1 RACK1-GST重组蛋白的表达与纯化Fig.1 Expression and purification of recombinant protein RACK1-GST
2.2 RACK1-GST融合蛋白的Western blot分析 结果显示,纯化蛋白在61 kDa处有单一的目的条带,证实所获得的蛋白为RACK1-GST融合蛋白(图2)。
2.3 子孢子感染对RACK1转录水平的影响 利用相对实时荧光定量PCR检测子孢子感染细胞不同时间的RACK1的转录水平。结果发现,子孢子入侵细胞后,RACK1的转录水平显著性升高,统计分析结果表明,感染后24 h的转录水平明显高于不感染组(P<0.05),而48 h组和72 h组的转录水平差异不显著(P>0.05),分别约为不感染组的14和16倍,均明显高于24 h组(P<0.05)(图3)。

图2 RACK1-GST融合蛋白的Western blot分析Fig.2 Western blot analysis of recombinant RACK1-GST protein

图3 子孢子感染对RACK1转录水平的影响Fig.3 Effect of sporozoites infection on transcription level of RACK1
2.4 子孢子感染对RACK1蛋白翻译水平的影响 结果表明,随着子孢子感染细胞时间的增长,RACK1蛋白表达量不断增加,24 h组显著高于不感染组(P<0.05),而48 h组和72 h组的蛋白表达水平差异不显著(P>0.05),均显著高于24 h组和不感染对照组(P<0.05)(图4)。
2.5 兔抗RACK1-GST多抗对球虫子孢子入侵细胞的影响 结果表明,无抗体孵育细胞对照组的子孢子入侵率为26%;正常IgG能抑制子孢子的入侵,但与对照组相比差异不显著(P>0.05);100 μg/mL和200 μg/mL RACK1抗体作用细胞后对子孢子的入侵影响不大,入侵率与对照组和正常IgG组相比差异不显著(P>0.05),而300和400 μg/mL作用细胞能明显促进子孢子的入侵,入侵率显著高于对照组和对应浓度的正常IgG组(P<0.05)。
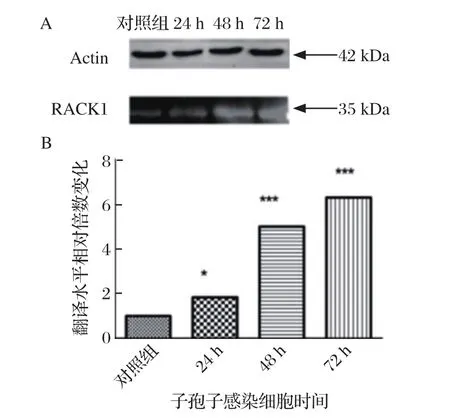
图4 子孢子感染对RACK1蛋白翻译水平的影响Fig.4 Effect of sporozoites infection on protein translation level of RACK1

图5 兔抗RACK1-GST多抗对子孢子入侵细胞的影响Fig.5 Effect of rabbit anti-RACK1-GST polyclonal antibody on sporozoites invading cell
3 讨论
RACK1是G蛋白β亚基的同族体,由GNB2L1基因编码,最早由Mochly-Rosen等[8]从大鼠脑组织的cDNA文库中克隆出来,并称其为一种全新活化的蛋白激酶C受体。已有研究表明,RACK1不仅可与细胞膜上活化的蛋白激酶C(protein kinase C,PKC)结合发生反应,还能结合多种胞浆蛋白或亚细胞结构,参与细胞内多条代谢通路,发挥一系列的生理作用。根据其与配体蛋白结合后是否被释放,可将其微观作用分为以下2个方面:完成对特定蛋白结构的转运,如其能与cAMP特异性磷酸二酯酶PDE4D5结合参与cAMP途径从而调节细胞增殖以及调控所结合酶的活性,如RACK1能与整合素integrin β结合,通过细胞外基质-整合素-细胞骨架的通路对细胞内的生化反应进行调控,继而发挥其在局灶粘着复合物中的挥脚手架蛋白作用[9-11];其还可以与受体蛋白酪氨酸磷脂酶PTPμ相结合调控以调控细胞间连接[12]。因此,RACK1在调节细胞代谢通路及生化反应方面发挥着重要的作用。本文对鸡源RACK1基因进行克隆,并对其在球虫子孢子感染细胞中的作用进行了研究。
本实验克隆的鸡RACK1片段大小为1002 bp,与已知的RACK1同源性为99%,编码317个氨基酸,相对分子质量约为35 kDa。生物信息学分析显示该编码蛋白无跨膜结构,无信号肽。结构功能域分析发现该蛋白可能含有1个N-糖基化位点,4个酪蛋白激酶II磷酸化位点,4个N-肉豆蔻酰化位点,7个蛋白激酶C磷酸化位点,1个酪氨酸激酶磷酸化位点,表明该蛋白的酶学活性可能受到其他蛋白的调节。利用NCBI的CDD程序对该基因编码的保守结构域进行搜索,结果显示其具有WD40重复结构域。将其克隆连接到表达载体pGEX-6P-1上,在大肠杆菌菌株中诱导获得了高效表达的可溶性重组蛋白,经GST柱纯化获得了较纯的重组蛋白,对纯化的蛋白以GST为一抗进行Western blot鉴定,证实所获得的蛋白为RACK1-GST融合蛋白。
为了研究RACK1在球虫感染中的作用,我们选择了鸡胚成纤维细胞(DF-1)作为模型。柔嫩艾美耳球虫寄生于鸡盲肠,选择DF-1细胞作为球虫培养细胞,更贴近宿主。子孢子入侵DF-1后,24 h发育为滋养体,48 h为未成熟裂殖体,72 h为第1代成熟裂殖体[13]。本文对子孢子入侵DF-1细胞不同时间段的RACK1转录水平和蛋白翻译水平检测发现,随着子孢子感染时间的增加,二者均明显增加。由此,表明子孢子的入侵会导致宿主RACK1的转录水平和蛋白水平上调,且两者的变化是同步的。为了探索RACK1对子孢子入侵的影响,我们选用了抗体与细胞共孵育的方法,结果表明兔抗rRACK1-GST多抗在低浓度孵育细胞的情况下对子孢子入侵宿主细胞影响不大,但在高浓度条件下能明显促进子孢子的入侵。从实验结果来看,推测RACK1蛋白可能在子孢子入侵宿主细胞过程中发挥了抑制作用。目前,未有RACK1蛋白对病原体感染细胞影响的报道,但发现有其他宿主蛋白对病原体感染影响的报道。李有文[14]研究了宿主核糖体蛋白L9对狂犬病毒生物学特性的影响,发现细胞内L9蛋白过表达能够显著抑制RABV的复制(10~20倍),干扰L9能够显著增强RABV复制(4~5倍),这些结果表明L9对RABV的复制具有重要的调节作用。张世伟[15]发现新城疫病毒感染DF-1细胞后,细胞的YB-1在转录水平和蛋白水平均出现上升趋势,提示新城疫病毒可能通过某种途径促进YB-1的mRNA的转录,而YB-1可能参与抗病毒的过程,不利于新城疫病毒的翻译和复制。说明宿主蛋白在病原体感染中发挥重要的作用。
本文对宿主RACK1蛋白在球虫子孢子感染宿主中的作用进行了研究,结果表明,子孢子入侵细胞后,细胞的RACK1转录水平和蛋白表达水平均明显提高,而抗体入侵抑制试验结果表明,高浓度的抗体可以明显促进球虫子孢子的入侵能力,提示RACK1在子孢子入侵宿主细胞过程中发挥了抑制作用。而随着子孢子在细胞内继续发育成滋养体和裂殖体时,虫体数量剧增,宿主细胞RACK1表达量进一步升高以继续与球虫对抗。以上结果表明,RACK1是负调控球虫入侵,但其具体机制还有待深入研究。
