航天搭载对嗜热链球菌G2的诱变作用及发酵性能评价
2018-09-06王莹孙二娜隋馨瑶赵亮孙健牛天娇张明文鹏程
王莹,孙二娜 ,隋馨瑶,赵亮,3,孙健,牛天娇,张明,文鹏程*
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070) 2(中国农业大学 食品科学与营养工程学院,北京,100083) 3(河北省畜产食品工程技术研究中心,河北 三河,065200) 4(蒙牛高科乳制品(北京)有限责任公司,北京,101107) 5(北京工商大学 食品学院,北京,100048)
航天搭载是把菌株搭乘返回式卫星送到太空,利用太空中特殊的环境诱变作用使菌株产生突变,主要是通过强辐射、微重力、高真空等太空综合环境因素诱发其变异。因为空间变异的突变频率高、突变谱广、变异幅度大同时变异性状稳定,所以航天诱变成为近年来发展迅速的新型微生物诱变育种技术[1]。航天诱变其有益突变可达2%~3%[2],且有益变异的频率比传统的γ射线处理要明显提高[3]。作为人工诱变的新途径,航天诱变对丰富种质资源、选育新品种具有重要的意义[4]。
嗜热链球菌是原核微生物中的链球菌属,是能够利用乳糖的同型发酵生成乳酸的兼性厌氧菌,为革兰氏阳性菌[5]。嗜热链球菌一般与德氏乳杆菌保加利亚亚种配合,作为发酵剂广泛应用于酸乳生产。嗜热链球菌产酸特性、代谢产物直接影响酸乳生产过程,以及风味、质构等酸乳品质。嗜热链球菌产酸速度快(主要在发酵前期产酸),且能缩短凝乳时间[6],提高生产效率,从而降低了酸乳的生产成本。菌株产生的胞外多糖不仅赋予酸乳特殊的风味和口感,而且还能提高其稳定性和持水性,从而减少酸乳在生产过程中稳定剂的使用[7-8]。但是不同的嗜热链球菌种直接会影响酸乳产品的质量,而且不同的菌株发酵特性也有较大差异,所以筛选出优良发酵性能的嗜热链球菌是制备发酵剂及酸奶的基础[9]。
嗜热链球菌G2是从新疆奶疙瘩中筛选出的1株产酸快、凝乳早且黏度高的菌株,将其作为出发菌株并搭载神舟十一号返回式飞船进行太空诱变处理,返回地面后进行菌株分离纯化,通过发酵及一系列产酸特性、产黏及产胞外多糖等指标的研究,以期获得具有优良发酵性状的突变株,并为优良发酵剂菌种的选择和发酵乳制品的开发提供理论依据。
1 材料与方法
1.1 原料
嗜热链球菌G2冻干菌粉置于无菌搭载小管中,搭载前4 ℃保存。“神舟十一号”返回式飞船2016年10月17日发射,2016年11月18日返回地面,飞行过程中样品置于飞船返回舱,返回地面后取出样品,由中国农业大学食品科学与营养工程学院功能乳品实验室保存备用。
1.1.1 培养基
10%复原脱脂乳用于菌株发酵试验,M17培养基用于嗜热链球菌的分离纯化。
1.1.2 主要仪器设备
LDZX-50KBS高压灭菌锅;LXJ-IIB高速台式离心机;UV-2102PC紫外可见分光光度计;DNP9082恒温培养箱 ;SNB-2黏度计;pH计;Biocreen C全自动生长曲线仪;JEM 1200EX透射电子显微镜;SU8010场发射扫描电镜。
1.2 试验方法
1.2.1 样品分离纯化[10]
搭载返回的G2冻干菌粉在无菌条件下称取0.1 g菌粉至9.9 mL生理盐水中,以10倍稀释法从10-1稀释到10-10,取5个稀释梯度10-4~10-8,分别吸取稀释液各1 mL,进行平板稀释,每个梯度做2个平行。平板在恒温培养箱中42 ℃培养48 h,随机挑选10个单菌落进行液体培养。在M17平板上进行多次划线纯化并挑取单菌落,经镜检确认为纯种,进行液体培养,作为搭载菌株用于后续实验。
1.2.2 脱脂乳培养基制备
10%脱脂乳粉10 mL于试管中,110 ℃灭菌10 min备用,将M17培养基培养的第2代菌接种于脱脂乳培养基待测。
1.2.3 生长曲线测定[11]
菌种以2%的接种量接种于新鲜的M17液体培养基中,42 ℃条件下进行培养,在不同时间点、600 nm处测定菌液的吸光度值。
1.2.4 pH值测定[12]
用pH计测定发酵乳的pH值。
1.2.5 酸度测定[13]
以0.5%酚酞作为指示剂,用0.1 mol/L的NaOH标准溶液滴定,用吉尔涅尔度(°T)表示。样品取3个平行,取其平均值。
1.2.6 黏度测定[14]
采用SND-2黏度计在室温下测定。读数选择停留时间较长且偏大的数值记录。样品取3个平行,取其平均值。
1.2.7 活菌数测定[15]
吸取1 mL发酵液至9 mL 0.8%生理盐水中,振荡混匀后采用10倍稀释,吸取1 mL稀释液进行平皿倾注,42 ℃恒温培养48 h,以测定发酵乳中嗜热链球菌的活菌数。
1.2.8 胞外多糖的分离与含量测定[16]
胞外多糖的提取:将第二代菌接入10%脱脂乳培养基中,发酵12 h,取10 mL发酵乳加入15%三氯乙酸,4 ℃下放置3 h,10 000 r/min离心30 min,取上清液备用。取上清液加入无水乙醇(1∶5,V∶V),4℃放置12 h;将上清液与无水乙醇的混合液10 000 r/min离心30 min,弃上清,加入10 mL蒸馏水,即为待测样品。采用苯酚-硫酸法测定多糖含量;测定时吸取样品1 mL,加入5%苯酚1 mL迅速摇匀,再加入5 mL浓硫酸冷却至室温,在490 nm处测定吸光值。
1.2.9 电镜测试
1.2.9.1 扫描电镜测试
取样:取大量样品离心(转速 3 000~4 000 r/min),去除上清液,加入适当 pH(7.2~7.4)的0.1 mol/L PBS清洗3遍;清洗时菌体温柔悬浮。固定:2.5%戊二醛固定3 h,用PBS清洗2遍,每遍10 min,再用纯水清洗2遍。梯度脱水:用乙醇的水溶液按体积分数为 30%、50%、70%、80%、90%的梯度对样品进行脱水,每步 15 min,之后在100%乙醇的水溶液中脱水 15 min×2次;再将样品置于乙醇和叔丁醇 1∶1(V∶V)混合液中15min;最后置样品于叔丁醇中 15 min×2次。冷冻干燥:滴加处理好的样品于5×5 mm的盖玻片上,置-80 ℃冰箱冷冻后放入冷冻干燥机(或者临界点干燥仪)中冷冻干燥。电镜观察:样品充分干燥后,进行扫描电镜观察。
1.2.9.2 透射电镜测试
取样:取大量样品离心(转速 3 000~4 000 r/min),去除上清液,加入适当 pH(7.2~7.4)的0.1 mol/L PBS清洗3遍;清洗时菌体温柔悬浮。固定:2.5%戊二醛固定3 h,用PBS清洗2遍,每遍10 min。再用纯水清洗2遍。梯度脱水。用乙醇的水溶液按体积分数为 30%、50%、70%、80%、90%的梯度对样品进行脱水,每步 15 min,之后在100%乙醇的水溶液中脱水15 min×2次;再将样品置于乙醇和叔丁醇 1∶1(V∶V)混合液中15 min;最后置样品于叔丁醇中15 min×2次。之后进行电镜观察。
1.3 数据处理与分析
所有数据均平行测定3次,使用SPSS19.0软件进行ANOVA方差分析,采用 ANOVA 进行方差分析,采用邓肯氏多重比较方法进行显著性分析。
2 结果与讨论
2.1 生长曲线
42 ℃条件下培养,每隔2 h在600 nm处测定菌液的吸光度值。它能够显示细菌生长繁殖的4个时期,即调整期、对数期、稳定期和衰亡期[17-18]。通过利用紫外分光光度计来测定菌液生长曲线能够实时监控菌体的生长情况[19]。从表1和图1可以看出,航天诱变得到的突变菌株B1-5、B2-1和B2-4生长状况与野生菌株G2大致相似,并没有发生明显改变,但是B1-1、B1-2、B1-3、B2-2、B2-5、B2-6和B2-7 OD600显著低于野生菌株G2。因此,将B1-5、B2-1和B-4作为后续试验待测菌株。

表1 搭载菌株生长曲线测定(OD600)Table 1 OD600 value within 24 h of Streptococcus thermophiles
注:同列字母不同,表示差异显著(p<0.05)。
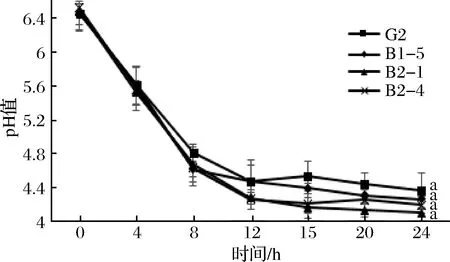
图1 四株嗜热链球菌发酵期间pH值的变化Fig.1 Change in pH during fermentation
2.2 pH值测定
嗜热链球菌作为常用的乳酸菌发酵剂之一,能够利用脱脂乳中的乳糖进行同型发酵产生乳酸,从而使发酵乳中的pH降低,滴定酸度升高。由图2可知,在发酵前4 h内突变株与野生株的pH变化不大,主要是由于在4 h内菌株正在处于延滞期,菌体活力较低,还没有开始生长[20]。从8 h开始,各菌株pH有所差异。当发酵到12 h时,G2发酵乳平均pH值从pH 6.46下降到pH 4.46,B1-5、B2-1和B2-4发酵乳的平均pH值分别从pH 6.45、pH 6.48和pH 6.52分别下降到pH 4.66、pH 4.27和pH 4.25,其中B2-1和B2-4的发酵乳平均pH值显著低于野生菌株G2(p<0.05);到达发酵终点24 h时,G2发酵乳平均pH值下降到pH 4.35,3株突变株发酵乳平均pH值下降到pH 4.25、pH 4.09和pH 4.18,与野生株均没有显著性差异(p<0.05)。
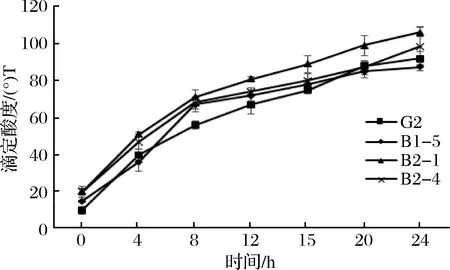
图2 四株嗜热链球菌发酵期间滴定酸度的变化Fig.2 Change in sample acidity during fermentation
2.3 滴定酸度测定
由图3可知,在发酵4 h时,野生株G2的滴定酸度从10 °T上升到40 °T,突变株B1-5、B2-1和B2-4的滴定酸度分别从15、20、20 °T升高到36、51、47 °T,且在4 h时发酵乳开始凝乳,利用乳糖生成乳酸使得酸度开始积累。当达到发酵终点24 h时,G2的滴定酸度达到92 °T,而突变株的滴定酸度分别是87.5、106和98.5 °T,且各菌株之间滴定酸度具有显著性差异(p<0.05)。同时,从表2可知,B2-1的产酸速率最大,达到3.58 °T/h。

图3 四株嗜热链球菌发酵期间黏度的变化Fig.3 Change in sample viscosity during fermentation

表2 嗜热链球菌发酵终点滴定酸度及产酸速率Table 2 Titration acidity at the end of the fermentation and acid-producing rate of Streptococcus thermophilus
注:同列字母不同,表示差异显著(p<0.05)。
2.4 活菌数测定
活菌数是评价发酵乳制品的重要指标之一,同时也是筛选优良发酵剂的重要标准之一[21]。当乳酸菌的活菌数大于106CUF/mL时,才会有乳酸菌在肠道中存活而发挥其保健作用[22]。从表3看出,嗜热链球菌在发酵至24 h期间活菌数都有不同程度的上升,说明在发酵期内,菌株活力良好。在发酵至16 h时,嗜热链球菌数量基本保持稳定。
2.5 黏度测定
在酸乳发酵过程中,嗜热链球菌可以通过酶的作用利用脱脂乳中的糖类形成一种活性物质胞外多糖(EPS),它是酸乳中天然的增稠剂,它与EPS达到含量呈正相关[23]。图4可以看出,黏度随着发酵时间的增加而增加,在发酵0~4 h期间,pH和滴定酸度变化较小,黏度变化不大,当发酵8 h时,其pH下降到4.6左右,酪蛋白达到了等电点开始发生变性,酪蛋白分子团的直径变大,黏度开始上升[24]。从图中看可以看出,突变株B2-1和B2-4的黏度显著高于野生株G2。
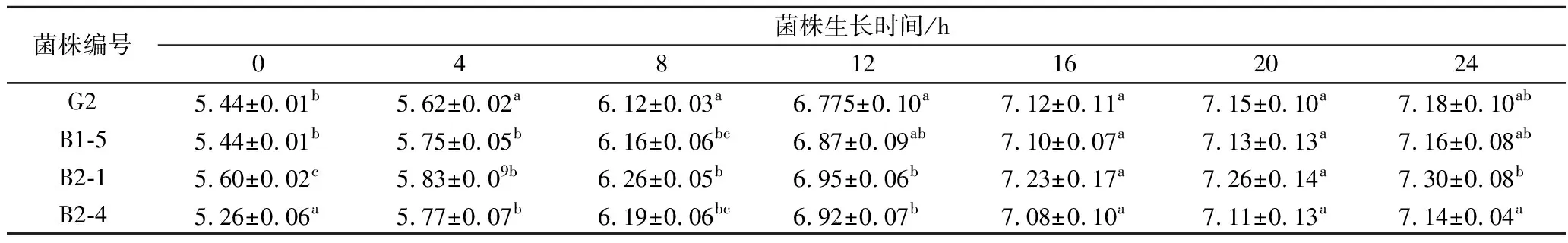
表3 菌株发酵期间活菌数的变化Table 3 Changes in viable cell count during fermentation
注:同列字母不同,表示差异显著(p<0.05)。
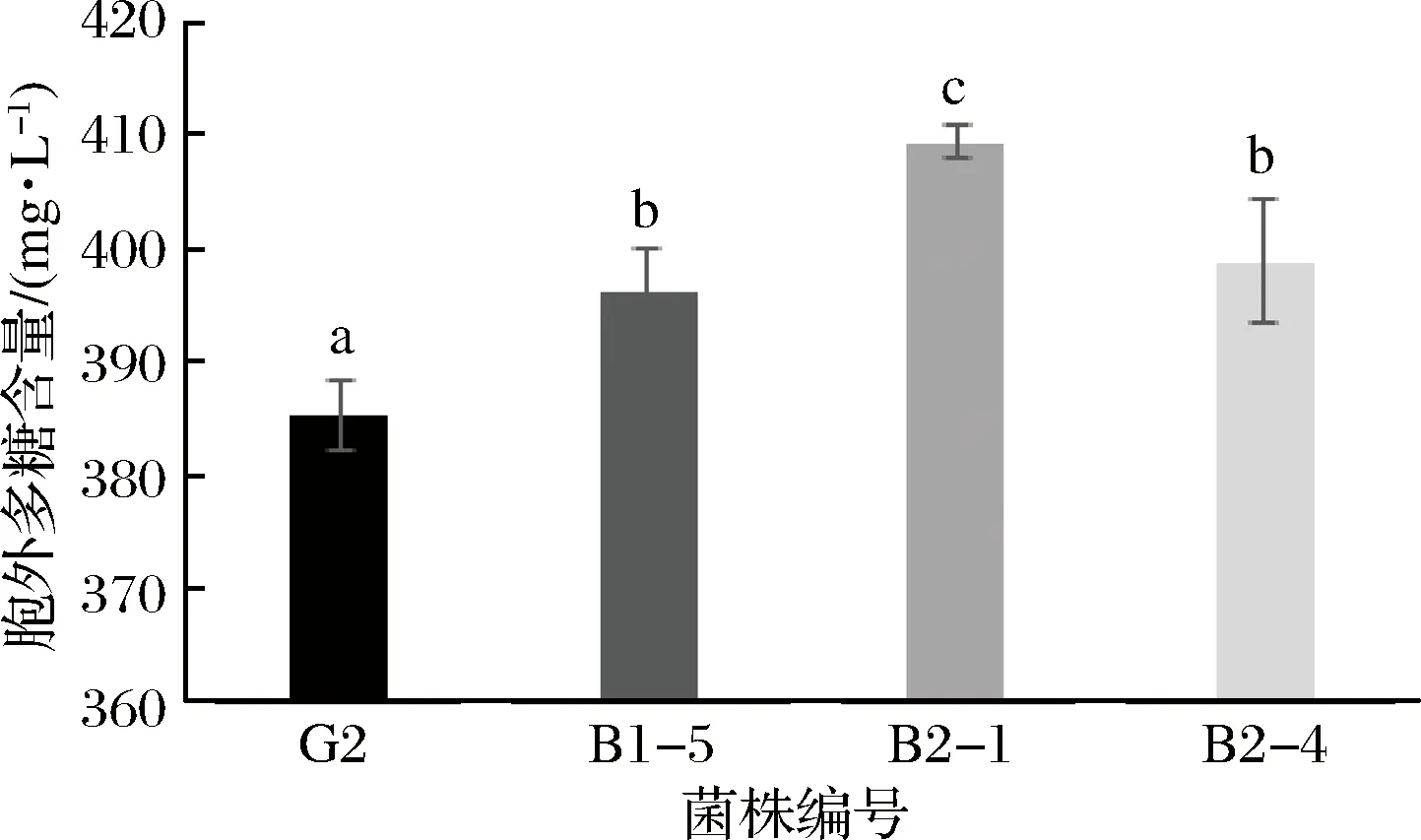
图4 三株嗜热链球菌胞外多糖含量Fig.4 Contents of EPS in Streptococcus thermophiles
2.6 胞外多糖含量测定
有报道称胞外多糖具有改善肠道微环境、增强人体免疫力等多种生理功能,能够提高产品的营养保健功能[25-26]。而嗜热链球菌是酸乳发酵过程中主要的产多糖菌株[27]。从图5中可知,突变株B1-5、B2-1和B2-4中的胞外多糖含量为396.14、409.35和398.80 mg/L,显著高于野生株G2的含量385.11 mg/L(p<0.05)。胞外多糖能够使酪蛋白分子之间更容易形成大分子,使分子直径变大,从而增加黏度,改善酸乳品质[24]。
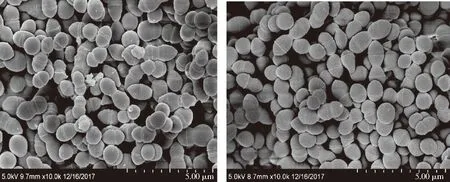
图5 野生株(左)与突变株(右)扫描电镜(SEM)形态学观察Fig.5 Microcopic observation under scanning electron microscopy

图6 野生株(左)与突变株(右)透射电镜(TEM)形态学观察Fig.6 Microcopic observation under transmission electron microscopy
2.7 电镜测试
嗜热链球菌菌落表面比较光滑,为白色或者淡黄色,革兰氏染色均呈阳性。通过扫描电镜和透射电镜可以看到,嗜热链球菌以2个卵圆型为1对的球菌连成长链。本试验中的野生株与突变株在形态上没有明显差异。
3 结论
通过对来自航天诱变的10株嗜热链球菌进行筛选并进行脱脂乳培养基42 ℃ 24 h发酵试验,测定发酵期间的pH值、滴定酸度、活菌数、黏度及胞外多糖含量等指标,分析了4株嗜热链球菌在发酵过程中的产酸特性,初步筛选出1株优良性状的嗜热链球菌。在42 ℃发酵期间,4株均在发酵开始后pH值迅速下降,达到发酵终点的时间约在12 h;其中突变株B2-1的pH值下降到4.09,滴定酸度为106 °T,且产酸速率最快,黏度及胞外多糖含量也显著高于野生菌株G2,但是在发酵期间活菌数变化不大。因此,通过航天诱变有可能改变嗜热链球菌的发酵性能,从而得到具有优良性状的菌株,为乳制品开发利用提供理论基础。
