枯草芽孢杆菌菌株B3抗菌肽的分离纯化与鉴定
2018-09-06白杰贠建民祝发明严海娇张紊玮艾对元
白杰,贠建民*,祝发明,严海娇,张紊玮,艾对元
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070) 2(甘肃省生物抗菌肽工程技术研究中心,甘肃 张掖,734000)
抗菌肽(antibacterial peptides)又称抗微生物肽(antimicrobial peptides,AMPs),是生物体在抵抗病原微生物的防御反应过程中产生的一类具有抗微生物活性的小分子多肽。目前,在不同动、植物组织和微生物中都已经被发现,并被证实有抗菌作用的蛋白质和多肽也是其先天免疫系统中重要的组成部分[1]。这些抗菌肽具有抗菌能力强、抗菌谱广、种类多、可供选择范围广、靶菌株不易产生抗性突变等特点,同时鉴于许多微生物已对抗生素产生抗药性,因此,抗菌肽预计将成为新一代的临床抗菌药物,并且在化妆品、生物农药、动物饲料添加剂、天然食品防腐剂、动植物抗病基因工程等方面具有广阔的应用前景[2-3]。
自1972年,瑞典的科学家BOMAN等人首先在果蝇中发现抗菌肽及其免疫功能方面的活性以来,直到1981年《Nature》杂志上公布的来自STEINER等人发现的CecropinA、B的氨基酸序列被认为是第一个真正意义上的抗菌肽[4]。在此后多年时间里,人们相继从微生物和动植物甚至人体内发现、分离获得了多种具有抗菌能力的活性多肽。BAGHIAN等研究发现,用与蜂毒素类似的合成物与疙疹病毒(HSV-1)作用时,能抑制HSV-1感染细胞的破裂和病毒扩散,蜂毒素的存在不仅能够影响糖蛋白的合成,还可通过调整细胞Na+/K+泵而保护细胞从而阻止了细胞的裂解,因而对宿主细胞的蛋白质合成和生长不会产生影响[5-6]。STEIN发现枯草芽孢杆菌(B.subtilis)具有产生二十多种结构多样化抗菌化合物的潜力[7],在这些抗微生物化合物中,表面活性素和神经蛋白的环状脂肽等在生物技术和生物制药应用中具有广泛认可的潜在用途[8-9]。迄今为止,已发现的Cereopin A,Myfimycin,Thanafin和Drosomycin等生物活性小肽都具有抗真菌的作用[10-11]。近年来,张东玲等人在研究针对单一抗菌肽用不同层析柱分离纯化中发现凝胶过滤层析柱与反相液相层析柱的联用改善日本鳗鲡肝脏抗菌肽分离纯化效果良好,洗脱峰数量较多,峰形单一且尖锐狭窄,基线平而低[12]。喻钢等人建立了基于制备型反相色谱柱分离纯化枯草芽孢杆菌细菌素类抗菌活性物质方法[13]。目前抗菌肽的分离纯化方案大多是基于抗菌肽分子量较小、带正电荷和两亲性等特性,采用多级纯化手段[14]。尽管抗菌肽具有巨大开发潜力,但对其结构信息与活性功能之间的关系还不甚了解[15],建立高效的抗菌肽分离、纯化和检测方法是开展相关理论研究和应用开发的基础。
本研究以枯草芽孢杆菌B3菌株液态发酵产物为样品,拟采用串联层析系统,通过由阳离子交换层析、疏水层析和尺寸排阻层析3种层析组成的层析系统,根据发酵液中目的抗菌肽与杂蛋白具有电荷差异、疏水差异、分子大小差异的原理,分别去除其他物质从而达到纯化的效果。并将经串联层析系统和反向色谱技术纯化后的抗菌肽,通过MALDI-TOF-MS质谱分析对得到具有抑菌活性的小分子多肽进行分子质量及结构信息分析,旨在为获得抗菌肽纯品及其结构信息,并为抗菌肽制备及抗菌肽制品检测提供方法参考。
1 材料与方法
1.1 材料与试剂
1.1.1 靶标菌株
大肠杆菌(CGMCC10003)和沙门氏杆菌(CGMCC10467),由中国普通微生物菌种保藏管理中心提供。
1.1.2 拮抗菌株
本实验室前期从甘肃河西盐碱土壤中分离获得1株对大肠杆菌(Escherichiacoli)和沙门氏杆菌(Salmonellaentericasubsp.enterica)具有拮抗作用的细菌菌株B3,经鉴定为枯草芽孢杆菌B3(BacillussubtilisB3)。
1.1.3 培养基
LB液体培养基、LB固体培养基:参考《分子克隆实验指南》中培养基配方配制。
1.1.4 试剂
Capto S离子交换层析介质,GE Healthcare有限公司;苯基-琼脂糖凝胶,北京索莱宝科技有限公司;Sephadex G-100凝胶柱,上海玉博生物科技有限公司(Pharmacia);氨苄青霉素,上海莼试生物技术有限公司;NaCl、KH2PO4、K2HPO4,天津市盛奥化学试剂有限公司;酵母提取物、蛋白胨、琼脂粉,北京兰博利德商贸有限公司。
1.2 仪器与设备
HL-2恒流泵,上海精科实业有限公司;离心机,德国Sigma实验室离心机股份有限公司; DHP-9012电热恒温培养箱,上海立久自动化设备有限公司;洁净工作台,北京东联哈尔仪器制造有限公司;LDZX-50KBS立式压力灭菌锅,上海博迅实业有限公司医疗设备厂;101型鼓风干燥箱,北京市永光明医疗仪器有限公司;冷冻干燥机,上海比朗仪器制造有限公司;反向高效液相色谱仪(WATERS 2695型)、反射式基质辅助激光解吸附飞行时间串联质谱( USA ABI-4800型)、UV-5800PC紫外分光光度计,上海华锡生物科技有限公司。
1.3 方法
1.3.1 抗菌粗提物的制备
从甘肃河西盐碱土壤中发现1株对大肠杆菌(E.coli)和沙门氏杆菌(S.entericasubsp.enterica)具有抑菌作用的枯草芽孢杆菌B3菌株(BacillussubtilisB3),将该枯草芽孢杆菌B3菌株接种到LB液体培养基中,于37 ℃、250 r/min振荡培养48 h,11 000 r/min离心20 min收集上清液,得到的上清液即为抗菌粗提物。
1.3.2 抗菌活性物质的分离纯化
1.3.2.1 阳离子交换层析
采用Capto S阳离子柱对上述抗菌粗提物进行层析。用0.02 mol/L, pH 5.8的磷酸盐缓冲液平衡层析柱,将抗菌粗提物以2 BV/h的速度上样,随后以0.03~0.12 mol/L、pH 5.8的磷酸盐缓冲液进行洗脱,每5 min收集1次洗脱液,分别用紫外分光光度计在波长280 nm处测其吸光度,绘制吸光值曲线图[16],并采用1.3.5方法进行抑菌试验,收集具有抑菌圈的洗脱液,绘制抑菌直径曲线图[17]。
1.3.2.2 疏水层析
以苯基-琼脂糖凝胶作为疏水介质对上述1.3.2.1收集的洗脱液进行疏水层析,其中采用0.02 mol/L、pH 5.8的磷酸盐缓冲溶液平衡后,以2 BV/h的速度上样,随后依次用0.05、0.04、0.03、0.02、0.01 mol/L的pH 5.8的磷酸盐缓冲溶液进行梯度洗脱,每5 min收集1次洗脱液,绘制吸光度曲线,评价分离效果,并进行抑菌试验,收集具有抑菌圈的洗脱液,绘制抑菌直径曲线图[18-19]。
1.3.2.3 尺寸排阻层析
以Sephadex G-100凝胶柱对有抑菌活性的组分进行纯化,其中采用0.02mol/L,pH 5.8的磷酸盐缓冲溶液平衡后,以2 BV/h的速度上样,随后以pH 5.8的磷酸盐缓冲溶液进行洗脱,每5 min收集1次洗脱液,绘制吸光度曲线,评价分离效果,并进行抑菌试验,收集具有抑菌圈的洗脱液,绘制抑菌直径曲线图[20]。
将上述逐步层析后的具有抑菌活性的洗脱液,进行冷冻干燥,得到的即为抗菌肽,-20 ℃保存,备用。
1.3.3 反相HPLC分离纯化抗菌物质[21-22]
①样品处理: 将经过串联层析系统纯化后的半纯品溶于双蒸水中,溶液浓度为300 mg/mL,0.22 μm微孔滤膜过滤备用。②色谱条件:ZORBAX 300 StableBond (300SB) C8色谱柱(4.6 mm×250 mm,5 μm) 流动相A:0.1%的三氟乙酸水溶液;流动相B:80%的乙腈水溶液;柱温:25 ℃,检测波长:280 nm;最大压力:200 bar;时间:65 min;流速:0.700 mL/min;上样量:20 μg。收集各个峰样品,冷冻干燥。以沙门氏菌作为指示菌,进行抑菌实验检测各个峰的活性。
1.3.4 B3抗菌物质的基质辅助激光解吸附飞行时间质谱(MALDI-TOF-MS分)析
收集反相HPLC分离纯化得到的活性峰,通过基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)质谱分析,NCBI数据库检索和比对。质谱检测条件:鞘气体流量15 arb,辅助气体流量5 arb,热喷涂电压4.7 kV,毛细管温度 275 ℃,毛细管电压49 V,套管透镜补偿电压 120 V。
1.3.5 抑菌活性检测[23]
采用双层琼脂孔穴扩散法并稍作改动。以大肠杆菌(CGMCC10003)和沙门氏杆菌(CGMCC10467)为靶标菌。将大肠杆菌和沙门氏杆菌分别接种至LB液体培养基与营养肉汤培养基,于37 ℃振荡培养15 h,备用。将加热融化的LB固体培养基15 mL注入到无菌平皿中待凝固后形成底层并放置牛津杯,吸取靶标菌液各100 μL,分别加入装有未凝固且不烫手的LB固体培养基三角瓶中,混匀,倾注30 mL到平皿中待凝固后形成上层,凝固后取出牛津杯形成有孔穴的培养平板,然后在培养基已形成的孔洞里加入200 μL的待检样液,并做阴性、阳性对照。其中阴性对照为缓冲液,阳性对照为质量浓度100 μg/mL的氨苄青霉素溶液。置于37 ℃培养箱内培养15 h,观察抑菌效果,测量抑菌圈直径。试验重复3次,计算平均值。
1.3.6 抗菌肽的理化性质
1.3.6.1 最小抑菌质量浓度测定
将定量由上述方法纯化后的样品做2倍递减质量浓度稀释,分别为0.010 156、0.020 312、0.040 625、0.081 25、0.162 5、0.325、0.65、1.3 μg/mL,对2株靶标菌分别做抑菌试验,以抑菌圈直径在10 mm以上作为依据来确定最小抑菌质量浓度。试验重复3次,计算平均值[24]。
1.3.6.2 耐热性检测
将定量由上述方法纯化后的样品配成质量浓度为1.0 mg/mL的溶液,在40、50、60、80、90、100、110、120 ℃下分别加热30 min,对2株靶标菌分别做抑菌试验,以未经加热的纯化样品为对照,观察抑菌圈直径变化[25]。试验重复3次,计算平均值。
1.3.6.3 耐酸碱度检测
将定量由上述方法纯化后的样品配成质量浓度为1.0 mg/mL的溶液,分别调pH值至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,放置10 min,对大肠杆菌及沙门氏杆菌做抑菌实验,观察抑菌圈直径变化,以pH 5.8的纯化样品为对照[26-27]。试验重复3次,计算平均值。
1.3.6.4 光照稳定性检测
将定量由上述方法纯化后的样品配成质量浓度为1.0 mg/mL 的溶液,在日光灯下放置10 min、30 min、1 h、6 h、24 h、48 h,对大肠杆菌及沙门氏杆菌做抑菌实验,观察抑菌圈直径变化,以未经日光灯照射的纯化样品为对照。试验重复3次,计算平均值。
2 结果与分析
2.1 串联柱层析系统分离结果
2.1.1 离子交换层析结果
抗菌肽通常为具有阳离子特性的多肽[28]。阳离子交换层析是利用离子交换剂(即交换介质)上的可交换离子与周围介质中被分离的各种离子间的亲和力不同,即利用离子交换剂的荷电基团,吸附样品溶液中相反电荷的离子或离子化合物,被吸附的物质随后被带同类型电荷的其他离子所置换而被洗脱,由于各种不同的离子或离子化合物对离子交换剂的结合力不同,因而洗脱的速率不同形成了层析层从而达到分离的目的。本试验采用Capto S柱,首先对发酵液进行了层析分离,结果见图1。
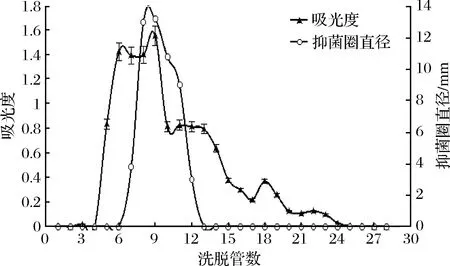
图1 离子交换层析分离效果Fig.1 Separation effect of ion exchange chromatography
在Copto S离子交换色谱图1中可以看出,各色谱峰之间分离效果还较差,色谱峰信号较弱。但实验证明了该抗菌肽具有阳离子交换特性,属于阳离子肽或具有阳离子特性的多肽。
发酵液经Capto S层析后,洗脱共收集30管样品,做抑菌实验发现第8管前后的收集液有抗菌活性,将有活性管合并,再用疏水层析柱层析。
2.1.2 疏水层析结果
疏水层析是利用多肽/蛋白质的疏水基团与亲水基团进行分离,多肽/蛋白质的表面通常具有疏水性基团,其与层析介质中带有疏水性的载体在高盐浓度时会结合,离子强度(盐浓度)越高,结合所形成的疏水键越强,由于形成的结合力不同从而达到分离的目的。本试验采用苯基-琼脂糖凝胶作为疏水介质,对2.1.1中收集到的抑菌活性部分进行分离,结果见图2。
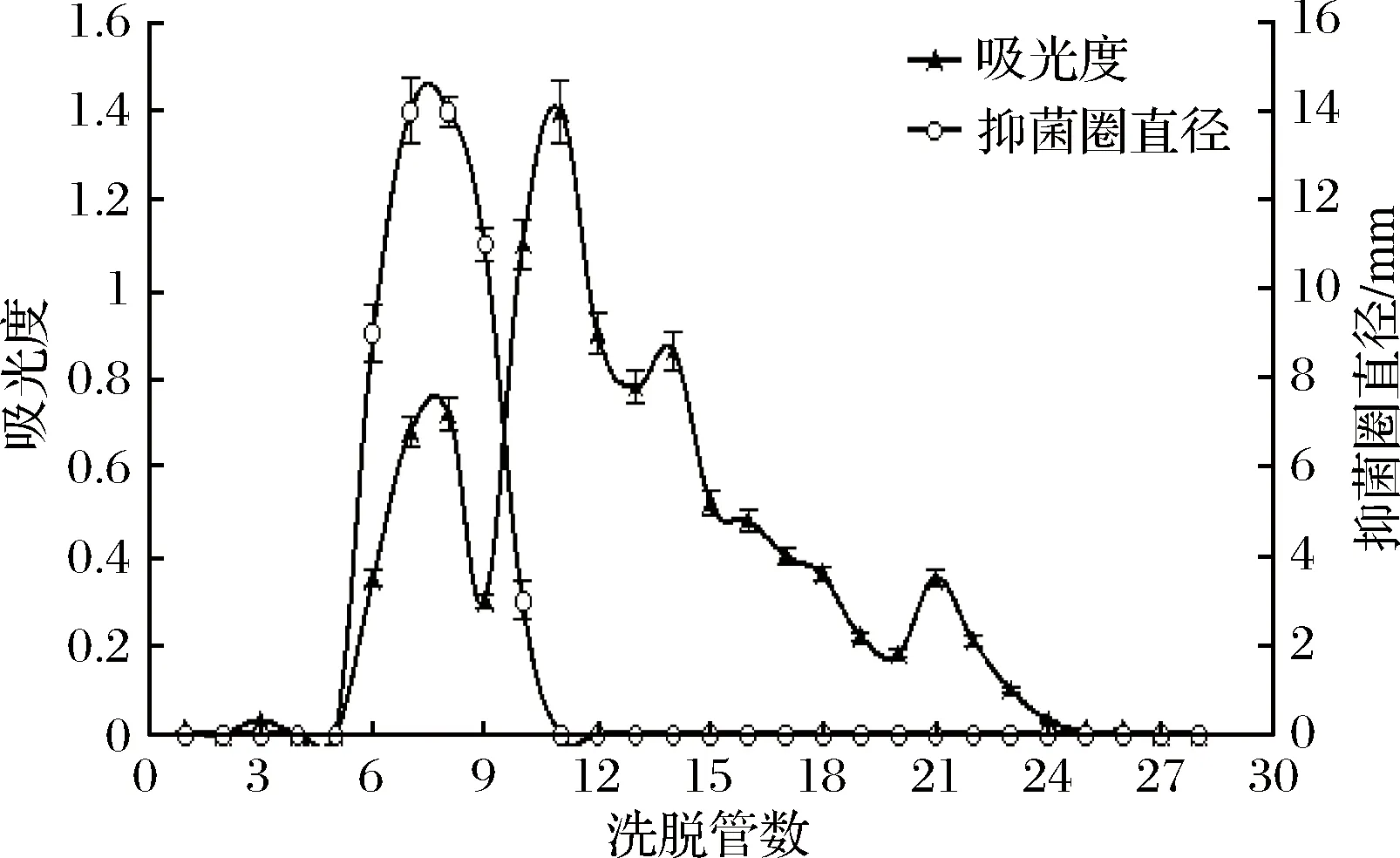
图2 疏水层析分离效果Fig.2 Separation effect of hydrophobic chromatography
图2显示,经过疏水层析后,其色谱峰分离效果较离子交换层析有所提高,但各蛋白质峰仍然相互重叠,不能被完全分开。对分步收集样品做抑菌活性试验,发现第7管有1个明显的色谱峰,且该时间段的样品有抑菌活性。
2.1.3 尺寸排阻层析结果
尺寸排阻层析是基于分子的大小不同进行分离,是一种非吸附形式的层析方法,因此缓冲液的成分不会直接影响分离结果,目的抗菌肽可以在广泛的pH值及离子强度下进行物质的分离。本试验采用葡聚糖凝胶G-100作为填料对上述收集的活性洗脱液进行尺寸排阻层析,结果见图3。
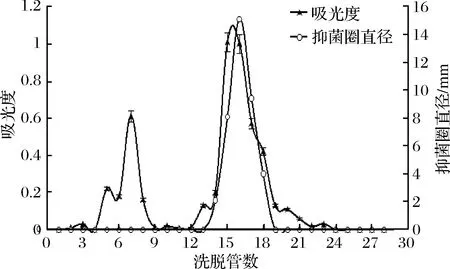
图3 尺寸排阻分离效果Fig.3 Separation effect of size exclusion
图3显示,样品色谱峰分离效果较疏水层析有所提高,有明显的优势峰,抑菌活性试验发现第16管有抑菌活性,收集活性组分,冷冻干燥备用。
2.1.4 分步层析分离物的抑菌活性比较
以质量浓度为100 μg/mL的氨苄青霉素溶液为阳性对照,缓冲液为阴性对照,开展了分步串联层析不同层析柱收集液对E.coli和S.entericasubsp.enterica抑菌试验比较,结果见图4和表1。对于2株供试靶标菌而言,氨苄青霉素阳性对照均具有明显抑菌圈,而阴性对照蒸馏水则无抑菌圈。在串联柱层析系统中,3种层析均收集到了能够抑制2株供试靶标菌的活性组分,阳离子交换层析活性相对弱于疏水层析和尺寸排阻层析收集到组分的抑菌活性,而经过疏水层析收集到组分的活性又相对弱于尺寸排阻层析收集到组分的活性。即抑菌活性(抑菌圈)大小顺序为:阳离子交换层析<疏水层析<尺寸排阻层析。
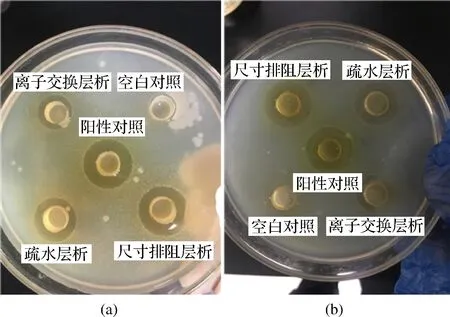
a-靶标菌为大肠杆菌;b-靶标菌为沙门氏杆菌图4 串联柱层析收集液抑菌实验Fig.4 Antibacterial activity of tandem column chromatography

表1 串联柱层析收集液抑菌直径Table 1 The antibacterial diameter of the column chromatography
注:“-”表示无活性;CK为0.02 mol/L、pH 5.8 PBS缓冲液;阳性对照为:100 μg/mL的氨苄青霉素溶液;不同字母表示不同处理间差异显著。
2.2 反相HPLC分离纯化抗菌物质
按照1.3.3所述的色谱条件进行反相 HPLC分离纯化,收集每峰共19个样品,冷冻干燥。以沙门氏菌作为指示菌,进行抑菌试验检测每个样品的活性。结果表明:第8峰样品组分具有明显的抑菌效果,结果见图5和表2。
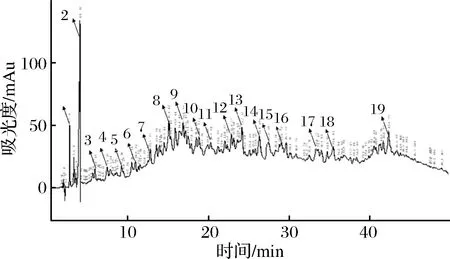
图5 半纯品的高效液相色谱检测结果Fig.5 Semi-pure liquid with high performance liquid chromatography
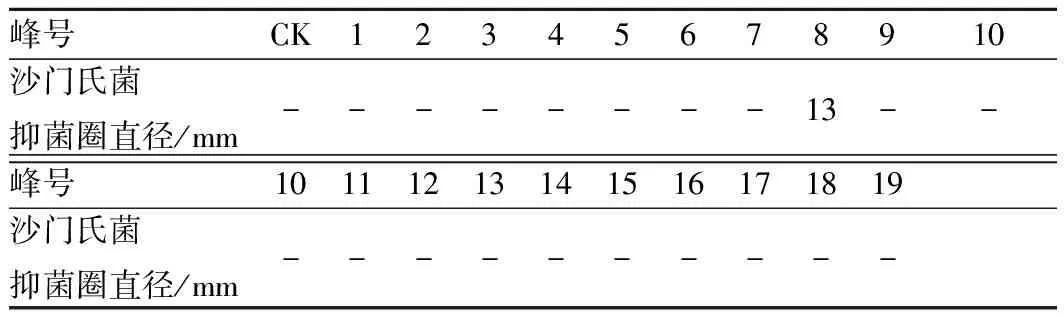
表2 RP-HPLC色谱各洗脱峰抑菌效果Table 2 Antibacterial effect of elution fractions purification from RP-HPLC chromatography
注:“-”表示无活性;CK为0.02 mol/L、pH 5.8 PBS缓冲液。
2.3 质谱分析抗菌肽氨基酸序列
经反相HPLC分离后抗菌活性组分进行MALDI-TOF-MS分析(图6)得到该抗菌肽的氨基酸序列为:Pro-Tyr-Ile-Pro-Gln-Pro-Arg-Pro-Pro-His-Pro-Arg-Leu,是一种富脯氨酸抗菌肽。由ExPasy中的ProtParam软件计算得到其分子质量为1 567.86 Da,等电点为10.84。将该肽段的氨基酸序列利用NCBI做同源性分析[29],与之序列相似性最高的仅为44.3 %,发现其为一种未报道的多肽,结果未发现有与之序列相匹配的蛋白质,可以证明本研究分离纯化到的B.subtitesB3抗菌肽很可能是一个新的蛋白质。
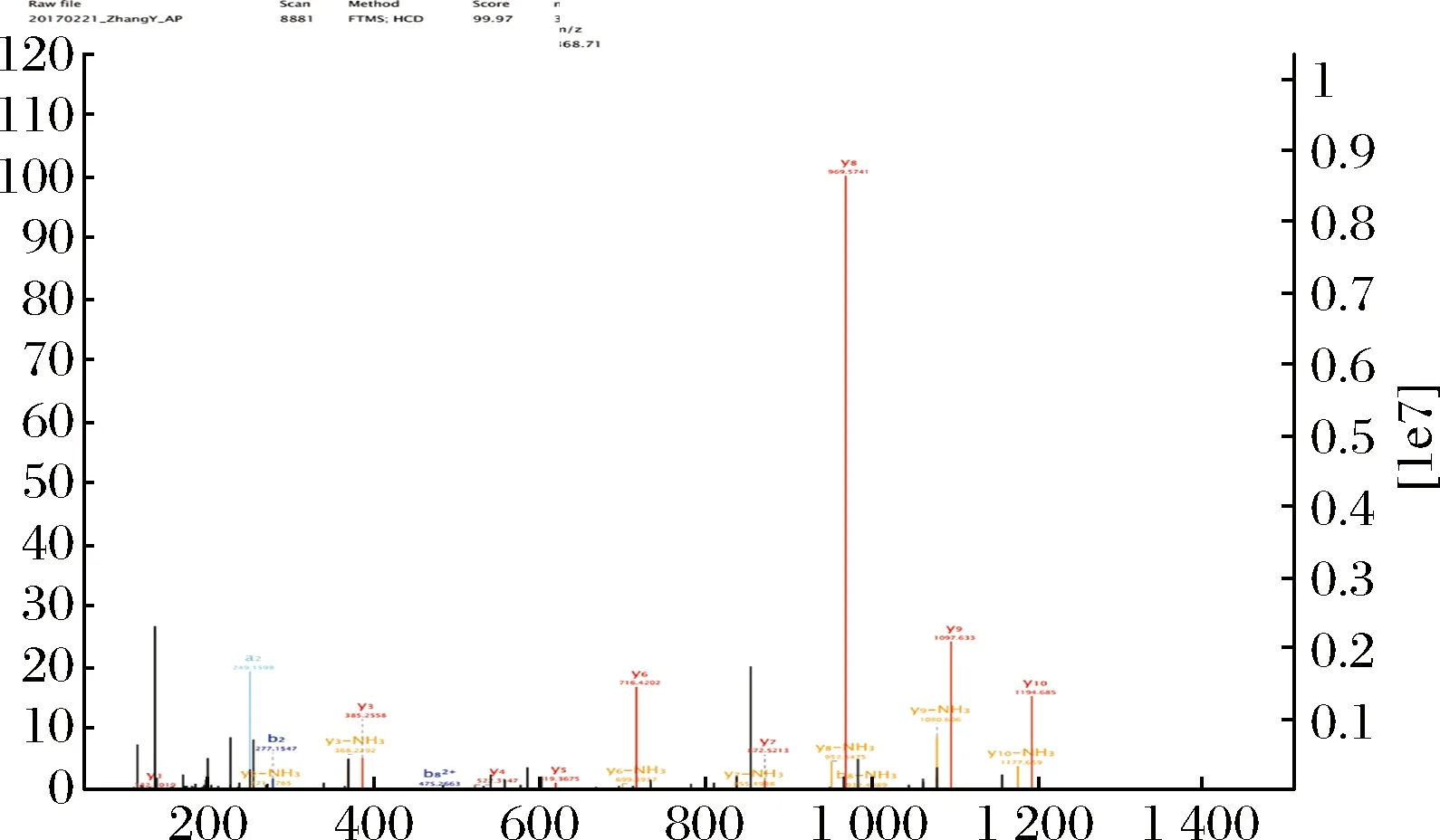
图6 质谱分析谱图Fig.6 Tandem mass spectrometry
2.4 最小抑菌浓度测定
由表3可知,该抗菌肽对E.coli和S.entericasubsp.enterica都有抑菌效果,且在浓度较低时依然保持稳定的活性,对2种靶标菌的最小抑菌质量浓度均为0.020 312 μg/mL。

表3 抗菌肽的抑菌活性Table 3 Antibacterial activity of antimicrobial peptides
注:—无抑菌效果。
2.5 耐热性检测
由图7可知抗菌肽在40~100 ℃加热后对E.coli和S.entericasubsp.enterica的抑菌活性变化不大,在100 ℃以下没有显著的变化,而在110 ℃抑菌活性出现下降,在121 ℃加热后丧失抑菌活性,可见抗菌肽在110 ℃以下具有较好的耐热性。
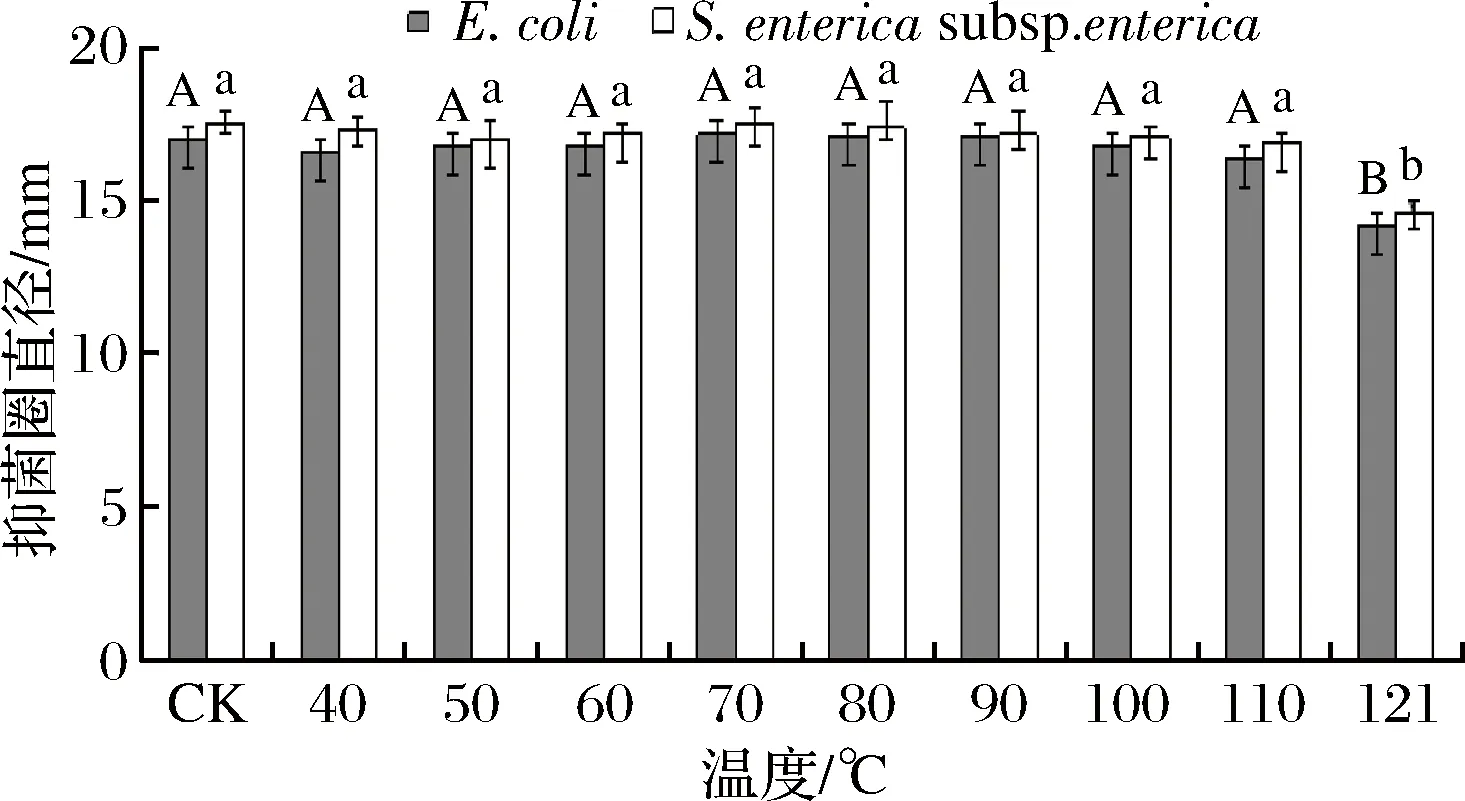
图7 不同温度加热对抗菌肽抑菌活性的影响Fig.7 Effects of different temperature heating on antimicr-obial activity of antibacterial peptides注:竖线表示标准误(±SE),不同字母表示不同处理间差异显著。
2.6 耐酸碱度检测
由图8可知抗菌肽在pH 4~11时具有较稳定的抑菌活性,当pH超过11后抑菌活性明显受到影响,可见,该抗菌肽对酸、碱度具有较好的稳定性。
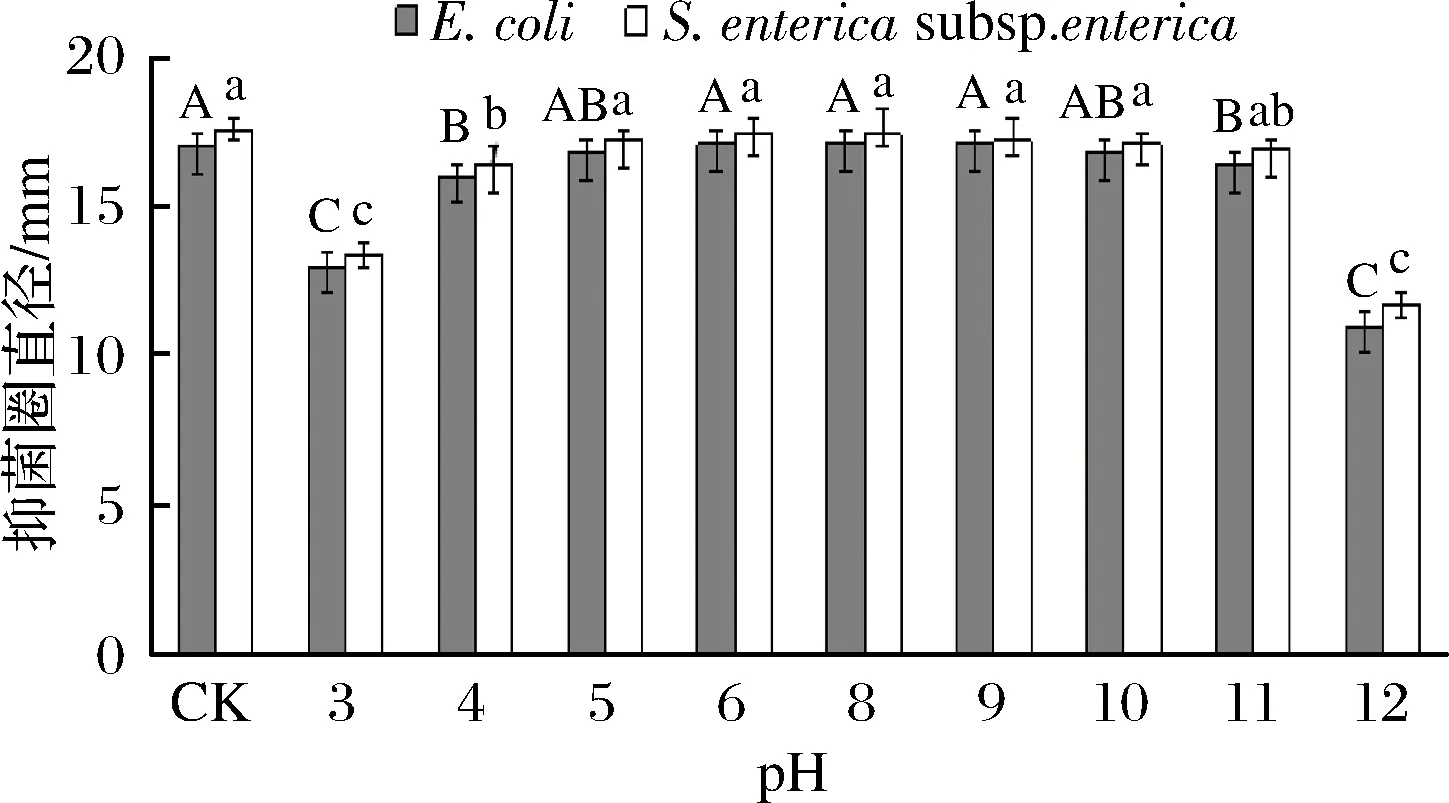
图8 不同pH对抗菌肽抑菌活性的影响Fig.8 Effects of different pH on antimicrobial activity of antibacterial peptides注:竖线表示标准误(±SE),不同字母表示不同处理间差异显著。
2.7 光照稳定性检测
由图9可知该抗菌肽在光照射时长10 min~48 h处理后对E.coli和S.entericasubsp.enterica的抑菌活性没有变化,可见该抗菌肽对光照具有较好的稳定性。
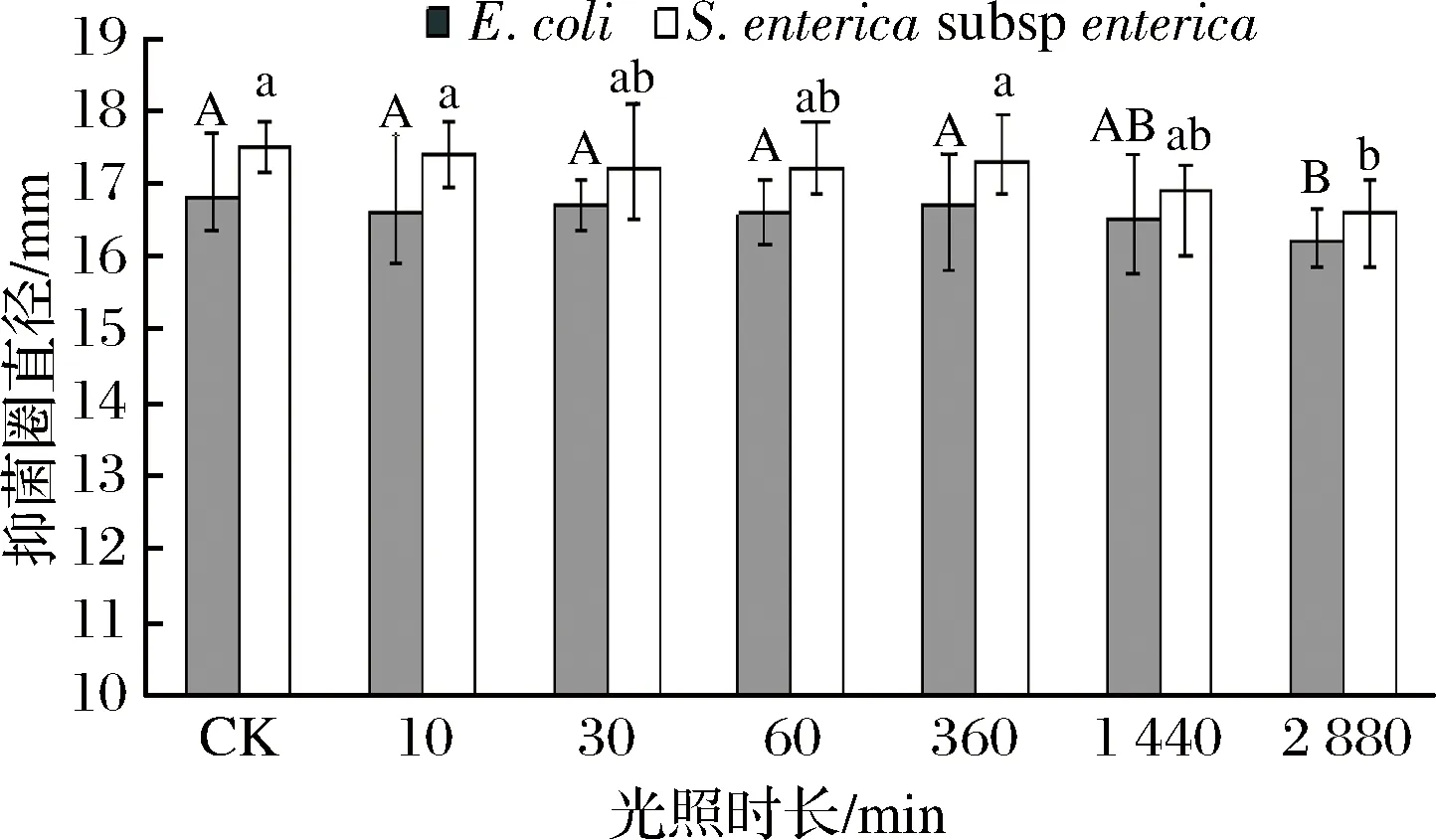
图9 不同光照时长对抗菌肽抑菌活性的影响Fig.9 Effect of different illumination time on antimicrobial activity of antibacterial peptides(注:竖线表示标准误(±SE),不同字母表示不同处理间差异显著。)
3 讨论
枯草杆菌具有良好的分泌性和非致病性等生物学特点,从枯草芽孢杆菌中提取抗菌肽具有广阔的开发前景[30]。徐建研究了表达PBD-2和cecropin P1抗菌肽的枯草芽孢杆菌,其所得的抗菌肽活性稳定,对多种革兰氏阴性菌,特别是肠杆菌科(Enterobacterhormaeche和Edwards)细菌,具有很强的伤杀作用,而对包括乳酸乳球菌(Lactococcuslactis)在内的革兰氏阳性菌不起作用,并且对真核细胞没有毒性作用[31];庄国宏等人研究了1株能产生对大肠杆菌(E.coli)具有明显抑杀作用抗菌肽的枯草芽孢杆菌菌株,其所得的抗菌肽具有抑菌谱较广、性质稳定的特点,在初步机理的研究中还发现该菌能够引起肠杆菌细胞膜穿孔,细胞内大分子物质泄漏、代谢活力下降及菌体破裂等,从而达到抑菌杀菌功效[32]。
本研究获得的产抗菌肽枯草芽孢杆菌B3菌株,经一系列试验证明,其产生的抗菌肽对E.coli和S.entericasubsp.enterica具有高效的抑菌效果,而且部分理化性质稳定,具备开发为一种高效新型抑菌剂的潜质,可为新型抗菌肽的开发提供菌株来源。但如何保证抗菌肽在外源性蛋白酶中的稳定性,避免抗菌肽发生降解而降低活性等问题,将是今后进一步研究的重点。同时,由于目前对于抗菌肽的开发利用主要是基于其高效抑菌性和独特抑菌机理而进行的。因此,探明枯草芽孢杆菌B3菌株来源抗菌肽的抑制作用机理也很必要,在开发相关产品之前亟待研究解决。
4 结论
综合采用串联柱层析法和反相色谱方法,从一株分离自甘肃河西盐碱土壤中的枯草芽孢杆菌B3菌株(BacillussubtilisB3)发酵液中,分离纯化出了一种对大肠杆菌(E.coli)和沙门氏杆菌(S.entericasubsp.enterica)具有抑菌作用的抗菌肽,并以其菌株发酵产物为样品,经串联层析系统和反向色谱技术纯化后的抗菌肽,通过MALDI-TOF-MS质谱对其进行了结构信息分析,结果表明该抗菌肽是一种小分子的富脯氨酸抗菌肽,其氨基酸序列Pro-Tyr-Ile-Pro-Gln-Pro-Arg-Pro-Pro-His-Pro-Arg-Leu,分子质量为1 567.86 Da,等电点为10.84。经NCBI数据库比对,发现其为一种未报道的多肽。该抗菌肽对大肠杆菌(E. coli)和沙门氏杆菌(S.entericasubsp.enterica)的最小抑菌质量浓度均为0.020 312μg/mL。同时,该抗菌肽表现出较强的耐热性、耐酸碱性和光照稳定性。
