两株具有缓解代谢综合征功能的人源益生菌的安全性评价
2018-09-06朱广素王刚王园园马方励赵建新张灏陈卫
朱广素,王刚*,王园园,马方励,赵建新,张灏,陈卫
1(江南大学 食品学院,江苏 无锡,214122)2(无限极(中国)有限公司,广东 广州,510623)
人体肠道是一个多元化、充满活力的微生态系统,为微生物的生长繁殖提供了绝佳的营养环境[1-2]。人体肠道菌群按照生理功能不同分为3类:共生菌、条件致病菌和病原菌[3]。双歧杆菌属和乳杆菌属是肠道共生菌中重要的两类菌,因其在促进消化、改善胃肠道健康、增强肠道免疫、抑制致病菌生长、调节肠道菌群稳态等方面发挥重要作用,被作为益生菌,广泛地用于膳食补充剂和特定的功能性食品[4-7]。
参照联合国粮食及农业组织(FAO)/世界卫生组织(WHO)和欧盟制定的益生菌安全性评估指南[8-9],对于将作为益生菌使用的乳酸菌,需从以下步骤判断其安全性:1)传统的生理生化检测,以确定其生物学分类及菌株培养等基本信息;2)体外致病基因检测,确保该菌株无致病性基因;3)抗生素抗性实验和细菌易位实验,检测菌株是否具有耐性药和转移性;4)体内致病性检测,包括动物实验和临床试验。按照我国《保健食品检验与评价技术规范2003版》[10]的要求,安全性毒理学评价实验分为4个阶段:1)急性毒性试验;2)遗传毒性试验,30 d喂养试验,传统致畸实验;3)亚慢性毒性实验——90 d喂养试验、繁殖试验、代谢试验;4)慢性毒性试验(包括致癌试验)。对于有长期安全使用历史的乳酸菌,可以先进行第一、二阶段的毒性试验,经初步评价后,决定是否需要进行下一阶段的毒性试验。
本研究团队前期对来自中国不同地区长寿村健康人体粪便样品中的乳酸菌进行了分离鉴定,研究了其耐酸耐胆盐等生理生化特性及生理功能,并对其全基因组信息进行了分析检测。在上述研究的基础之上,参照相关的国家标准要求[10-13],对其中具有显著缓解代谢综合征功能的青春双歧杆菌Z25和罗伊氏乳杆菌138-1进行安全性评价,包括急性毒性实验、28 d短期毒理实验、致畸实验、细菌移位实验,以确定其是否能作为安全、可食用的益生菌用于后续的产品研发。
1 材料与方法
1.1 试剂与设备
主要试剂:MRS培养基,青岛海博生物技术有限公司;生理盐水,辰欣药业股份有限公司;本研究所用试剂盒均购于南京建成生物技术公司;其他常用试剂均购于国药集团化学试剂有限公司。
主要实验设备:高温高压灭菌锅,SANYO;厌氧工作站,Electrotek;大容量冷冻离心机,Thermo;冷冻干燥机,Virtis;多功能酶标仪,Thermo;全自动脱水机,Leica;半自动切片机,Leica;全自动染色机,Leica;KD-160型电子秤,东莞百利达健康器材有限公司;精密电子天平EL3002,Mettler Toledo;电子分析天平BSA124S,Sartorius;CELLtac α型血球分析仪,NIHON KOHDEN;光学显微镜,OLYMPUS;正置生物显微镜,OLYMPUS;体视显微镜,OLYMPUS;游标卡尺,成都成量工具集团有限公司。
1.2 实验菌株
实验用菌株均来自于食品生物技术中心菌种保藏中心(Culture Collection of Food Microorganisms, CCFM)。青春双歧杆菌Z25(CCFM8630)分离自湖北省钟祥市95岁健康男性粪便,罗伊氏乳杆菌138-1(CCFM8631)分离自广西省巴马县57岁健康女性粪便。
1.3 实验动物及适应性喂养
实验中所使用动物为清洁级SD大鼠(雌雄各半),体重180~220 g,购自浙江省实验动物中心,生产许可证号:SCXK(浙)2014-0001。将大鼠适应性喂养7 d,环境温度为22±2 ℃,湿度为(55±5)%,光照为12 h光暗交替。适应性喂养结束后,根据急性毒性实验、28 d喂养实验和致畸实验的需要进行随机分组。除致畸实验外,实验期间大鼠饲喂基础饲料,自由饮水,同室分笼饲养。
1.4 实验方法
1.4.1 受试菌悬液的制备
将菌株接种于含0.5 g/LL-半胱氨酸盐酸盐的MRS培养基中,置于厌氧工作站37 ℃活化两代后用于制备动物实验所需冻干粉。将培养好的菌液以8 000×g离心20 min,无菌PBS缓冲液清洗菌体2遍,用100 g/L的脱脂乳、30 g/L海藻糖和30 g/L的蔗糖作为冻干保护剂重悬菌体,冷冻干燥制成菌粉,并对其进行平板菌落计数。参照文献报道[14],用无菌生理盐水将菌粉调整为2×108(低剂量)、2×109(中剂量)、2×1010CFU/mL(高剂量),制备成3种剂量不同的菌悬液,用于后续动物实验。
1.4.2 急性毒性实验
按照GB 15193.3—2014《食品安全国家标准急性经口毒性试验》[11]和《保健食品检验与评价技术规范2003版》[10]要求进行实验。适应性喂养结束后,随机选取雌雄大鼠分为3组,每组雌雄各10只,分别为对照组、青春双歧杆菌Z25高剂量组(BA-H)和罗伊氏乳杆菌138-1高剂量组(LR-H)。其中对照组大鼠灌喂灭菌冻干保护剂稀释液,实验组大鼠灌喂益生菌稀释液。每天定时经口灌胃1次,剂量为2 mL/只,连续灌胃7 d。给予受试菌悬液后,观察并记录大鼠的行为、死亡情况和中毒表现等。在实验开始和结束时,用KD-160型电子秤称取并记录动物体重,实验结束处死大鼠,进行解剖检查,记录心、肝、脾、肺、肾变化并用精密电子天平EL3002称重,计算脏器指数,出现病变时应做病理组织学检测。
1.4.3 28天喂养实验
按照GB 15193.22—2014《食品安全国家标准28天经口毒性试验》[12]和《保健食品检验与评价技术规范2003版》[10]要求进行实验。适应性喂养结束后,随机选取雌雄大鼠分为7组,每组雌雄各10只,分别为对照组、青春双歧杆菌Z25低剂量组(BA-L)、青春双歧杆菌Z25中剂量组(BA-M)、青春双歧杆菌Z25高剂量组(BA-H)和罗伊氏乳杆菌138-1低剂量组(LR-L)、罗伊氏乳杆菌138-1中剂量组(LR-M)、罗伊氏乳杆菌138-1高剂量组(LR-H)。其中对照组大鼠灌喂灭菌冻干保护剂稀释液,实验组大鼠灌喂不同剂量的益生菌稀释液。每天定时经口灌胃1次,剂量为2 mL/只,连续灌胃28 d。给予受试菌悬液后,观察并记录大鼠的行为表现、死亡情况和中毒体征等。在实验期间,用KD-160型电子秤称取并记录体重和摄食量,计算食物利用率;实验结束时,计算动物体重增长量、总摄食量和总食物利用率。
实验结束处死大鼠,进行红细胞计数、白细胞计数及分类、血红蛋白浓度、血小板计数等血液学指标测定;进行血生化检查,测定指标包括总胆固醇(TC)、甘油三酯(TG)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、血糖(GLU)、尿素氮(BUN)、肌酐(Cr)、血蛋白(ALB)、总蛋白(TP);先对高剂量组和对照组大鼠进行脏器组织病理学检查,发现病变后再对较低剂量组相应器官及组织进行检查,检测脏器包括心、肝、脾、肺、肾、胃、十二指肠、回肠、结肠。
1.4.4 致畸实验
按照GB 15193.14—2015《食品安全国家标准致畸试验》[13]和《保健食品检验与评价技术规范2003版》[10]要求进行实验。选取健康、性成熟清洁级SD大鼠,1∶1合笼交配,饲料为大鼠营养繁殖饲料,自由饮水。每日对雌鼠检查阴栓,查出阴栓当日作为受孕0 d,用KD-160型电子秤称量体重。孕鼠分笼饲养,随机分为7组,每组12只。实验组设置同1.4.3,在孕期第7~16天,每天定时经口灌胃1次,根据母体体重调整灌胃体积;在母鼠受孕的第0,7,12,16,20天用KD-160型电子秤称体重。
于大鼠孕第20天麻醉放血处死孕鼠,迅速取出子宫,逐个检查胎鼠有无外观异常,用KD-160型电子秤称量怀孕子宫重、子宫胎盘重和胎盘重,用精密电子天平EL3002称取卵巢和子宫的重量。将一半胎鼠放入Bouin氏液中固定,检查内脏。另一半胎鼠去皮、去内脏及脂肪后,放入0.01%茜素红液染色,并经透明液脱色后检查骨骼发育情况。
1.4.5 细菌易位实验
将经28 d喂养实验的大鼠处死后,无菌环境下解剖,用无菌手术刀取心、肝、脾、肺、肾等脏器并切开,用一次性无菌棉签擦拭各脏器切面,涂布于含0.5 g/L半胱氨酸的MRS固体培养基上,37 ℃倒置厌氧培养24~48 h,观察有无特征菌落生长[15]。
1.5 数据处理
使用Graphpad Prism5进行绘图,使用SPSS 22.0对实验数据进行差异显著性分析。相同字母标注代表无显著性差异,p<0.05则认为差异显著。与雌性对照组之间有显著差异:p<0.05标注*,p<0.01标注**,p<0.001标注***;与雄性对照组之间有显著差异:p<0.05标注#,p<0.01标注##,p<0.001标注### 。
2 结果与分析
2.1 急性毒性实验
2.1.1 急性毒性试验对大鼠体重的影响
不同菌株灌胃大鼠,实验期间各组大鼠生长、行为和精神状态良好,未见中毒症状或死亡现象。图1所示为各实验组大鼠的体重增量(图1-A)及进食量(图1-B),灌喂益生菌组体重增幅较对照组均有较明显的降低,且表现出较明显的性别差异,BA对雌性体重增幅影响较雄性略明显;同时,与对照组相比,灌胃益生菌降低了大鼠的进食量。

图1 益生菌对急性毒性大鼠体重增量及进食量的影响Fig.1 Weight gain and food intakeof acute toxicity test
2.1.2 急性毒性实验对大鼠脏器指标的影响
7 d实验结束后,对大鼠进行解剖,观察脏器并称重。观察结果表明,大鼠心脏、肝脏、脾脏、肺及肾脏均无可见病变。各组大鼠的脏器指数如表1所示,灌胃不同益生菌的试验组大鼠与对照组相比,均无显著性差异。

表1 急性毒性实验脏器指数Table 1 Organ index of acute toxicity test
2.2 28 d喂养毒性试验
2.2.1 不同菌株对大鼠体重及食物利用率的影响
用不同剂量的益生菌灌胃大鼠28 d,大鼠生长、行为和精神状态良好,未见中毒症状或死亡现象。图2所示为各实验组大鼠的体重增量(图2-A)及食物利用率(图2-B),结果表明各组大鼠体重增量与食物利用率均表现出性别差异,灌喂不同剂量益生菌组的雌性大鼠体重增幅较对照组均有降低,与食物利用率的结果相一致;灌胃青春双歧杆菌Z25对体重增量和食物利用率的影响大于罗伊氏乳杆菌138-1,提示该2株菌具有潜在的减肥功能。
2.2.2 大鼠脏器指标的影响

图2 益生菌对28 d喂养大鼠体重增量及食物利用率的影响Fig.2 Weight gain and food utilization rate of 28 day feeding toxicity test
实验结束后,对大鼠进行解剖,观察脏器并称重。结果表明,大鼠肝脏、脾脏及肾脏均无可见病变。各组大鼠的脏器指数均无显著性差异。
2.2.3 不同菌株对大鼠血液生化指标的影响
不同剂量的益生菌灌胃28 d后,对各组大鼠血液的血脂指标(TC、TG)、肝功能指标(ALT、AST)、葡萄糖(GLU)及蛋白指标(ALB、TP)、肾功能指标(BUN、Cr)等进行测定,结果如图3所示。灌胃益生菌28 d后,与对照组相比,雌性BA-L、LR-M及雄性BA-L组TC含量有所提高;雌性BA-M、LR-L、LR-M及雄性BA-L组TG含量有所升高;雄性BA-L和LR-L组ALT含量有所增加,雄性LR-M和LR-H组AST含量有所下降,雌性大鼠的ALT和AST指标与对照组均无显著差别。
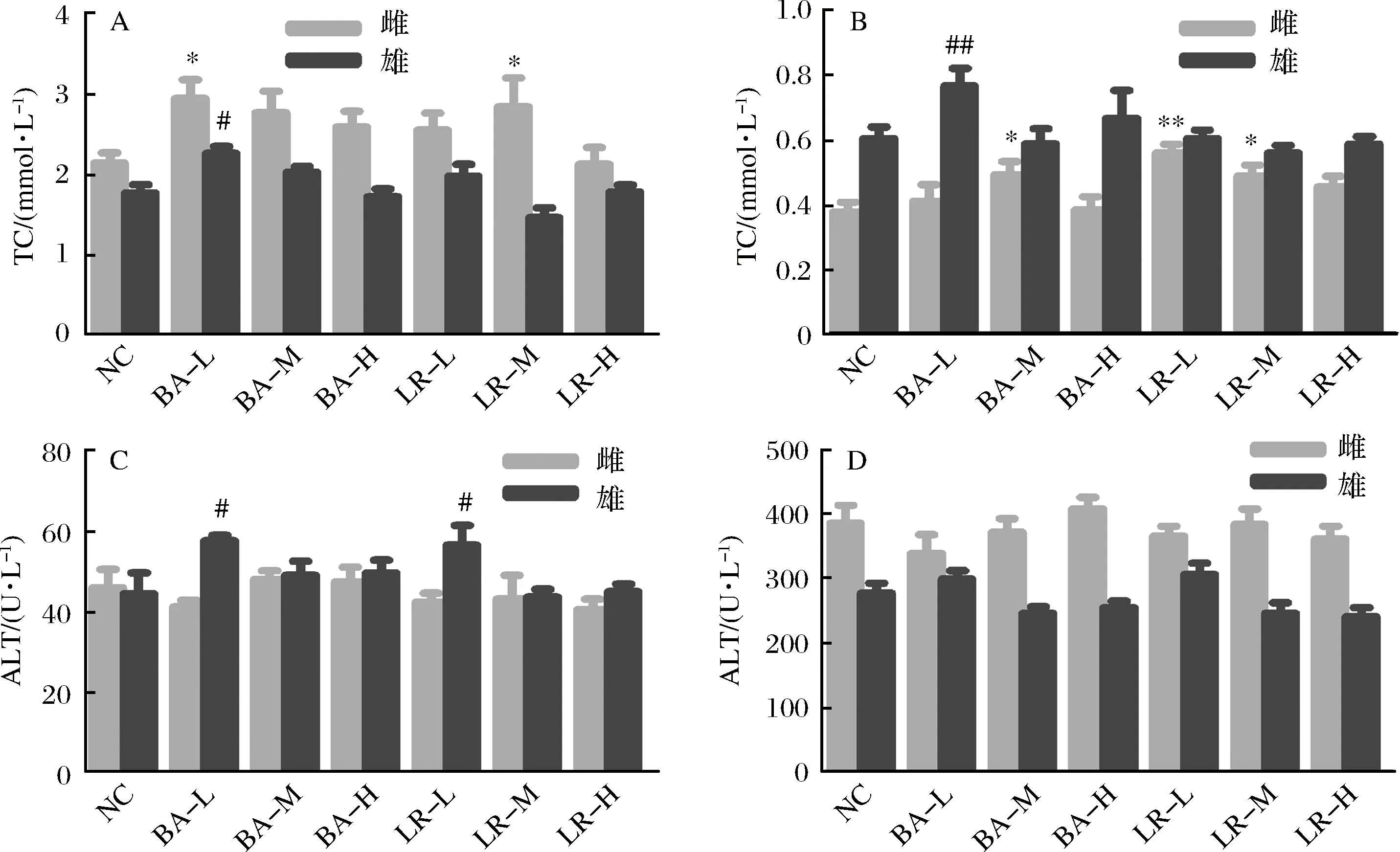
图3 益生菌对28 d喂养大鼠血脂及肝功能指标的影响Fig.3 Blood lipid and liver function index of 28 day feeding toxicity test
如图4所示,灌胃不同浓度的益生菌,血液中的葡萄糖含量也呈现部分的升高,与对照组相比,雄性BA-M、BA-H和LR-M组GLU含量少量升高,而雌性大鼠组别中GLU升高的为BA-L和LR-H组。
2.2.4 不同菌株对大鼠血液学检查的影响
灌胃不同浓度的益生菌28 d后,对各组大鼠进行血液学检查,各实验组红细胞计数、白细胞计数及分类、血红蛋白浓度、血小板计数等指标均无显著差异。
2.2.5 不同菌株对大鼠组织病变的影响
对灌胃28 d高剂量益生菌大鼠的心脏、肝脏、脾脏、肺脏、肾脏、睾丸、卵巢、胃、十二指肠、回肠、结肠和胰腺等器官固定后,经脱水、石蜡包埋、切片和H&E染色,光镜观察组织病理学改变(图5~图6)。
镜检结果显示:各实验组雄性及雌性大鼠中,部分肺组织样本均出现不同程度的支气管性肺炎,与对照组相比,未见明显加重,提示非益生菌相关性病变;且因实验动物为清洁级SD大鼠,出现一定比例的支气管性肺炎属正常现象,发病的试验大鼠也并未表现出明显异常。各实验组雄性及雌性大鼠肺脏组织偶见出血,发生率较低,且与对照相比,未见明显加重或发生率升高,提示非益生菌相关性病变。各实验组雌雄大鼠,除肺脏之外的其他组织,均未见明显的组织病变。
2.3 致畸实验
2.3.1 不同乳酸菌灌胃对孕鼠生殖功能的影响
不同剂量的益生菌灌胃孕鼠,对其生殖功能及胚胎形成的影响如表2所示。与NC组相比,益生菌组终末期体重(GD20)均有不同程度的下降,其中LR组有显著差异;灌胃益生菌组的孕鼠子宫胎盘重、子宫重及子宫脏体系数均高于NC组;而怀孕子宫重、卵巢重、卵巢脏体系数、黄体数等指标,各实验组孕鼠均未见统计学差异。
2.3.2 不同乳酸菌灌胃对胎仔外观的影响
不同剂量的益生菌灌胃孕鼠,比较各组胎仔总数、总重、均重、身长、尾长、雌雄比及外观畸形率等指标,未见明显差异,各组胎仔外观畸变率均为0。
2.3.3 不同乳酸菌灌胃对胎仔内脏的影响
不同剂量的益生菌灌胃孕鼠,对各实验组胎仔窝别内脏变异率及畸形率进行检查。结果显示,各组胎仔窝别内脏变异率均为0,NC组胎仔窝别内脏畸形率为(1.39±4.81)%,畸变类型为肾异位;其余各组未见明显异常改变。

表2 对孕鼠生殖功能及胚胎形成的影响Table 2 Effects on reproductive function and embryo formation in pregnant rats
注:脏体系数/%=脏器质量/动物体质量×100。
2.3.4 不同乳酸菌灌胃对胎仔骨骼的影响
结果显示,各组胎仔窝别骨骼畸形率从NC组至LR-H组依次为3.47%、6.88%、6.35%、5.83%、7.74%、7.94%和9.29%,与NC组相比,灌胃益生菌组畸变率略有升高,但仍处于较低的比率范围,同时无显著性差异,且部分升高并无明显的剂量效应;畸变类型主要为间顶骨、胸骨、肋骨、腰椎、骶椎缺失、胸骨分离和胸骨分叉,其中间顶骨、胸骨、腰椎、骶椎缺失可能与孕鼠孕期未到有关。
2.4 细菌易位实验
对灌胃益生菌28 d的大鼠脏器无菌切开,取其切面涂布于含0.05%半胱氨酸的MRS固体培养基上,37 ℃倒置厌氧培养24~48 h后,均无特征性菌落生长,该结果表明2株菌在宿主体内未发生细菌易位现象。
3 讨论
作为肠道共生微生物,乳杆菌和双歧杆菌因其在食品和膳食补充剂中较长的使用历史被认为是无致病性、安全可食用的。然而,从理论上讲益生菌可能存在以下副作用:进入血液引发系统性感染;产生有害的代谢产物;对敏感人群的过度免疫刺激;耐药基因的转移[9]。近年来,越来越多的新的益生菌菌种(如罗伊氏乳杆菌、鼠李糖乳杆菌)被开发使用,鉴于其使用历史不长,因此其安全性还需进一步评价[16]。
本研究按照相关文件进行了毒理学评价,与李金敏[14]等的报道一致,益生菌灌胃不会对大鼠的脏器和行为造成影响。灌喂不同剂量的益生菌组体重增幅较对照组均有降低,且表现出明显的性别差异,青春双歧杆菌Z25对雌性体重增幅影响较雄性略明显;同时,检测到灌胃益生菌可降低大鼠的进食量及食物利用率。以上结果表明,青春双歧杆菌Z25和罗伊氏乳杆菌138-1可以通过降低大鼠的食欲,从而进一步影响其体重,提示该2株菌具有潜在的减肥功能[17-18]。
血液成分或细胞发生异常,可以反映全身血液系统、组织器官的病变,因此动物血液学检查在毒理学研究中十分重要。有研究表明,菌血症的发生与乳杆菌(主要是鼠李糖乳杆菌)有关,免疫功能低下的病人更容易感染[19]。本研究结果表明,血液中蛋白指标、肝功能指标、肾功能指标均在正常范围内,证实该实验用益生菌不会对肝肾造成损伤。益生菌灌胃对雄性血脂指标(TC、TG)无明显影响,中剂量的罗伊氏乳杆菌138-1会导致雌性大鼠TC和TG含量略微升高,但仍处于报道的正常范围内[20],而针对这2株菌的前期研究表明,这2株菌对由高糖高脂饲料导致的大鼠代谢综合征具有显著的缓解作用。已有多个研究表明,补充益生菌能缓解高脂饮食引发的血糖升高[21-23],而益生菌对正常饮食大鼠血糖的影响鲜有报道。从本研究结果来看,针对正常饮食的健康大鼠,这2株益生菌虽然对血糖血脂有一定的影响,但血糖血脂的变化都在正常范围内,且并没有明显的剂量效应,提示该变化可能与大鼠血糖血脂水平的正常浮动有关。
致畸实验结果表明益生菌各剂量组对胎仔发育、外观及内脏畸形均无明显影响,提示2株益生菌无致畸作用。细菌易位是指位于肠道中的细菌或内毒素穿过肠上皮屏障,经粘膜固有层进入肠系膜淋巴结,经人体循环至肝、肾、脾等无菌的组织器官的过程[24]。与宋静颐[25]等人的研究一致,本实验结果表明,不同剂量的益生菌灌胃大鼠,均未在肝、肾、脾等部位检测到特征菌落,证实2株实验菌株在大鼠体内不会发生细菌易位。相反,王坚锵[26]等通过给腹腔感染的大鼠补充嗜酸乳杆菌,发现益生菌补充能明显降低大鼠血、肺脏、肝脏和肠系膜淋巴结等组织的细菌易位;李京京[27]等通过建立大鼠缺血再灌注模型,证实了植物乳杆菌L2能够抑制肠道损伤导致的细菌易位。
综合上述实验结果,可初步证实青春双歧杆菌Z25和罗伊氏乳杆菌138-1对于大鼠安全,可以应用于产品研发和工业生产。
4 结论
通过对青春双歧杆菌Z25和罗伊氏乳杆菌138-1进行系统的安全性评价,急性毒性实验和28 d毒理实验结果表明,灌胃不同剂量的益生菌,实验期间大鼠除体重增长幅度略有下降以外,日常表现及体征一切正常,均未表现出明显的组织病变和中毒现象;致畸实验表明,益生菌实验组大鼠体重略有下降,对孕鼠生殖功能、胎仔外观及内脏均无明显影响;血液学指标均在正常范围内;2株菌株均未发生细菌易位现象。综上所述,青春双歧杆菌Z25和罗伊氏乳杆菌138-1对大鼠安全,且相对于人体重,安全性评价中大鼠益生菌的摄入比例远高于产品推荐的消费者日常益生菌摄入比例,因此该2株菌可用于后续产品开发及实际生产。
