Apelin改善RUPP大鼠模型的妊娠结局*
2018-08-27王成书刘晓莉李艳青黄向华常瑞晶
王成书, 刘晓莉, 李艳青, 黄向华△, 常瑞晶
(1河北医科大学第二医院妇产科,河北 石家庄 050000;2河北省中医院妇产科, 河北 石家庄 050011)
近年来,妊娠期高血压疾病已成为孕产妇与围产儿发病率及近远期死亡率增高的主要原因,至今尚未发现安全有效的预防和治疗子痫前期(preeclampsia,PE)的药物。RUPP(reduced uterine perfusion pressure)大鼠模型在模拟子痫前期的高血压、氧化应激及胎儿生长受限方面最贴近[1-2],在其它物种也能成功地被复制。该模型已被用作药物干预治疗子痫前期的研究,如枸橼酸西地那非、血红素加氧酶和普伐他汀等[3-5]。Apelin (APLN)是近年发现的一种具有多种生物学功能的血管活性肽,参与调节心血管系统稳态、扩张血管、调节水盐代谢及介导免疫调节等多种生物学效应[6-8]。Apelin存在多种亚型,其中短肽比长肽活性更强,在心血管系统中以apelin-13和apelin-36活性最强[9]。目前国内外尚未见apelin在RUPP大鼠模型中的研究报道。
材 料 和 方 法
1 实验动物及主要试剂
清洁级SD大鼠(体重180~200 g)购自河北省实验动物中心。大鼠饲养环境为室温18~28 ℃,12 h/12 h昼夜循环,不控制水和食物。夜间将雌雄鼠按(3~4)∶1同笼喂养,每日晨取鼠阴道分泌物涂片,光学显微镜下检测到精子当天定义为大鼠孕0天。
异氟烷购于上海雅培公司;apelin-13购于Cayman;大鼠可溶性fms样酪氨酸激酶1(soluble fms-like tyrosine kinase-1,sFlt-1)ELISA试剂盒购于上海西唐生物科技有限公司;大鼠血管内皮生长因子A(vascular endothelial growth factor-A,VEGF-A)定量酶联检测试剂盒购于上海森雄科技实业有限公司;丙二醛(malondialdehyde,MDA)和总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒购于南京建成生物工程研究所。
2 方法
2.1动物模型的建立 参考Granger等[10]的描述建立RUPP大鼠模型。银质血管收缩夹的制作:在银夹的V型区,放入一个直径0.203 mm/0.1 mm的针灸针,打开银夹钳,将银夹对准置于银夹钳头部的槽内,夹持并闭合银夹,然后抽取出针灸针,这就在银夹的V型区制造出直径0.203 mm/0.10 mm的银质血管收缩夹,分别作为腹主动脉和子宫血管卵巢支的血管夹。RUPP手术方法:孕鼠14 d(体重200~250 g)用1.5%~2%异氟烷麻醉,碘伏消毒后开腹,距髂总动脉分叉处上方0.5~1 cm游离腹主动脉约1 cm,将分离出的腹主动脉(距离髂总分叉处至少0.5 cm)滑入银夹直径0.203 mm区域,暴露并分离两侧子宫血管卵巢支,分别滑入银夹直径0.1 mm的区域,关腹后置孕鼠侧卧位,予保暖直至清醒。
2.2动物分组和实验流程 将14 d 孕鼠(体重200~250 g)随机分为4组,分别为正常孕鼠(normal pregnant,N)组(分离腹主动脉后将银夹放在腹部脂肪中,n=6)、RUPP孕鼠(PE)组(行腹主动脉及双侧子宫动脉缩窄术,n=7)、APLN组(同N组,n=7)和PE+APLN组(同PE组,n=8)。记录孕14 d 孕鼠胚胎数目;从孕14 d 起,给APLN组及PE+APLN组皮下注射apelin-13,剂量100 μg/kg,每天2次,共5 d,PE组及N组连续5 d皮下注射相当剂量的生理盐水;孕18 d 收集24 h 尿量;孕19 d 用2%异氟烷麻醉后行颈总动脉血压测量及心脏功能检测,再行剖宫产术、腹主动脉采血及胎盘组织标本采集。
2.3尿液收集方法 大鼠孕18 d 将其放于标准代谢笼中,24 h 后收集孕鼠尿液量,将尿液2 000 r/min离心10 min,取出上清液,置于-40 ℃冰箱保存待检。测定尿液中尿蛋白的浓度,根据尿量及尿蛋白的浓度计算出24 h 尿蛋白总量。
2.4颈总动脉血压测量及心脏功能检测 2%异氟烷麻醉大鼠后,将其仰卧位捆绑固定于实验操作台上,1.5%~2%异氟烷维持,颈部备皮、碘伏消毒,切开颈部皮肤,暴露右颈总动脉,先游离出右颈总动脉约1~1.5 cm,远心端结扎,近心端用动脉夹夹闭。将镊子柄部放在夹闭的远心端与近心端之间的颈总动脉下方,固定颈总动脉,在临近远心端结扎处的动脉壁上用眼科小剪刀以30°倾斜角度朝向近心端剪斜口,注意不要剪断。用平镊轻柔夹起已经剪开的颈总动脉斜口上缘,将充满0.3%肝素生理盐水的颈动脉插管(内径0.8 mm)向近心端插入约1 cm,用丝线穿线结扎近心端动脉血管和导管,连接压力换能器和多道生理信号采集处理系统(将数据输入到计算机);松开动脉夹将导管再送入约1 cm左右,即可看到动脉的血压波形;待孕鼠安静稳定5 min左右后,记录颈动脉收缩压(systolic arterial pressure,SAP)和舒张压(diastolic arterial pressure,DAP),据此可换算出平均动脉压(mean arterial pressure,MAP);然后慢慢插管至左心室,当出现左室波形后停止推进插管,稳定约20 min后记录描记的心率(heart rate,HR)、左心室收缩末期压(left ventricular end-systolic pressure,LVESP)、左心室舒张末期压(left ventricular end-diastolic pressure,LVEDP)及左心室压力最大上升和最大下降速率(±dp/dtmax)。
2.5ELISA法检测孕鼠血清VEGF-A和sFlt-1的水平 用抗大鼠VEGF-A和sFlt-1单抗包被于酶标板上,标准品和样品中的大鼠VEGF-A和sFlt-1分别与单抗结合,加入生物素化的抗大鼠VEGF-A和sFlt-1抗体,形成免疫复合物连接在板上,辣根过氧化物酶标记的streptavidin与生物素结合,加入酶底物工作液TMB,出现蓝色,加终止液硫酸,颜色变黄,在450 nm处测吸光度(A)值,大鼠VEGF-A和sFlt-1浓度与A值成正比,可通过绘制标准曲线求出标本中大鼠VEGF-A和sFlt-1水平。
2.6化学法测定孕鼠血清MDA和T-AOC的水平 MDA可与硫代巴比妥酸生成有色化合物,在530 nm处有最大吸收,测定其吸光度;T-AOC能使Fe3+还原成Fe2+,后者可与菲啉类物质形成稳固的络合物,通过比色可测出其抗氧化能力的高低。
3 统计学处理
应用SAS 9.1统计分析软件分析数据,均行正态性及方差齐性检验,结果以均数±标准差(mean±SD)表示,单因素方差分析和Student-Newman-Keuls法进行多组间比较,以P<0.05为差异有统计学意义。
结 果
1 血流动力学的变化
由表1可见,PE组的颈动脉收缩压、舒张压及平均动脉压比N组升高(P<0.05),LVESP和LV+dp/dtmax较N组均降低(P<0.05),而LVEDP较N组明显增高(P<0.05)。
PE+APLN组的收缩压、舒张压及平均动脉压与PE组比较均降低(P<0.05),LVESP和LV +dp/dtmax均比PE组高,而LVEDP明显降低(P<0.05);APLN组上述参数与N组比较差异均无统计学显著性,见表1。
2 尿蛋白定量
由表1可见,PE组24 h 尿蛋白定量比N组明显升高(P<0.05),但N组尿蛋白并没有呈阴性,这与人类不同;PE+APLN组24 h尿蛋白比PE组低(P<0.05);APLN组与N组相比差异无统计学显著性。
3 妊娠结局
3.1胚胎 PE组的胚胎存活率与N组比较明显减低,而PE+APLN组比PE组高 (P<0.05);PE组存活胚胎平均体重比N组减低,而PE+APLN组比PE组增加(P<0.05),见表1。
3.2胎盘 PE组胎盘重量比N组减低, PE+APLN组比PE组增加(P<0.05),见表1。

表1 妊娠大鼠及其胚胎的生物学参数的比较
*P<0.05vsN group;#P<0.05vsPE group.
胎盘形态学变化:HE染色光学显微镜示,与N组比较,PE组的绒毛水肿、细胞排列较乱、细胞核大小不一、深染; PE+APLN组胎盘绒毛的水肿减轻,细胞排列较齐整,深染区减少。电镜下观察,PE组内质网扩张、线粒体嵴和膜融合消失、可见糖原;PE+APLN组内质网扩张、部分线粒体嵴和膜融合消失、富含糖原,见图1。
4 血清VEGF-A、sFlt-1、T-AOC及MDA水平的比较
由表2可见,PE组血清VEGF-A水平比N组减低,而PE+APLN组比PE组和N组均减低(P<0.05);PE组血清sFlt-1水平比N组增高,而PE+APLN组与PE组相比差异无统计学显著性;PE组血清的T-AOC水平比N组降低,而PE+APLN组血清的T-AOC水平比PE组增加(P<0.05);PE组血清的MDA水平比N组升高,而PE+APLN组比PE组降低(P<0.05)。
讨 论
研究发现子痫前期患者胎盘apelin含量减少[11-12],且正常妊娠和子痫前期患者胎盘组织apelin亚型主要为apelin-13[3]。Apelin在胎盘组织中的存在,提示它已参与到调节胎盘转运营养物质、胚胎发育以及胎儿生长控制。有研究表明apelin控制胎儿和新生儿葡萄糖稳态、改变了孕产妇营养不良引起的胎儿生长受限[13]。同时,apelin还具有稳定血流动力学、舒张血管和促进血管新生等方面的作用。因此,在大鼠子痫前期模型注射apelin-13治疗是可行的。至今的研究尚未发现apelin对胎儿具有不良影响。
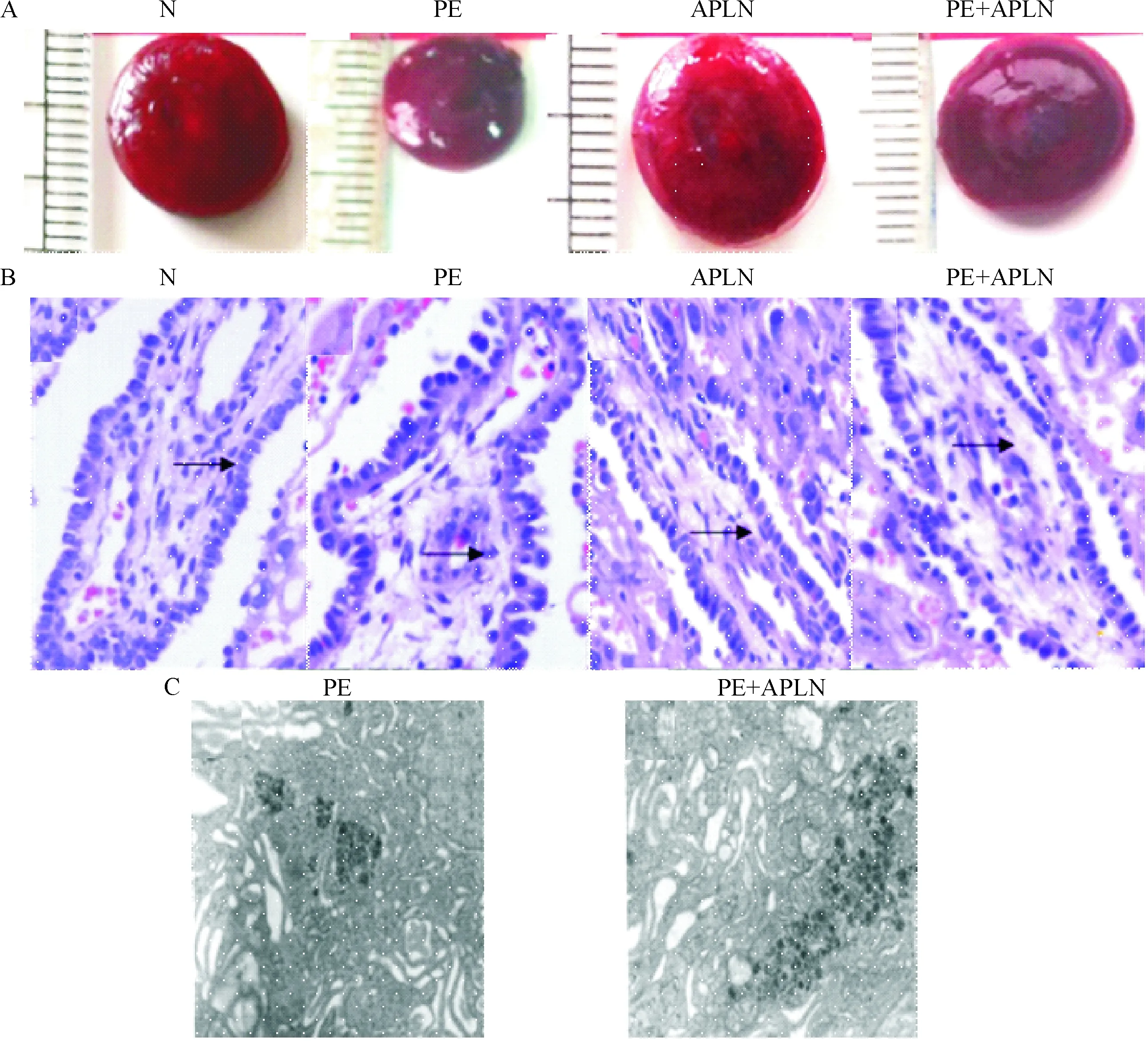
Figure 1. The effect of apelin on morphological structure of placenta. A: the placenta appearance; B: HE staining in placenta tissue with trophoblast cells in labyrinth layer (×400); C: electron microscopic images of glycogen in trophoblast cells of placenta tissue (×20 000).
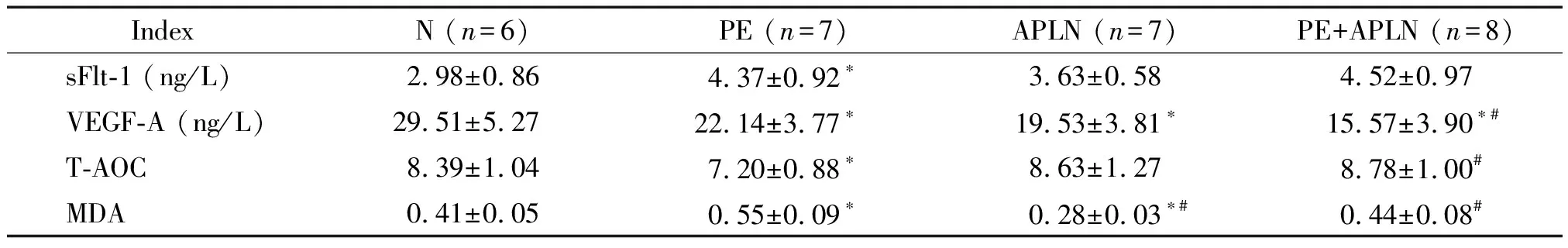
表2 妊娠大鼠血清学标志物的变化
*P<0.05vsN group;#P<0.05vsPE group.
在本实验中,我们也成功地应用RUPP大鼠模型模拟了子痫前期的主要临床表现,胎盘形态学也表现出缺血缺氧。有趣的是,该动物模型受apelin-13干预后,其临床表现、妊娠结局及胎盘形态学均不同程度地有所改善,但其具体作用机制尚不清楚。在动物心梗心衰模型和肺动脉高压模型的研究中,也证实了apelin能改善心功能和扩张血管的作用[14-15]。
在血管内皮生长因子的几种类型中,VEGF-A具有高度的内皮细胞特异性,在血管的发生和形成过程中起着主要的调控作用;而sFlt-1是一种选择性剪接和截短的血管内皮生长因子受体,游离于血清, 与VEGF-A结合则减少促血管生成因子与其结合,最终导会致血管内皮功能紊乱。本研究结果中PE+APLN组血清sFlt-1与PE组相比差异不显著,但VEGF-A水平明显下降,这种现象或许是受到apelin这一血管活性物质的抑制。曾有研究显示apelin能抑制VEGF介导的血管内皮钙黏蛋白的下调[16]。胎盘的生长发育必然涉及到血管的逐渐形成,apelin的促血管生成作用或许促进了PE+APLN组胎盘的生长发育,从而改善其妊娠结局。
研究表明氧化应激在子痫前期发生发展过程中起了重要作用,母血的氧化应激状态可预测子痫前期的发展[17]。在本实验中,apelin-13使PE+APLN组的抗氧化能力得到不同程度恢复。Apelin在心脏疾病的动物模型中同样起着防御氧化应激的作用。尽管许多研究表明在子痫前期患者出现临床表现之前,其体内氧化应激水平已经升高,但是后来的研究数据并不支持单纯应用抗氧化剂(比如维生素E和维生素C)能有效预防子痫前期的发生[18]。Apelin虽然减轻了PE+APLN组的氧化应激水平,但这种现象应该不是改善子痫前期临床表现的最终机制。
总之,本实验为预防和治疗子痫前期提供了可靠的实验依据及临床治疗探索路线,但其具体机制有待进一步探讨。
