非马沙坦对2型糖尿病大鼠早期心肌S-腺苷同型半胱氨酸水解酶的调节作用
2018-08-27韩冬梅刘方波万相全
韩冬梅, 刘方波, 万相全
(青岛市第八人民医院药学部, 山东 青岛 266100)
目前,糖尿病心肌病(diabetic cardiomyopathy,DCM)已经被证实为糖尿病(diabetes mellitus,DM)独立的并发症。近年来,糖尿病心肌病的发病机理主要集中在血糖和血脂的代谢异常,而氨基酸和蛋白质的有关研究资料相对匮乏[1]。S-腺苷同型半胱氨酸水解酶(S-adenosyl-L-homocysteine hydrolase,SAHH)是一种细胞内广泛存在的酶,它可催化水解S-腺苷同型半胱氨酸(S-adenosyl-L-homocysteine,SAH)生成腺苷和同型半胱氨酸(homocysteine,Hcy),其中SAH是由S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)提供甲基参与机体DNA和组蛋白的甲基化而产生[2]。SAH作为代谢前体在SAHH的催化下生成同型半胱氨酸,而抑制SAHH将导致细胞内SAH的蓄积,从而对转甲基反应产生反馈性抑制作用,并产生显著的免疫抑制作用。近年来,对于SAHH的研究越来越多,而主要集中在SAHH的体外抑制剂研究上[3-4],对于SAHH的内源性抑制方面鲜有研究。Hcy是一种含硫氨基酸,为甲硫氨酸去甲基化中间产物。1969年有学者发现并提出Hcy与动脉硬化密切相关,之后与糖尿病和心血管疾病的关系日益受到重视;之后,人们发现血浆Hcy的升高同心血管病变是紧密联系在一起的,因此糖尿病和心血管疾病之间的关系日益受到重视。随着研究的深入,Tehlivets等[5]发现Hcy与甲硫氨酸另一中间代谢产物SAH共同参与了心血管疾病的发生发展过程。Jacobs等[6]研究显示,随着糖尿病患者体内胰岛素水平的变化,Hcy的水平可以升高、降低及正常,这直接与糖尿病病情发展密切相关。Hcy不仅与糖尿病相关,还可能参与糖尿病肾病、糖尿病视网膜病等慢性并发症的发生。Cho等[7]对大样本的2型糖尿病患者进行为期2~6年的流行病学研究显示,患者血浆Hcy浓度与患者肾功能有密切的相关性,提示Hcy可能促进糖尿病肾病的发生。而近年研究[8]表明,SAH水平的升高导致心肌细胞内外等离子交换失调,参与多种慢性心血管疾病的发生;而更有研究[9]指出SAH与Hcy可以共同作为慢性心血管病的标志物。
非马沙坦(fimasartan,FIM)是一种新型的非肽类血管紧张素II 1型受体(angiotensin II type 1 receptor,AT1-R)拮抗剂,具有选择性阻滞AT1-R的作用,在多种类型高血压的治疗中表现出快速和有效的抗压效果。新近临床前研究[10]表明,与非马沙坦同类的奥美沙坦酯在糖尿病状态下,对心肌具有显著的保护作用。另有研究显示,血管紧张素II受体拮抗剂类对心肌的保护作用与Hcy表达水平的调控可能具有相关性[11],但具体作用机制仍不清楚。因此,我们建立2型糖尿病大鼠模型,选取造模后动物给予非马沙坦进行干预作用,探究非马沙坦对SAHH及下游Hcy等因子表达调控的可能作用机制。
材 料 和 方 法
1 实验动物和试剂
健康雄性Sprague-Dawley(SD)大鼠,SPF级,体重180~200 g,由山东省医学科学院动物中心提供,合格证号为SCXK(鲁)2017-0014。
非马沙坦(山东省医学科学院药物所提供,分析纯:含量>99%);医用超声耦合剂(上海申风医疗保健有限公司);生物素标记山羊抗兔IgG/小鼠IgG的II抗试剂盒(北京中杉金桥生物);ProSieve Color Protein Makers(Lonza Rockland);链脲佐菌素、同型半胱氨酸、多聚-L-赖氨酸和L-谷氨酰胺(Sigma);抗SAHH、AT1-R和β-actin单克隆抗体(Cell Signaling Technology)。
2 实验方法
2.1动物模型的构建及分组 SPF级健康雄性SD大鼠35只,适应性喂养1周后,随机分为正常对照(control)组10只和糖尿病模型(DM)组25只:control组饲以普通饮食;DM组采用高脂饮食(猪油30%,胆固醇2.5%,脱氧胆酸钠1%,常规饲料66.5%)灌胃,并于5周末禁食12 h后,一次性腹腔注射1%链脲佐菌素(30 mg/kg,溶于pH 4.5的柠檬酸-柠檬酸三钠缓冲液中)。Control组正常大鼠注射同体积柠檬酸-柠檬酸三钠缓冲液。造模后72 h尾静脉采血,血糖试纸检测空腹血糖(fasting blood glucose,FBG),选择FBG≥11.1 mmol/L及尿量、饮食和体重变化综合判断糖尿病大鼠模型是否成功。造模成功大鼠随机分为DM组和DM+FIM组:DM组以高脂饮食灌胃4周;DM+FIM组于2周末灌胃给予非马沙坦,按照2.5 mg·kg-1·d-1剂量给药,持续到4周末。Control组始终以普通饲料喂养8周。
2.2空腹血糖及胰岛素的检测 DM组和DM+FIM组大鼠分别于4周末禁食12 h,颈静脉窦取血,离心分离血清,检测FBG及空腹胰岛素(fasting insulin,FINS)水平,计算胰岛素敏感指数(insulin sensitivity index,ISI),ISI=ln[1/(FINS×FBG)]。
2.3血清学检测 造模大鼠于4周末麻醉,仰位固定,开胸,腹主动脉取血,每只5 mL,3 000 r/min 离心10 min,取上清,分装,-20 ℃保存待测。生化仪检测总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平。
2.4超声心动图检测动物的心功能 造模大鼠于4 周末禁食12 h后,以30 mg/kg戊巴比妥钠麻醉大鼠并固定,使用Vevo 2100小动物超声成像系统[维胜(中国)有限公司]检测左心室舒张末期内径(left ventricular internal diastolic diameter,LVIDd)、左心室收缩末期内径(left ventricular internal diameter at end-systole,LVIDs)、左室舒张末期后壁厚度(left ventricular posterior wall thickness at end-diastole,LVPWd)、左室收缩末期后壁厚度(left ventricular posterior wall thickness at end-systole,LVPWs)、短轴缩短率(fractional shortening,FS)、左心室射血分数(left ventricular ejection fraction, LVEF)及左心室质量(left ventricular mass,LV mass)。
2.5标本收集 大鼠麻醉,固定,开胸,迅速取出心脏,用预冷生理盐水洗净,滤纸吸干,剔除血管、脂肪等非心肌组织,称心脏重量(heart weight,HW),分离左心室并称左心室(含室间隔)重量(LV weight,LVW),并计算心脏(左心)指数=心脏(左心室)重量(mg)/体重(g)。分离的左心室置于EP管中,于液氮中保存待用。
2.6高效液相色谱(high-performance liquid chromatography,HPLC)测定Hcy、SAH及SAM的表达 每20 mg组织加入100~200 μL含1 mmol/L PMSF的裂解液研磨充分后,低温离心10 min,取匀浆上清,并测定总蛋白浓度。取研磨后上清液20 μL注入HLPC,用线性梯度洗脱方式将样品从色谱柱洗脱。线性梯度如下: 0~0.5 min, 100% A; 0.5~20 min, 75% A和25% B; 20~30 min, 75% B和25% A; 30~45 min,100% B。色谱图采用惠普公司HP3394积分仪记录,所有实验进行5次并进行定量分析,通过比较标准曲线峰面积及SAM和SAH的洗脱峰面积获得心肌组织Hcy、SAM和SAH含量。
2.7Western blot实验 每20 mg组织加入100~200 μL含1 mmol/LPMSF的裂解液研磨充分后,4℃、14 000×g离心10 min,取匀浆上清,并测定总蛋白浓度。40~70 μg总蛋白上样量于SDS-PAGE进行分离。湿法转膜2 h,体积分数5%的脱脂奶粉封闭1 h后与相应I抗4 ℃共孵育过夜,次日与辣根过氧化物标记的II抗共孵育,用增强型化学发光试剂进行显色,并利用灰度分析软件定量分析。
3 统计学处理
计量资料以均数±标准差(mean±SD)表示,应用SPSS 19.0统计软件进行数据处理,计量资料的组间均数比较采用独立样本t检验或方差分析,多重比较采用Bonferroni校正的t检验,以P<0.05表示差异有统计学意义。
结 果
1 大鼠DM模型建立情况
实验期间,正常对照组大鼠状态良好,饮食正常,身体健壮,自主活动正常;而DM组大鼠逐渐出现精神萎靡、身体消瘦、毛发不整、腥臊臭味加重、饮食量和饮水量均增加、排泄物显著增多、臭味加重等症状。25只大鼠中造模成功21只,成功率为84%,基础代谢情况见表1。
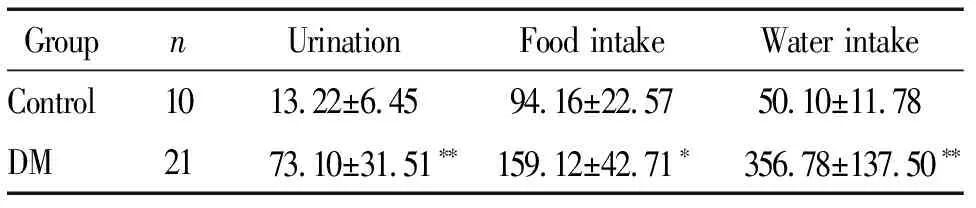
表1 造模后各组大鼠基础代谢情况比较
*P<0.05,**P<0.01vscontrol group.
2 造模后各组大鼠FBG、FINS和ISI的变化
与对照组比较,糖尿病模型组大鼠血清FBG和FINS显著升高(P<0.05),ISI显著下降(P<0.01),表明2型糖尿病大鼠造模成功,见表2。
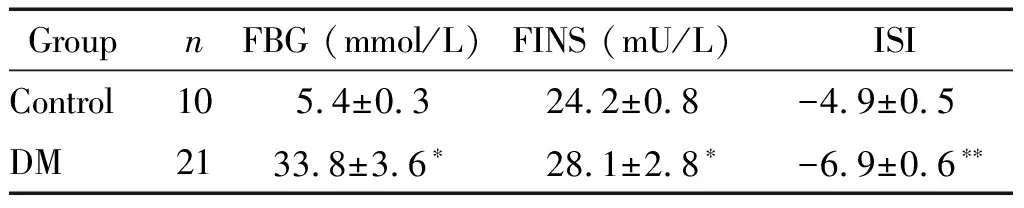
表2 造模后各组大鼠基本情况比较
*P<0.05,**P<0.01vscontrol group.
3 大鼠体重及心脏各指标的测定结果
与对照组相比,DM模型组大鼠体重降低(P<0.05),且体重增量明显降低(P<0.01),心脏及左心室重量明显增加(P<0.01,P<0.05),心脏指数和左心室指数均显著高于对照组(P<0.05);非马沙坦处理组大鼠的体重与模型组相比较差异无统计学显著性,但体重增量显著提高(P<0.05),心脏指数和左心室指数均显著低于DM模型组(P<0.05),见表3。
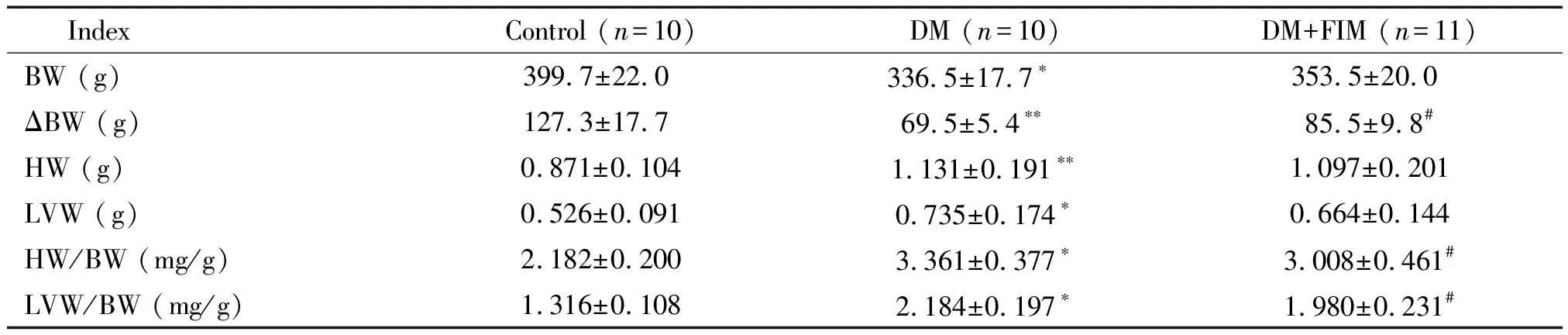
表3 早期DM大鼠体重及心脏相关指标测定
BW: body weight; ΔBW=BWafter-BWbefore; HW: heart weight; LVW: left ventricular weight.*P<0.05,**P<0.01vscontrol group;#P<0.05vsDM group.
4 大鼠血生化指标的检测结果
与对照组比较,DM模型组大鼠血清中FBG和LDL-C明显升高(P<0.01),TG和TC亦升高明显(P<0.05),HDL-C则降低显著(P<0.05);与DM模型组相比较,非马沙坦处理组大鼠血清FBG降低显著(P<0.05),TC和TG含量均略有降低,但差异无统计学意义,HDL-C变化不大,LDL-C降低显著(P<0.05),见表4。

表4 早期DM大鼠血生化指标的检测
*P<0.05,**P<0.01vscontrol group;#P<0.05vsDM group.
5 心脏超声检测结果
与对照组比较,DM模型组大鼠的LVIDd及LVIDs显著增大(P<0.01),LVPWd及LVPWs不同程度增厚(P<0.05),FS、LVEF及LVW显著降低,LVW/BW增高显著,差异具有统计学意义(P<0.05);与DM模型组相比较,DM+FIM组LVPWd降低显著(P<0.05),FS和LVEF升高显著(P<0.05),LVW/BW显著降低(P<0.05),其它各指标变化不大,见图1、表5。
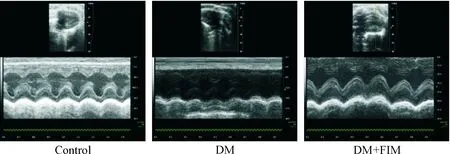
Figure 1. M-mode echocardiography of cardiac tissue from each group.
6 HPLC检测相关氨基酸的表达
同型半胱氨酸在糖尿病模型组大鼠心肌组织中表达显著高于对照组(P<0.01);与DM模型组相比较,DM+FIM组Hcy的表达明显降低,差异具有统计学意义(P<0.05)。与对照组比较,SAH在糖尿病模型组大鼠心肌组织中表达显著降低(P<0.05),而SAM在DM模型组和FIM干预组表达变化的差异无统计学显著性,但SAM/SAH值升高显著,差异有统计学意义(P<0.01)。与DM模型组相比较,DM+FIM组SAM水平同样变化不大,但SAM/SAH值降低显著(P<0.05),见表6。
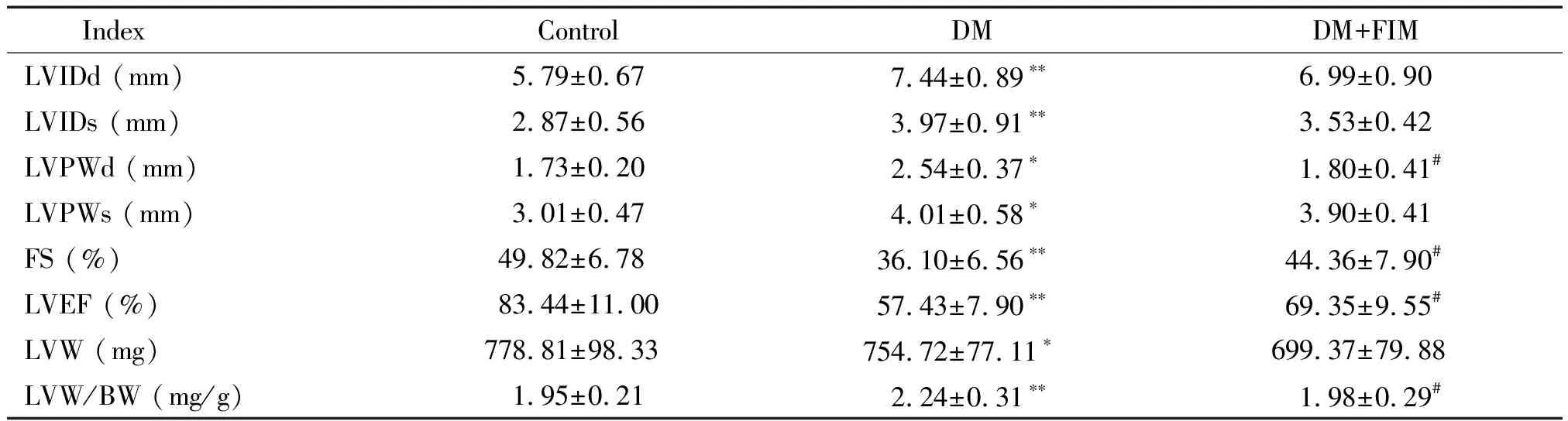
表5 早期DM大鼠左室结构参数及功能比较
*P<0.05,**P<0.01vscontrol group;#P<0.05vsDM group.
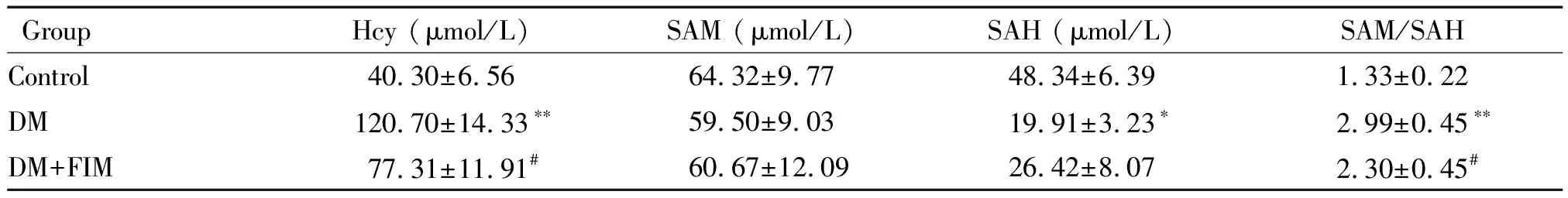
表6 HPLC检测大鼠心肌组织相关氨基酸的表达
*P<0.05,**P<0.01vscontrol group;#P<0.05vsDM group.
7 SAHH及AT1-R蛋白的表达
Western blot实验结果表明,SAHH在各处理组的表达水平表现出显著的差异。相对于正常对照组,DM模型组大鼠心肌SAHH蛋白的表达显著升高(P<0.01);与DM模型组相比较,DM+FIM组SAHH的表达水平显著降低,差异具有统计学意义(P<0.01),见图2。
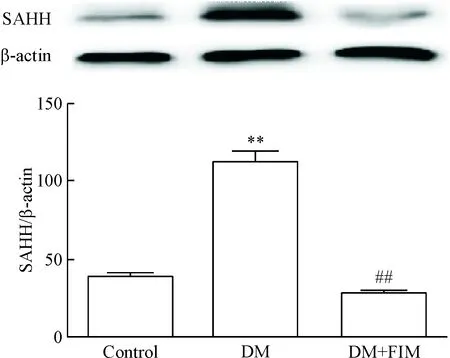
Figure 2. The expression of SAHH in the cardiac tissues in each group determined by Western blot. Mean±SD.n=10.**P<0.01vscontrol group;##P<0.01vsDM group.
AT1-R蛋白在糖尿病模型组大鼠心肌组织中表达相对于正常对照组的差异无统计学显著性;与DM模型组相比较,DM+FIM组的AT1-R蛋白表达增加明显,差异具有统计学意义(P<0.01),见图3。
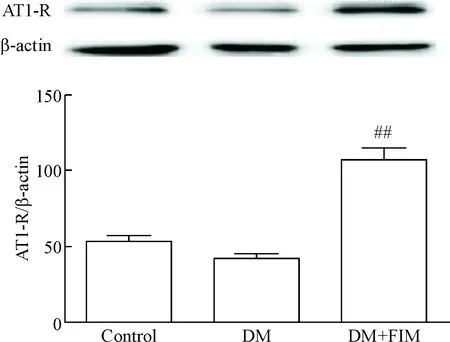
Figure 3. The expression of AT1-R in cardiac tissues of each group determined by Western blot. Mean±SD.n=10.##P<0.01vsDM group.
讨 论
有研究表明,SAHH及下游Hcy等因子的表达可能是心血管病发生发展的重要作用机制,而SAHH的表达调控作用可能是该机制作用中的重要环节[12]。SAHH催化水解SAH生成腺苷和同型半胱氨酸。研究显示,Hcy参与介导多种原因引起的血管损害,同时对包括心脏大血管在内的血管平滑肌细胞、内皮功能、血脂蛋白和血液凝集系统均有损害作用[13]。进一步研究显示,当Hcy水平升高超过与一氧化氮(nitric oxide,NO)反应的饱和极限时,多余的Hcy就可以损伤内皮细胞,导致NO生成减少,从而进一步促进心血管系统的损伤[14]。而SAHH介导产生的内源性腺苷是心血管急性期代偿预适应的触发因子之一,一过性心肌缺血或长时间持续缺血刺激时阻断腺苷受体进而减弱其心肌保护作用。由此我们可以推断,SAHH对早期缺血预适应起到了触发和介导的作用。血管紧张素II受体拮抗剂在心血管疾病的治疗方面表现出越来越多的作用。Song等[15]研究显示,替米沙坦可以通过激活主动脉血管内皮细胞糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK3β)的表达起到缓解高血糖状态下心血管病变的作用。Rhee等[16]研究显示,非马沙坦联合他汀类药物更能降低血液的Hcy等成分,产生更好的心脏保护作用,而相应的机制仍不清楚。
本实验首先对所建立大鼠2型糖尿病模型进行多种形式的验证,以非马沙坦对糖尿病模型大鼠心脏病变进行干预,探究非马沙坦对SAHH表达水平变化的影响,用以推断非马沙坦与SAHH表达状态的调节关系。2型糖尿病大鼠模型研究显示,在干预处理的4周时间里,模型组与正常对照组以及FIM处理组之间已经表现出心肌功能的差异。超声心动图的研究显示,FIM干预组在心肌收缩率、左室舒张末期内径、短轴缩短率、左室射血分数及左室质量等指标表现出心肌功能代偿性的恢复。Western blot结果显示,相对于正常对照组,糖尿病心肌病早期DM模型组心肌组织SAHH的表达显著升高,而FIM处理组则下降;DM模型组AT1-R表达降低,而FIM处理组则升高显著。HPLC技术对相关氨基酸检测结果显示,Hcy在DM模型组表达升高,FIM处理组表达则相对于DM组降低显著,SAH的表达变化趋势与Hcy相反;而SAM在各组间变化不显著。我们推测,在糖尿病状态下,能量代谢紊乱,反馈性引起SAHH表达升高,高表达的SAHH作用下,大量的SAH水解产生Hcy和腺苷,体内Hcy表达处于高水平。而本实验结果显示,DM模型组大鼠心肌组织Ang II显著升高,直接作用于心肌成纤维细胞,与细胞表面的AT1-R结合刺激心肌成纤维细胞增生及胶原代谢的改变,引起心肌间质及血管周围纤维化,导致心脏重构,心室顺应性下降,最终引起舒张和收缩功能障碍,心肌局部RAS异常激活,AT1-R的表达显著降低,而在给予FIM干预后,AngⅡ水平显著降低,而AT1-R表达出现反馈性升高,高表达的血管紧张素抑制了SAHH的活性,同时Hcy处在甲硫氨酸循环中SAH的下游,高水平的Hcy同时也引起SAHH表达下调,SAHH不足促进了SAH降解受阻、浓度升高。而SAH又恰处于SAM向DNA转甲基反应的下游,SAHH降低,SAH升高,转甲基反应受阻,甲硫氨酸循环紊乱,从而促进DNA低甲基化的发生。体内DNA低甲基化状态同时又影响Hcy代谢,而SAM的表达变化不大。本研究提示,非马沙坦在体内可能是起到SAHH内源性抑制剂的作用来调节SAHH的表达,进而能够缓解高糖尿病状态下Hcy相关的心肌病变及SAH诱导的心脏大血管病变,其机制可能与血管紧张素动态调节SAHH的酶活来影响Hcy的代谢水平有关。
糖尿病心肌病是糖尿病心血管严重并发症的重要组成部分,氨基酸代谢酶系在该病发生发展过程中研究越来越受到重视。本研究初步探知了非马沙坦可能通过对血管紧张素的表达调节,干预糖尿病心肌病的发生发展过程,也提示我们血管紧张素调节作用在糖尿病心肌病的治疗中可能会是一个有益的研究方向。
