红景天苷对小鼠原代T淋巴细胞体外行为的影响*
2018-08-27尹乐乐叶莎莎欧阳东云曾耀英
尹乐乐, 叶莎莎, 欧阳东云, 曾耀英
(暨南大学1附属第一医院临床检验中心,2生命科学技术学院组织移植与免疫研究中心, 广东 广州 510632)
红景天苷(salidroside,Sal)是从传统藏药红景天(Rhodiolarosea)根部提取出来的一种具有苯酚结构的化合物[1]。Sal作为传统藏药广泛应用于抗炎[2]、抗氧化[3]和抗疲劳等方面的治疗。有研究表明,Sal对多种细胞(如神经细胞、心肌细胞及内皮祖细胞[4]等)具有抗凋亡作用。在Sal对机体固有免疫细胞的影响方面,我们已在前期实验中证实了Sal对小鼠腹腔巨噬细胞体外增殖、吞噬及NO产生均有促进作用,而对细胞凋亡和活性氧簇(reactive oxygen species,ROS)产生均有抑制作用[5]。在Sal与T淋巴细胞研究方面,目前已有文献表明,红景天苷对某些动物模型体内T淋巴细胞型别转换及相关细胞因子调节具有一定的作用[4-7],但其对小鼠原代T淋巴细胞体外行为的影响却鲜有报道。因此,我们通过分析Sal对小鼠T淋巴细胞体外活化、增殖、ROS产生及凋亡的影响,评价其免疫效应及作用机制。
材 料 和 方 法
1 动物
清洁级 BALB/c近交系雄性小鼠,3~4周龄及8~10 周龄,均购于广东省医学实验动物中心,许可证号为SYXK(粤)2012-0122。 其中,3~4周龄清洁级 BALB/c近交系小鼠用于获取胸腺T淋巴细胞,8~10周龄清洁级 BALB/c近交系小鼠用于获取淋巴结T淋巴细胞。
2 主要试剂和仪器
红景天苷购自中国江苏华荣生物科技有限公司,粉末状,水溶性,纯度为99 %,将红景天苷用PBS溶解配制成 400 mmol/L的储存液,分装,于-20 ℃避光保存,临用前用 PBS稀释成工作液;RPMI-1640 细胞培养液和胎牛血清(fetal bovine serum,FBS)购自Gibco;大鼠抗小鼠CD3-PE和仓鼠抗小鼠CD69-FITC购自BD Pharmingen;羧基二乙酸荧光素琥珀酰亚胺酯(carboxyfluorescein diacetate succinimidyl ester,CFDA-SE)购自Molecular Probe;L-谷氨酰胺、β-巯基乙醇(β-mercaptoethanol,β-ME)、刀豆蛋白 A(concanavalin A,Con A)、地塞米松(dexamethasone,DEX)、DMSO、MTT、2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,H2DCFDA)及DiOC6(3)均购自Sigma。
手术剪、眼科剪和眼科镊购自中国苏州手术器械厂;细胞培养板、移液管、离心管、平皿和培养瓶均购自Corning;流式细胞仪(FACSCalibur)购自Becton Dickinson;酶标仪(680 型)购自Bio-Rad。
3 主要方法
3.1淋巴细胞悬液的制备 将BALB/c小鼠断髓处死,浸泡于75%乙醇中进行消毒,无菌分离双侧腋窝、锁骨下、腹股沟浅淋巴结和肠系膜淋巴结,置于盛有预冷的PBS的无菌平皿中,去掉被膜,研磨,200目尼龙网过滤。收集细胞,PBS离心(250×g, 4 ℃, 5 min)洗涤细胞2次,用RPMI-1640 完全培养液(含10% FBS、2 mmol/L L-谷氨酰胺、50 μmol/L β-ME、100 mg/L链霉素和1×105U/L青霉素)调成密度为3×109/L的淋巴细胞悬液。
3.2MTT比色法检测Sal对小鼠T淋巴细胞活力的影响 实验分组:阴性对照(negative)组、正常对照(control)组和单纯药物(Sal)组,每组设3个复孔。将密度为3×109/L的细胞悬液接种在96孔板中,每孔190 μL,加入10 μL终浓度分别为80 μmol/L、160 μmol/L和320 μmol/L的Sal工作液,37 ℃、5% CO2培养箱中培养48 h。每孔加入20 μL MTT (5 mg/L),避光孵育4 h后,离心(300×g,5 min)弃上清,每孔加100 μL DMSO,振荡器上避光振荡10 min,以溶解孔底紫色结晶,在酶标仪490 nm波长检测各孔吸光度(A)值,并计算细胞的相对存活率,细胞相对存活率(%)=(Sal组A值-negative 组A值)/(control组A值-negative 组A值)×100%。
3.3荧光标记的单克隆抗体染色分析T淋巴细胞活化抗原CD69表达水平 实验分组:control组、Con A组和Sal+Con A组,每组设3个复孔。Sal同T淋巴细胞孵育培养4 h后,加入终浓度为5 mg/L的Con A继续作用8 h 后收集细胞。PBS离心(250×g,4 ℃,5 min)洗涤细胞2 次,重悬于PBS中,加入anti-mouse CD3-PE和anti-mouse CD69-FITC(终浓度为1 μg/106cells),混匀后室温避光染色30 min,PBS离心(250×g,4 ℃,5 min)洗涤细胞2次,立即上流式细胞仪检测。
3.4CFDA-SE染色法检测小鼠T淋巴细胞增殖情况 调整细胞密度为1×1010/L,加入CFDA-SE工作液(终浓度为1 μmol/L),充分混匀,于室温避光轻轻振荡10 min。用等体积RPMI-1640培养液终止染色,离心(250×g,4 ℃,5 min),弃上清,相同条件洗涤细胞2 次后,用RPMI-1640完全培养液重悬,并调整细胞密度为3×109/L。实验分组:control组、Con A组和Sal+ Con A组,每组设3个复孔。Sal同T淋巴细胞孵育培养4 h后,加入终浓度为5 mg/L的Con A继续作用72 h 后收集细胞,上流式细胞仪检测。
3.5H2DCFDA荧光探针检测小鼠T淋巴细胞胞内ROS的生成量 实验分组:control组和单纯药物(Sal)组,每组设3个复孔。Sal同T淋巴细胞孵育培养48 h后,弃细胞培养板内上清液,再用板内PBS 清洗细胞后弃上清。用200 μL终浓度为5 μmol/L的H2CFDA将细胞重悬。将细胞悬液于室温避光染色30 min,2 mL PBS离心(250×g,4 ℃,5 min)洗涤细胞2 次,弃去上清,用200 μL的PBS将细胞重悬,且立即上流式细胞仪检测。
3.6DIOC6(3)染色检测不同浓度Sal对T淋巴细胞线粒体活性的影响 实验分组:control组和单纯药物(Sal)组,且每组设3个复孔。Sal同T淋巴细胞孵育培养48 h后,弃细胞培养板内上清液,再用板内PBS 清洗细胞后弃上清。用200 μL终浓度为20 nmol/L的DiOC6(3) 将细胞重悬。将细胞悬液于室温避光染色30 min,加2 mL PBS离心(250×g,4 ℃,5 min)洗涤细胞2 次,弃去上清,用200 μL的PBS将细胞重悬,立即上流式细胞仪检测。
3.7DiOC6(3)染色检测DEX 诱导作用下Sal对T淋巴细胞线粒体膜电位的影响 实验分组:control组、DEX组和Sal+DEX组,且每组设3个复孔。调整密度为3×109/L的细胞悬液,接种在96孔板中,每孔190 μL,加入10 μL Sal工作液,在37 ℃、5% CO2培养箱中待药物作用4 h后,加入1 μL浓度为100 μmol/L的地塞米松,继续培养24 h后收集细胞,用2 mL PBS洗涤2 次(250×g,4 ℃,5 min),弃去上清,用200 μL终浓度为20 nmol/L的DiOC6(3) 将细胞重悬。将细胞悬液于室温避光染色30 min,PBS离心(250×g,4 ℃,5 min)洗涤细胞2 次,弃去上清,用200 μL的PBS将细胞重悬,立即上流式细胞仪检测。
3.8小鼠胸腺T淋巴细胞悬液的制备 取3~4周龄BALB/c小鼠,断颈处死,浸泡于75%乙醇中进行消毒,无菌分离胸腺组织,在含有PBS的无菌平皿中去掉被膜,于200目尼龙网研磨过滤,收集细胞,PBS离心(250×g,4 ℃,5 min)洗涤细胞2次。用含10% FBS的RPMI-1640完全培养液将胸腺细胞重悬,并调整细胞密度为3×109/L,即得胸腺细胞悬液。
3.9流式细胞术检测Sal 对DEX诱导作用下胸腺T淋巴细胞凋亡的影响 实验分组:control组、DEX组和Sal+DEX组,且每组设3个复孔。调整胸腺T淋巴细胞悬液接种于96 孔板,每孔190 μL体系。加入10 μL Sal工作液,在37℃、5% CO2培养箱中待药物作用4 h后,加入终浓度为10-7mol/L的DEX。于37 ℃、5% CO2培养箱中继续培养 4 h,收集细胞,用PBS洗涤2 次(250×g,4 ℃,5 min),弃去上清,用200 μL终浓度为20 nmol/L的DiOC6(3) 将细胞重悬。将细胞悬液于室温避光染色30 min,PBS离心(250×g,4 ℃,5 min)洗涤细胞2 次,弃去上清,用200 μL 的PBS将细胞重悬,立即上流式细胞仪检测。
3.10流式细胞术检测及数据统计 全部数据经 FACSCalibur、FACSAria 型流式细胞仪和 CellQuest、FACSDivaTM软件获取,获得的数据用CellQuest、 ModFit LT 3.2和FCS Express 3.0软件进行分析。采用SPSS 17.0统计软件,数据以均数±标准差 (mean±SD)表示,组间均数比较则采用单因素方差分析(one-way ANOVA)结合Student-Newman-Keulsq检验。以P<0.05为差异有统计学意义。
结 果
1 不同浓度Sal对小鼠T淋巴细胞体外细胞活力的影响
采用MTT法检测Sal对小鼠T淋巴细胞存活的影响。结果显示,终浓度分别为80、160及320 μmol/L的Sal同原代小鼠T淋巴细胞共孵育48 h后所得的细胞存活率都在90%以上,且与control组相比,无显著差异,见表1。这一结果表明,实验所选浓度范围内Sal对小鼠T淋巴细胞活力的毒性影响较小。

表1 MTT法检测不同浓度Sal对小鼠T淋巴细胞体外存活率的影响
2 Sal对Con A诱导作用下小鼠T淋巴细胞 CD69 分子表达水平的影响
小鼠淋巴结T细胞在静息状态下很少表达CD69;经单纯Con A诱导T淋巴细胞8 h后, Con A组中表达 CD69 的 T淋巴细胞百分率显著增加,与对照组相比较差异显著(P<0.01);实验所用各浓度Sal均能升高 Con A 诱导的T细胞 CD69的表达水平,且呈一定的剂量依赖关系,其中,320 μmol/L Sal能明显提高T淋巴细胞CD69的表达水平,与Con A相比较差异显著(P<0.01),见图1、表2。

Figure 1. Effects of Sal on the expression of CD69 on activatited T lymphocytes in response to Con A stimulus.

表2 Sal对Con A刺激的T淋巴细胞CD69表达的影响
△△P<0.01vscontrol group;*P<0.05,**P<0.01vsCon A group.
3 Sal 对ConA 诱导作用下T淋巴细胞体外增殖的影响
CFDA-SE标记技术利用活细胞染料CFDA-SE随细胞每增殖一代后,其荧光强度减半的原理,结合流式细胞术可动态追踪分析淋巴细胞增殖。用ModFit LT 3.2软件拟合后,我们计算得出各代细胞所占的百分率及增殖指数(proliferation index,PI),即增殖后的细胞总数与增殖前的细胞总数的比值。CFDA-SE标记的T淋巴细胞经Con A诱导刺激72 h后增殖一次的代表性结果见图2,正常对照组仅见一个亲代峰,无增殖峰,未出现CFDA-SE荧光强度减弱;经Con A诱导刺激72 h后, Con A对照组的细胞出现4 个子代峰;而加入80、160及320 μmol/L的Sal后,各药物组内细胞分裂的代数及PI值均有增长(P<0.01),见表3。
4 Sal 对小鼠T淋巴细胞胞内ROS产生的影响
H2DCFDA 作为一种活细胞染料,它在进入活细胞膜内能够被细胞内酯酶作用并转化生成为H2DCF,而后者对细胞内各类ROS敏感且极容易被其氧化并生成2’,7’-dichloroflurorescein,该产物具有强荧光特性,通常结合荧光显微镜或流式细胞术检测细胞内ROS水平,根据平均荧光强度(mean fluorescence intensity,MFI)的变化来表示细胞内ROS生成量的改变。结果显示,各浓度Sal与T淋巴细胞共孵育作用48 h后均能显著降低T淋巴细胞胞内ROS 的产量,其MFI值与control组相比显著降低 (P<0.05),见图3。
5 不同浓度Sal对T淋巴细胞线粒体活性的影响
DiOC6(3)是一种亲脂性荧光染料,它能够与活细胞线粒体发生结合,其结合过程依赖于线粒体自身的膜电位水平,线粒体膜电位的变化又反映线粒体的自身活性,即线粒体膜稳定性所处的状态。一旦线粒体膜稳定性变差,即线粒体膜通透性增高致使细胞趋向发生凋亡。通常在流式细胞术结果中DiOC6(3)的MFI发生左移往往是意味着细胞线粒体膜稳定性变差。本次实验结果显示,单独Sal作用于T淋巴细胞均能够明显提高其线粒体膜电位水平,且与control组相比较差异显著(P<0.01),且呈一定剂量依赖关系,见图4。

Figure 2. Effects of Sal on the proliferation of T cells stimulated by Con A for 72 h.
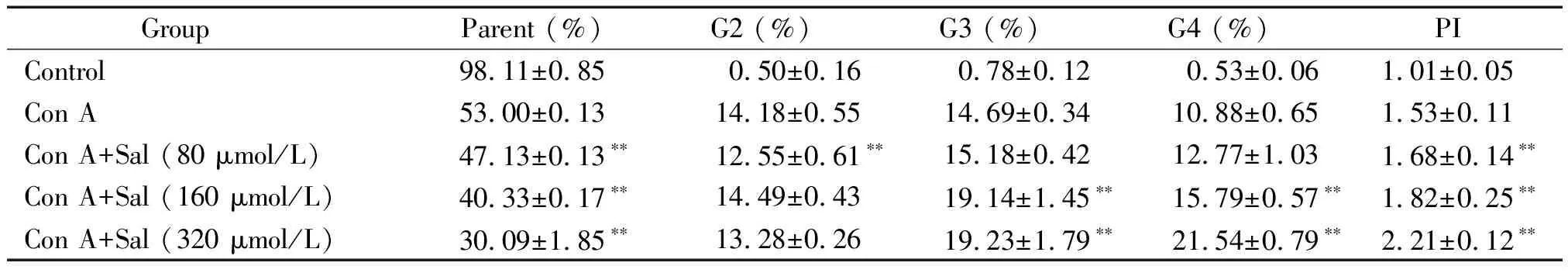
表3 Sal对Con A诱导72 h条件下T淋巴细胞体外增殖的影响
Parent: parent cells; G: the cells at different generations; PI: proliferation index.**P<0.01vsCon A group.
6 Sal对DEX诱导作用下小鼠 T淋巴细胞线粒体膜电位的影响
我们分别用终浓度为80 μmol/L、160 μmol/L和320 μmol/L的Sal与T淋巴细胞共孵育4 h,然后再用DEX体外诱导T淋巴细胞24 h,结果显示,DEX组DiOC6(3)的MFI值与control组相比显著降低(P<0.01);各浓度Sal在DEX诱导条件下能显著提升T淋巴细胞内线粒体膜电位水平(P<0.01),见图5。
7 Sal 对DEX诱导作用下小鼠胸腺T淋巴细胞凋亡的影响
结果显示,control组内胸腺T淋巴细胞发生凋亡率为(19.36±1.91)%,而经DEX诱导后,胸腺T淋巴细胞的凋亡比率上升至(35.48±2.13)%,与control组相比显著升高(P<0.01);终浓度为80 μmol/L、160 μmol/L和 320 μmol/L的Sal均可以明显降低DEX诱导的胸腺T淋巴细胞凋亡,其细胞凋亡率分别为(31.34±3.57)%、(28.99±2.54)%和(24.47±2.03)%(P<0.01),见图6。
讨 论
T淋巴细胞源自机体骨髓中的淋巴样前祖细胞,它在胸腺中发育成熟,并具有高度的异质性。它介导特异性免疫应答,在T细胞依赖性抗原诱导的体液免疫应答中发挥重要作用。我们知道,T淋巴细胞在执行特异性免疫应答过程中,可分为3个阶段:(1)T淋巴细胞特异性识别抗原阶段;(2)T淋巴细胞活化、增殖和分化阶段;(3)效应T淋巴细胞的产生和效应阶段。几乎所有免疫相关病症的发生、发展均与T淋巴细胞行为的改变相关。而T淋巴细胞行为改变的程度又可直接影响着特异性免疫应答的模式、强弱和结果。例如,在机体感染病原微生物过程中,T淋巴细胞在识别特异性抗原后能否发生快速细胞活化和增殖这一事件是影响机体免疫系统对外界抗原进行免疫防御和免疫应答功能的关键环节。另外,T淋巴细胞的自身活性又是影响T淋巴细胞发挥功能的基础。当T淋巴细胞因过度活化而发生大量凋亡时,通常会引起机体对外界病原微生物等抗原物质进行特异性免疫应答反应的能力下降。因此,保护机体T淋巴细胞行为对增强机体对特异性抗原的应答能力以及预防和控制相关感染性疾病的发生具有重要意义。
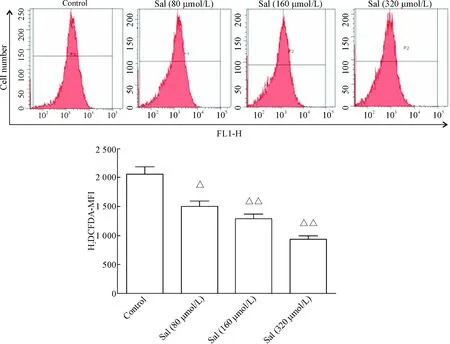
Figure 3. Effects of Sal on the production of ROS from T-lymphocytes. Mean±SD.n=3.△P<0.05,△△P<0.01vscontrol group.

Figure 4. Effects of Sal on the mitochondrial activity in T-lymphocytes. Mean±SD.n=3.△△P<0.01vscontrol group.

Figure 5. Effects of Sal on the mitochondrial membrane potential of T-lymphocytes stimulated by DEX. Mean±SD.n=3.△△P<0.01vscontrol group;##P<0.01vsDEX group.
红景天苷是从传统藏药红景天根部提取出来的一种具有苯酚化学结构的化合物[1],它作为传统藏药广泛应用于抗炎[2]、抗氧化[3]和抗疲劳等方面的治疗。我们已在前期实验中证实了Sal对小鼠腹腔巨噬细胞体外增殖、凋亡、吞噬、ROS和 NO产生等方面均有一定作用[5]。而在Sal与T淋巴细胞研究方面,目前已有文献表明,Sal对某些动物模型体内T淋巴细胞型别转换及相关细胞因子调节具有一定的作用[4-7],但Sal对小鼠原代T淋巴细胞体外行为的影响却鲜有报道。因此,我们通过分析Sal小鼠T淋巴细胞体外活化、增殖、ROS及凋亡的影响,评价其可能的免疫效应及作用机制。
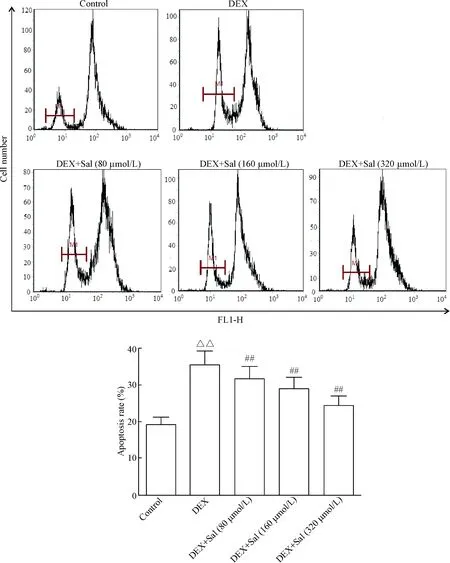
Figure 6. Effects of Sal on apoptosis of thymus T cells in response to DEX. Mean±SD.n=3.△△P<0.01vscontrol group;##P<0.01vsDEX group.
Con A是一种重要的多克隆刺激剂,其作用于T淋巴细胞表面的TCR/CD3复合体而诱导T淋巴细胞的活化及增殖。活化的T淋巴细胞表面表达早期活化表面分子CD69,它是T淋巴细胞活化后最早表达的表面分子,在多克隆刺激剂Con A作用下,T淋巴细胞会迅速活化,即T淋巴细胞经ConA刺激后30~60 min即可检到CD69 mRNA,2~3 h表达于T淋巴细胞表面,18~24 h表达量达到高峰。以CD69的表达水平作为T淋巴细胞的早期活化标志来研究体外干预对T淋巴细胞活化的影响是重要的免疫学研究方法。本实验结果表明,通过对小鼠T淋巴细胞表面分子CD69表达百分率变化的检测,Sal能够促进Con A刺激下T淋巴细胞表面分子CD69的表达。这为Sal促进T淋巴细胞早期活化提供了直接证据,并可能对细胞活化后的细胞增殖等行为的影响提供实验依据。
初始T淋巴细胞在病原微生物或免疫刺激原刺激下迅速活化,被活化的T淋巴细胞迅速进入细胞周期,并通过有丝分裂大量增殖,并进一步分化成为效应T 淋巴细胞并快速增殖,然后离开淋巴器官随血液循环到达特异性抗原聚集部分执行其免疫效应功能。因此本研究中,我们选用CFDA-SE染色结合流式细胞术检测Sal对Con A刺激下小鼠T淋巴细胞增殖的影响。实验结果表明,Sal 对 Con A 诱导的细胞增殖有明显的促进作用,可显著增加细胞的增殖指数及子代细胞所占的比例,并且呈剂量依赖性。谢乐斯等[8]研究表明,Sal具有类丝裂原样效应,可增强T淋巴细胞介导的特异性免疫。这与我们结果相一致。但Sal对促进小鼠T 淋巴细胞增殖的机制尚未有研究表明,还有待进一步探讨。
ROS能够起始细胞的凋亡级联反应。当细胞产生过量ROS往往导致细胞发生凋亡或坏死[9]。而细胞凋亡是一个主动的由基因决定的自动结束生命的过程。本研究分别以H2DCFDA染色法和DiOC6(3)染色结合流式细胞术分析Sal 对 T 细胞ROS产生和对细胞胞内线粒体膜电位的影响。结果表明,Sal的长时间作用能够使T淋巴细胞内ROS的产量降低。同时,Sal亦能够通过加强线粒体膜的稳定性来抑制 DEX诱导T淋巴和胸腺细胞的凋亡。前人研究表明,Sal能清除机体内不同种类的超氧阴离子自由基和羟基自由基[10-11]。本研究结果与文献研究结果相一致,但Sal在抑制T淋巴细胞胞内ROS产生以及保护细胞凋亡方面中所参与的环节尚未清楚,还需进一步工作加以证实。
综上所述,Sal能够明显提高小鼠T淋巴细胞的活性,促进T淋巴细胞的体外活化和增殖,抑制细胞内ROS的产生以及DEX诱导的T淋巴细胞和胸腺细胞的凋亡。但Sal在抑制T淋巴细胞胞内ROS产生及保护细胞免于凋亡方面所参与的环节尚未清楚,还需我们进一步工作加以证实。
