硝酸甘油联合β-巯基乙醇对冠心病患者外周血内皮祖细胞的影响
2018-08-27曾彩雨杨发林宁建文
曾彩雨, 贺 红, 杨发林, 潘 建, 宁建文, 刘 鑫
(1浙江大学医学院附属第一医院急诊科, 浙江 杭州 310003; 山东大学齐鲁医院2心内科,3检验科, 山东 济南 250012)
血管内皮功能障碍尤其是内皮祖细胞(endothelial progenitor cells,EPCs)功能障碍参与动脉粥样硬化(atherosclerosis,AS)的发生发展,并在缺血性疾病中起重要作用,外周血和骨髓来源的EPCs在特定条件下能够定向迁移到内皮损伤部位,通过一系列内皮修复机制改善内皮功能障碍[1]。既往研究表明一氧化氮(nitric oxide,NO)调节的信号途径参与了EPCs的动员、增殖、迁移、分化和黏附的各个过程[2]。硝酸甘油(nitroglycerin,NTG)作为治疗心血管疾病的基础药物已有百年历史,然而实验证实给大鼠48 h不间断滴注硝酸甘油能制作硝酸甘油耐药模型,并发现硝酸甘油耐药可诱导EPCs凋亡并抑制其增殖;临床经验也显示长期持续或一次大量静脉应用硝酸甘油会产生过量活性氧簇(reactive oxygen species,ROS),细胞实验证明这些ROS来自线粒体、NADPH氧化酶和脱耦联的内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)等,其中损伤作用极强的过氧亚硝基阴离子(peroxynitrite anion,ONOO-)会降低NO的生物利用度,从而引起血管内皮功能障碍,临床上诱发硝酸甘油耐药[3-4]。前期实验已经证明低浓度(7.5 mg/L)的硝酸甘油通过提供适宜浓度的外源性一氧化氮,可上调血管内皮生长因子A(vascular endothelial growth factor-A,VEGF-A)的表达,促进EPCs的增殖;而高浓度(20.0 mg/L)的硝酸甘油通过过量外源性NO使ONOO-和ROS水平明显增加,损伤细胞酶系统,从而降低NO的生物利用度,使EPCs增殖能力下降[5]。但是硝酸甘油影响EPCs增殖的分子机制尚未清楚,而β-巯基乙醇(β-mercaptoethanol,β-ME)能否通过提供胞内酶所需的巯基来减轻高浓度的硝酸甘油引起的耐药也未可知。本研究以硝酸甘油作为研究对象,研究其对EPCs体外增殖影响的分子机制,并将β-巯基乙醇与中毒浓度的硝酸甘油联用,探讨硝酸甘油耐药的干预措施及潜在机制,为硝酸甘油在冠心病(coronary heart disease, CHD)治疗中的使用提供新的基础理论依据,并为解决硝酸甘油耐药问题提供新的思路。
材 料 和 方 法
1 患者来源
本实验所选的冠心病患者为山东大学齐鲁医院2013年1月~2015年1月于心内科住院患者,共75例,这些患者均因冠脉疾病行选择性冠脉造影,经相关检查排除6个月内曾患心肌梗死、主动脉狭窄、肥厚性心肌病及恶性高血压,且住院期间未服用维生素E及维生素C等抗氧化的药物。实验分2组,其中对照(control)组40人,34例女性,6例男性,平均年龄(55.7±7.1)岁,住院期间未常规应用硝酸酯类药物或用药小于24 h;硝酸甘油(NTG)组35人,31例女性,4例男性,平均年龄(58.9±8.0)岁,住院期间曾连续使用硝酸甘油(>0.5 μg·kg-1·min-1)超过48 h。本研究经山东大学齐鲁医院伦理委员会通过(KYLL-2013-115),所有患者及志愿者签署知情同意书后获取实验材料。
2 实验材料
胎牛血清、M199培养基、胰蛋白酶和PBS(Hyclone);MTT (Sigma);6孔、24孔及96孔细胞培养板(Corning);VEGF及ONOO-酶联免疫吸附试剂盒(R&D system);抗β-actin抗体及辣根过氧化物酶标记的山羊抗兔/鼠 II 抗(中杉金桥);鼠抗人p-Akt、Akt(Ser473)、p-eNOS和eNOS(Ser1177)抗体(CST)。CO2恒温培养箱(HERAcell 2401);酶标仪(Infinite M200);离心机(Beckman L-100XP);倒置荧光显微镜(OLYMPUS IX70-142);激光共聚焦显微镜(ZEISS LSM710)。
3 实验方法
3.1临床试验 留取上述患者及健康志愿者外周血各1 mL,用流式细胞仪测定CD34和KDR双标阳性的循环内皮祖细胞水平,并用ELISA法检测血浆中ONOO-和VEGF-A的表达水平。
3.2内皮祖细胞的分离、培养和鉴定 留取经冠脉造影确诊的冠心病患者及正常志愿者外周血各50 mL,用人淋巴细胞分离液经密度梯度离心法获得单个核细胞,加入M199培养基调整细胞密度至(2~5)×109/L,接种至人纤维连接蛋白包被的24孔培养板中,放入培养箱(37 ℃、5% CO2、湿度95%)中培养,培养4 d后去除未贴壁细胞,隔天换液。培养过程中在倒置显微镜下观察细胞形态变化。培养至第7天,对贴壁细胞进行鉴定:加入DiI标记的乙酰化低密度脂蛋白(DiI-labeled acetylated low-density lipoprotein,DiI-ac-LDL,2.4 mg/L),37 ℃孵育1 h,PBS洗2次,4%多聚甲醛固定细胞,用PBS浸洗3次,晾干后将10 mg/L的FITC-UEA-I加入上述标本,37 ℃孵育1 h,再用PBS洗3次,吹干待检;滴上缓冲甘油(甘油1份和0.01 mmol/L、pH 7.2的PBS 1份)1滴,于多波长激光共聚焦显微镜鉴定。计数鉴定正常志愿者及冠心病患者贴壁细胞的数量,检测其黏附能力、迁移能力(Boyden小室法)及成血管能力(采用体外血管生成试剂盒检测体外EPCs的血管生成能力,细胞拉长变形,长度为宽度的4倍以上可被认为形成小管),以上计数均于400倍倒置显微镜下选取8个视野计数后,计算每高倍视野平均数。
3.3冠心病患者内皮祖细胞活力的检测 MTT法分别检测硝酸甘油、LY294002及β-巯基乙醇对EPCs活力的影响,培养7 d后用胰蛋白酶消化贴壁的EPCs,并重新接种到96孔板中,分别用硝酸甘油(7.5和20 mg/L)、LY294002(50 μmol/L)及β-巯基乙醇(50 μmol/L)进行干预,72 h后用MTT法检测EPCs活力,在培养第12天,在显微镜高倍视野下用人工计数法观察不同浓度硝酸甘油对EPCs集落数及EPCs绝对计数的影响,在24孔板中培养可见集落时在400倍倒置显微镜下选取8个视野计数后,计算每高倍视野平均数,继续培养2 d后消化下贴壁细胞计数绝对数取平均值,计数由未参与处理细胞的两人独立完成。
3.4冠心病患者EPCs培养液中ROS、ONOO-和VEGF-A水平的检测 硝酸甘油和β-巯基乙醇干预72 h后,用DCFH-DA探针检测上清液中ROS水平,去除细胞培养的上清液,每孔各加入10 μmol/L的DCFH-DA,并以DMSO作为溶剂对照,37 ℃孵育细胞60 min后,用PBS洗涤细胞2次,每孔再加入适量培养基,分别采用荧光显微镜及荧光酶标仪对其荧光强度进行检测;同时,根据ELISA试剂盒说明书用ELISA法检测细胞培养上清液中ONOO-及VEGF-A的水平。
3.5冠心病患者内皮祖细胞Akt、p-Akt、eNOS及p-eNOS水平的检测 用冷PBS漂洗细胞3次,每孔加入200 μL细胞裂解液,刮下细胞,冰上裂解30 min后,15 000 r/min、4 ℃离心30 min,取上清蛋白溶液于-70 ℃保存备用,各组取30 μg蛋白进行SDS-PAGE,然后转移至醋酸纤维素膜上,5%脱脂奶粉-PBST室温封闭1 h,分别加入I抗,4 ℃孵育过夜,PBST漂洗3次,每次10 min,再加入辣根过氧化物酶标记的II抗,37 ℃孵育1 h,ECL化学发光显影,用β-actin 蛋白的吸光度进行标准矫正,ImageJ计算目的蛋白磷酸化与β-actin的比值。
4 统计学处理
应用SPSS 16.0软件进行统计学处理。所有实验至少重复4次,计量资料以均数±标准差(mean±SD)表示。表1和表2中两组间均数比较采用t检验,其余数据采用单因素方差分析比较组间差异,以P<0.05为差异有统计学意义。
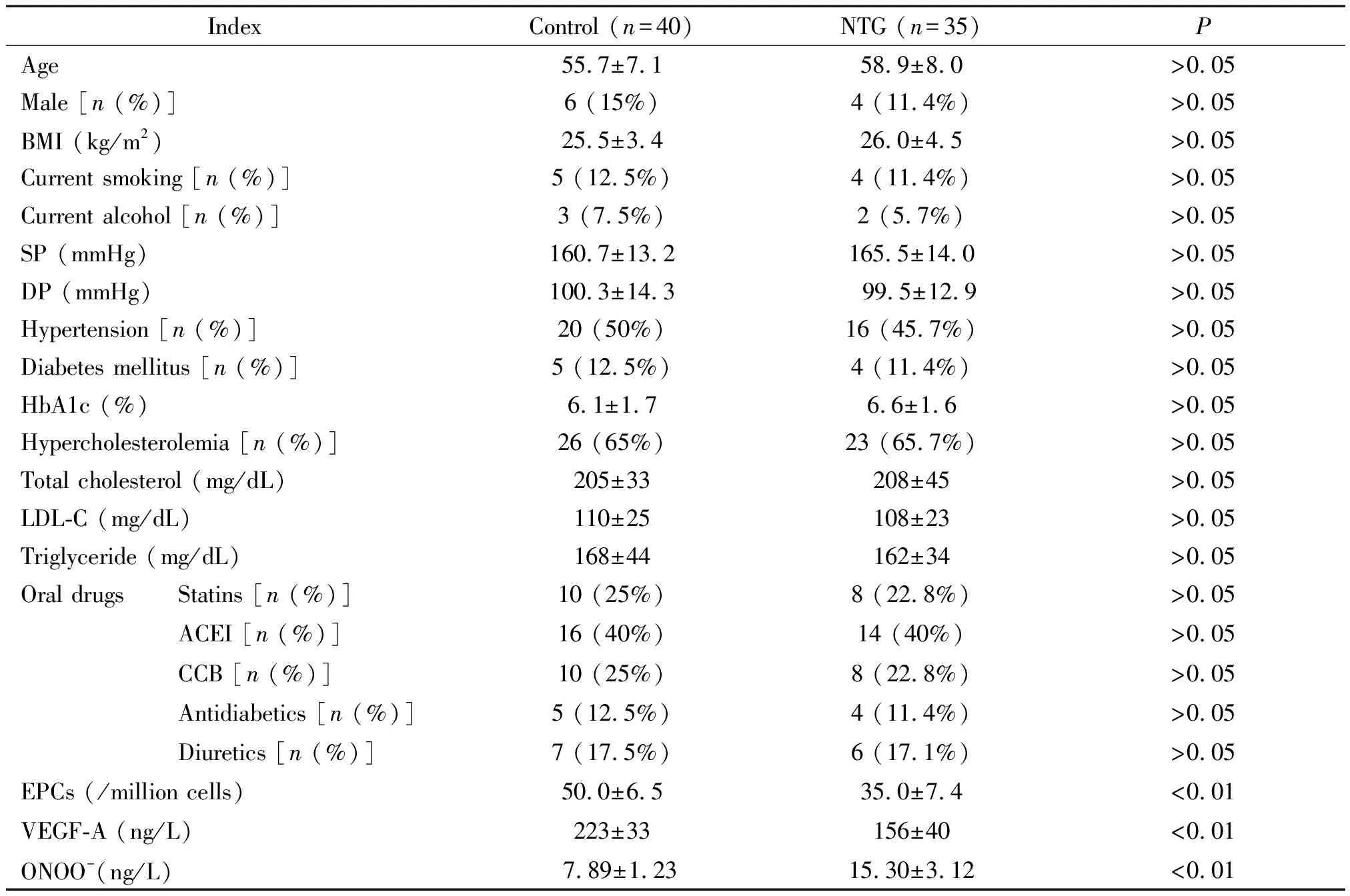
表1 对照组与高浓度硝酸甘油组各项临床资料及EPCs、VEGF-A和ONOO-水平
BMI: body mass index; SP: systolic pressure; DP: diastolic pressure; LDL-C: low-density lipoprotein cholesterol; ACEI: angiotensin-converting enzyme inhibitor; CCB: calcium channel blocker; EPCs: endothelial progenitor cells; VEGF-A: vascular endothelial growth factor-A; ONOO-: peroxynitrite; CRP: C-reactive protein.

表2 冠心病患者与健康志愿者循环血中内皮祖细胞数量及功能的比较
结 果
1 冠心病患者临床资料的比较
与对照组相比,在年龄、血压、血糖和血脂等基础资料无明显差异的情况下,高浓度硝酸甘油组内皮祖细胞数量明显下降(P<0.01),血清中ONOO-水平明显升高(P<0.01),VEGF-A水平显著降低(P<0.01),见表1。
2 冠心病患者EPCs功能变化及细胞形态观察
与正常志愿者比较,显微镜高倍视野下观察冠心病患者贴壁的EPCs数量减少(P<0.05),黏附能力、迁移能力和成血管能力均减弱(P<0.05),见表2;细胞形态的变化基本一致,培养7 d 的EPCs可见细胞集落周围出现梭形细胞,见图1A;培养14 d 的EPCs呈大的集落样生长,四周梭形细胞放射状排列,见图1B;再培养1~2 d 呈铺路石样改变,见图1C。2类人群来源的EPCs用DiI-ac-LDL和FITC-UEA-I鉴定,EPCs吸附FITC-UEA-I呈绿色,见图1D,EPCs吸附DiI-ac-LDL呈红色,见图1E,合成后呈黄色,图1F。
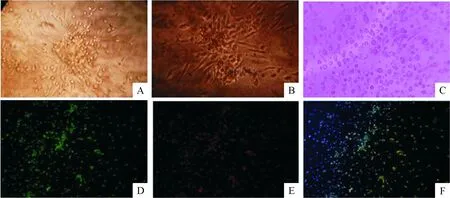
Figure 1. Morphology and characterization of EPCs from peripheral blood. A:colonies were reached a peak on the 7th d (×400); B: at day 14, the colony formation started with a central aggregate of round cells, surrounded by spindle-shaped cells radiating away from the central core that display endothelial features (×400); C: paving stone sample cells were formed (×400); D: the attached EPCs were evaluated for the uptake of lectin (FITC-UEA-I) (green,×100); E: binding of acetylated LDL labeled with 1,1’-dioctadecyl-3,3,3’,3’-tetramethylindocarbocyanine (red,×100); F: the merged image of D and E(×100).
3 硝酸甘油影响冠心病患者EPCs活力的机制
与对照组相比,适宜浓度的硝酸甘油通过显著增强EPCs中p-eNOS(Ser1177)和p-Akt(Ser473)的蛋白水平,见图3C,改善PI3K/Akt/eNOS信号通路,从而促进VEGF-A分泌,见图3B,来促进EPCs的生长,见图3A;而高浓度硝酸甘油抑制了Akt和eNOS的磷酸化水平及VEGF-A的分泌,见图3C、4D,提高了上清液中ONOO-水平及贴壁细胞ROS水平,见图4B、图2,使EPCs的活力被抑制,见图3A、4A。
4 β-巯基乙醇明显改善高浓度硝酸甘油对冠心病患者EPCs活力的抑制作用
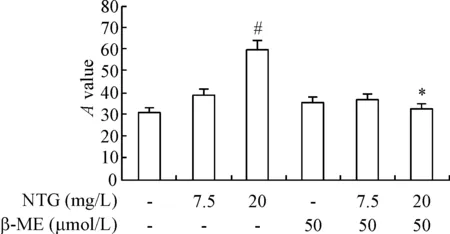
Figure 2. The effect of NTG and β-ME on the releasing of ROS in EPCs. Mean±SD.n=5.#P<0.05vscontrol group;*P<0.05vsNTG (20 mg/L) group.
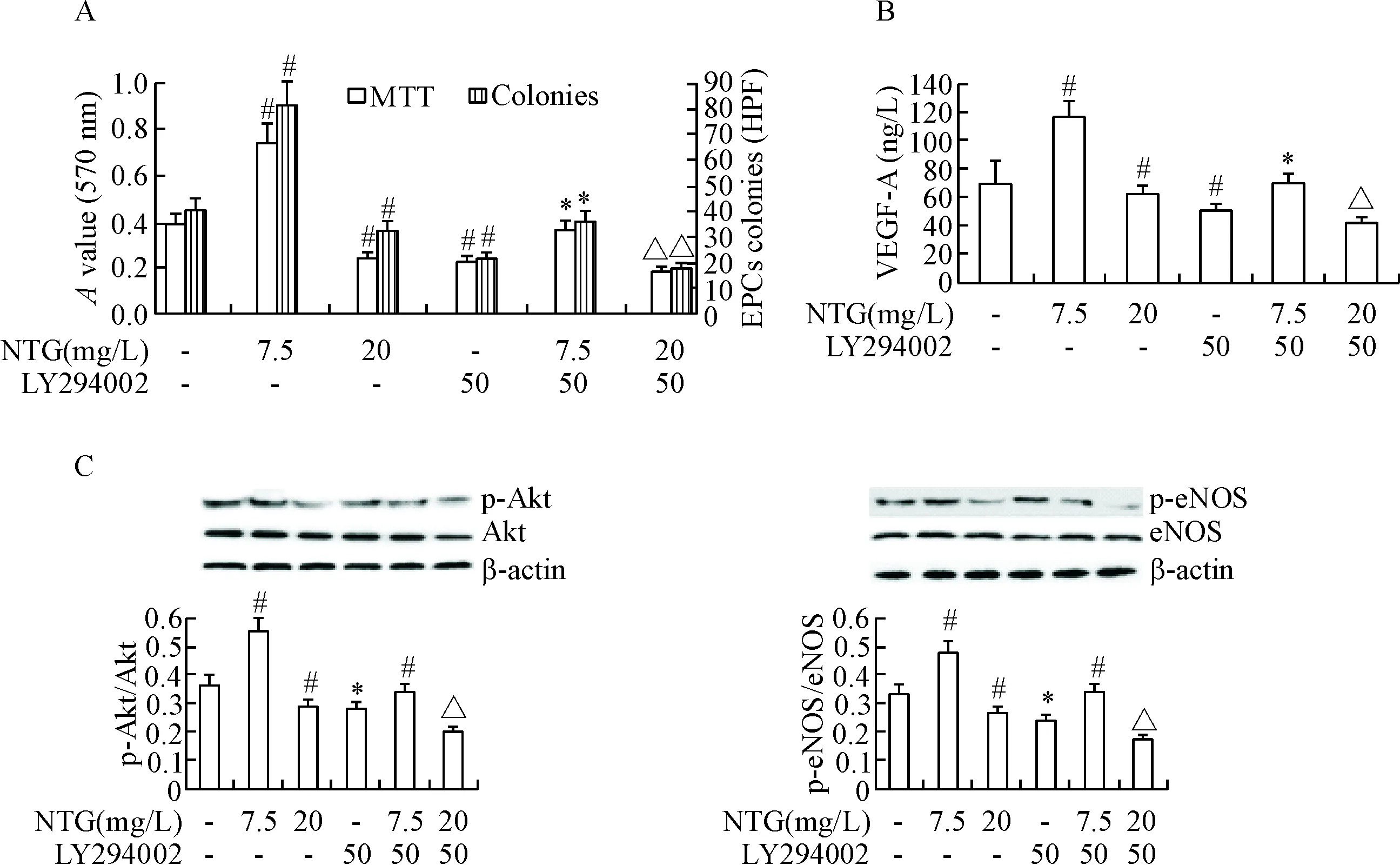
Figure 3. The effects of NTG and LY294002 on the cell viability of EPCs. A and B: the cell viability and VEGF-A production of EPCs were detected; C: the protein expression of p-Akt and p-eNOS was detected by Western blot. Mean±SD.n=5.# P<0.05vscontrol group;*P<0.05vsNTG (7.5 mg/L) group;△P<0.05vsNTG (20.0 mg/L) group.

Figure 4. The effects of NTG and β-ME on EPCs.A: pre-incubation with β-ME enhanced the proliferation of EPCs as compared with single NTG treatment (20.0 mg/L); B and C: there was a significant decrease in ONOO-production, and a significant increase in VEGF-A production between NTG-treated group and the NTG (20.0 mg/L)+β-ME (50 μmol/L) group;D:β-ME reversed the effect of excess NTG (20.0 mg/L)-induced down-regulation of p-Akt and p-eNOS protein levels. Mean±SD.n=3.#P<0.05vscontrol group;△P<0.05vsNTG (20 mg/L) group.
与高浓度硝酸甘油(20.0 mg/L)组相比,联用β-巯基乙醇明显降低ONOO-的水平,见图4B,和降低贴壁细胞ROS的生成,见图2,改善磷酸化Akt和eNOS的水平,见图4D,表明β-巯基乙醇可以通过减轻氧化应激并改善PI3K/Akt/eNOS信号通路来改善硝酸甘油耐药。
讨 论
本研究证明了:(1)与对照组相比,连续应用高浓度硝酸甘油48 h可使冠心病患者会产生耐药,具体表现为抑制外周血中EPCs活力,使其分泌ONOO-水平升高血循环血中VEGF-A的分泌减少;(2)不同浓度硝酸甘油通过影响EPCs中p-Akt和p-eNOS的蛋白水平影响ONOO-和VEGF-A生成来改变EPCs的细胞活力;(3)β-巯基乙醇从蛋白水平改善了耐药情况下EPCs中Akt和eNOS的磷酸化水平,恢复了eNOS的活性,改善了硝酸甘油耐药,说明除了已证明的NO可通过环磷酸鸟苷通路介导影响细胞生长和分化,外源性NO也通过PI3K/Akt/eNOS信号通路介导影响细胞的生长和分化。
通过新生血管供给营养来恢复组织和器官的功能被认为是机体发生缺血性疾病后自我修复的一种重要途径,EPCs在缺血组织血管新生中起到关键作用[6]。以往研究证明PI3K/Akt/eNOS信号通路在细胞的生长、增殖及功能发挥等多方面具有重要作用[7]。该信号途径的多种上游细胞因子(如PI3K及PKB/Akt)和下游因子(如eNOS、mTOR、p70S6K和FOXO)等调节EPCs的增殖[8-9]。在PI3K及eNOS敲除的小鼠中由缺血和VEGF引起的EPCs的增殖和动员能力均下降[10]。我们的研究也证明了适宜浓度的硝酸甘油可以通过提供的外源性NO来调节PI3K/Akt/eNOS信号通路,促进EPCs生长。
以往的研究大多认为硝酸甘油只能迅速改善心脏病症状,不能改善预后,且长期连续或一次大剂量应用后会产生耐药,限制了其在临床上的应用,目前的治疗指南中硝酸甘油未成为像β-受体阻滞剂及钙通道阻滞剂治疗心脏病的一线药物。引起硝酸甘油耐药的机制有多种,近来对硝酸甘油体外耐药机制的研究如下:(1)巯基耗竭学说认为硝酸甘油向NO的生物转化过程中需要多种巯基酶的参与,持续应用硝酸甘油会引起细胞内巯基的逐渐消耗,导致NO生成逐渐减少,生物利用度下降[3];(2)氧化应激学说认为长期持续应用硝酸甘油在代谢过程中产生过氧化亚硝酸蓄积,对细胞DNA损伤作用强[11]。研究证实持续硝酸甘油治疗时超氧阴离子的生成主要来源有黄嘌呤氧化酶、NADH/NADPH氧化酶[12]、线粒体及内源性NOS(主要是eNOS脱耦联引起),大量的超氧化物可以使硝酸甘油向NO的转化发生障碍,生物利用度下降。
为了防止耐药的发生,最常应用的策略是小剂量间断应用硝酸甘油,但会增加心脏缺血事件的发生率。本研究联用β-巯基乙醇,表明:(1)由于硝酸甘油耐药机制之一是巯基的耗竭,多种细胞在增殖、分化及发挥功能方面都有许多酶的参与,而这些酶中大多都含有巯基,既往研究表明β-巯基乙醇可通过提供巯基来改善细胞内酶活力来促进其增殖,本实验发现联用β-巯基乙醇可改善硝酸甘油耐药;(2)高强度的氧化应激在硝酸甘油耐药中作用明显,本实验证明β-巯基乙醇可以作为抗氧化剂,显著减少高浓度硝酸甘油刺激时贴壁细胞的ROS产生量,ONOO-分泌量减少,显著改善耐药;(3)β-巯基乙醇从蛋白水平上改善了耐药情况下EPCs中p-Akt和p-eNOS的蛋白水平,恢复了eNOS的活性。
总之,本研究从EPCs水平证明了适量浓度的硝酸甘油提供的外源性NO可以通过上调PI3K/Akt-eNOS信号通路使VEGF-A的含量增加,从而促进冠心病患者EPCs的细胞活力,联用β-巯基乙醇可以改善硝酸甘油耐药,从细胞水平上推测长期小剂量应用硝酸酯类药物或可以改善心脏病患者预后,从而扩大硝酸酯类的临床适应症,为临床上改善硝酸酯类耐药提供了一种新思路。
