多囊卵巢综合征不孕妇女抗精子抗体的评价*
2018-08-27李晓红朱伟杰
江 欢, 李晓红, 朱伟杰
(1深圳市龙岗区妇幼保健院生殖内分泌科, 广东 深圳 518172;2暨南大学生命科学技术学院生殖免疫研究所, 广东 广州 510632)
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是育龄妇女常见的内分泌及代谢紊乱性疾病,大多数患者表现为持续性不排卵的生殖障碍。PCOS介导不孕的发病机制尚未充分认识,近年来研究显示炎症免疫与PCOS的发生发展联系密切,PCOS妇女体内的炎症因子和免疫因子表达增加[1-3],抗卵巢抗体、抗甲状腺抗体和抗核抗体等阳性率较高[4-5],表明机体免疫防御机制有不同程度紊乱,对自身抗原易于发生免疫应答。精子对女性是一个同种异体抗原,产生的抗精子抗体(antisperm antibody, ASA)可降低女性生育力[6]。PCOS妇女处于低度慢性炎症的免疫功能紊乱状态[7-8],是否对精子抗原的易感性增高尚需充分评价。
高雄激素血症和胰岛素抵抗是PCOS妇女的病理生理基本特征。过高雄激素和胰岛素抵抗加重使PCOS妇女肥胖的发生率增加。脂肪细胞具有内分泌作用,可分泌多种脂肪细胞因子参与免疫细胞活动及炎性反应过程。肥胖改变了机体脂肪细胞因子的分泌平衡,可以加剧PCOS妇女的免疫功能紊乱状态,但肥胖及非肥胖PCOS不孕妇女与精子抗原有否联系尚无资料。在先前研究的基础上[9],本实验检测肥胖型及非肥胖型PCOS不孕妇女的ASA水平,以期阐明PCOS与精子同种免疫的相互关系,为深入认识PCOS介导不孕的发病机制提供参考资料。
材 料 和 方 法
1 材料
ASA免疫珠(抗IgG和IgA型)购于Irvine Scientific;牛血清白蛋白和DMEM培养液购于Gibco。
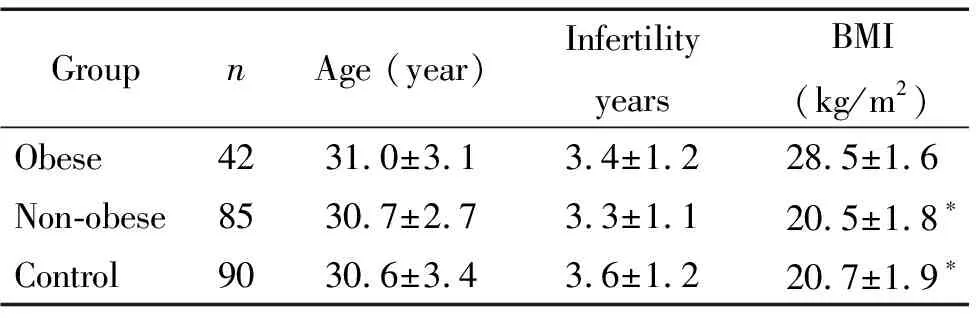
选择2017年1月~12月于深圳市龙岗区妇幼保健院生殖内分泌科就诊的127例原发不孕的PCOS患者,年龄26~35岁,不孕1~5年。PCOS诊断参照鹿特丹诊断标准[10],按体质量指数(body mass index, BMI)分成2组:肥胖型PCOS组(BMI≥25 kg/m2,42例,obese组)和非肥胖型PCOS组(18 kg/m2 于月经期第2~4天做性激素测定的同时获取入组对象的血清标本。按WHO精液分析手册操作方法,采用间接免疫珠试验(indirect immunobead test, iIBT)检测ASA水平[11]。血清标本经56 ℃、30 min灭活,用洗涤后的精子悬液按1∶5比例稀释,37 ℃孵育60 min后,用含0.3%牛血清白蛋白的DMEM培养液洗涤精子2次,调整精子悬液浓度为2.0×1010/L。取5 μL精子悬液与5 μL免疫珠于玻片上混匀,用相差显微镜放大400倍检查湿片,观察200个活动精子,以>50%活动精子黏附有免疫珠为阳性[11],本实验室设20%~49%为弱阳性,<20%为阴性[12-14]。每次实验均设置阳性及阴性对照。 采用SPSS 19.0统计软件分析。计量资料用均数±标准差(mean±SD)表示,组间比较采用方差分析,ASA阳性率的比较采用2检验。以P<0.05为差异有统计学意义。 Obese组患者平均年龄(31.0±3.1)岁,平均不孕(3.4±1.2)年,BMI≥25 kg/m2,平均BMI 为(28.5±1.6) kg/m2;non-obese组患者平均年龄(30.7±2.7)岁,平均不孕(3.3±1.1)年,18 kg/m2 表1 3组患者一般资料的比较 *P<0.05vsobese group. Obese组和non-obese组患者均未检出ASA-IgG阳性,control组检出2例ASA-IgG阳性,阳性率为2.2%,2例阳性均为原发不孕患者。Obese组、non-obese组和control组分别检出1、2和2例弱阳性,弱阳性率分别为2.4%、2.4%和2.2%,其中control组1例弱阳性为原发不孕患者,另1例为早孕人流后继发不孕患者。3组弱阳性率的比较没有差异。3组均未检出ASA-IgA阳性,见表2。 表2 3组患者血清ASA水平比较 PCOS是临床表现高度异质性的疾病,在育龄妇女的发病率为5%~10%[15],导致女性不孕。PCOS的发病机制复杂并呈多因性,以往认识到PCOS不孕妇女的下丘脑-垂体-卵巢轴抑制了卵泡发育和排卵,近年研究揭示PCOS不孕妇女的免疫功能紊乱,易于激起自身抗原发生免疫反应,产生自身抗体干扰女性生殖[1-5]。精子对女性是同种异体抗原,ASA是引起女性免疫不孕的常见因素[6,16]。本研究中PCOS妇女ASA的检测结果均为阴性,提示PCOS状态下的免疫功能紊乱并未增加这些妇女对精子抗原的易感性。根据WHO精液检查与处理手册的标准,50%以上的活动精子黏附有ASA免疫珠时,才诊断为精子抗原导致的免疫不孕[11]。故此,ASA没有参与介导PCOS不孕妇女的生育力下降。 女性体内ASA产生的确切途径尚未完全阐明。女性生殖道黏膜上皮的屏障作用是构成黏膜局部免疫防御的重要因素。当生殖道炎症或损伤时,正常的免疫屏障或防御机制受到破坏,精子抗原与机体免疫系统接触后,可能诱发女性的同种免疫反应,产生ASA[6, 17]。目前研究认为,炎症免疫与PCOS的发病机制相关,但本课题组先前研究显示,PCOS并不增加妇女ASA的生成[9]。由于胰岛素抵抗,PCOS妇女多合并肥胖[18]。肥胖通常伴随机体的慢性炎症状态,可加重PCOS妇女的免疫功能紊乱[19]。因此,肥胖型PCOS妇女在慢性炎症因子的协同刺激下,对自身或同种抗原的易感性可能增加,但ASA是否参与介导肥胖型PCOS妇女的不孕发病机制未见文献报道。本研究结果显示,肥胖型PCOS不孕妇女体内未检测出ASA阳性,表明PCOS妇女合并肥胖亦没有增加对精子抗原的易感性,可能涉及的因素:(1)PCOS妇女体内激素环境复杂,性激素是参与调控免疫反应的因素之一[20]。雌激素可增加外周血调节性T细胞的水平,增强免疫抑制功能[21]。雄激素可抑制B淋巴细胞增殖和抗体生成,发挥免疫负调节作用[22]。PCOS妇女体内雄激素和雌激素水平升高,通过直接抑制B细胞的抗体合成功能或增加Treg数量等多种途径可抑制免疫应答,减弱了精子抗原对女性免疫系统的刺激作用;(2)本研究所纳入的PCOS对象均已排除生殖道异常及感染等病变,即女性生殖道上皮完整性未受破坏或损伤,避免了精子抗原与女性生殖道免疫活性细胞的接触;(3)女性生殖道局部免疫防御机制相对独立,不受机体炎症状态的影响。故此,没有引起针对精子抗原的免疫应答。 人工流产对子宫内膜和子宫颈会造成损伤,生殖道感染是人流术后常见的并发症。流产后如果过早有频繁的无屏障性交,可能使精子抗原易于与生殖道免疫活性细胞发生相互作用,诱导了ASA产生。本研究结果显示,非PCOS不孕组有流产史的妇女没有检出ASA阳性,该组的2例ASA阳性均为原发不孕患者,表明人工流产的规范操作及术后注意避免过早接触精子抗原,不会导致ASA的产生。根据本研究结果,非PCOS不孕组妇女中检测出2例(2.2%)ASA阳性,此外,3组妇女均有个别标本显示ASA弱阳性,提示不论机体免疫状态如何,性交行为的存在使妇女均有被精子抗原致敏的可能性[6]。因此,ASA作为引起女性免疫不孕的常见因素,在不孕妇女的常规检测中仍是必要的。 综上所述,ASA不是介导肥胖型及非肥胖型PCOS妇女生育力下降的主要因素。但PCOS妇女机体的免疫功能紊乱,特别对于肥胖型患者,慢性炎症可能促使其它潜在的免疫因素共同参与PCOS不孕的致病机制,今后需加强相关的研究。2 方法
3 统计学处理
结 果
1 3组患者一般资料的比较
2 3组患者血清ASA水平的比较

讨 论
