CART肽抑制缺血再灌注小鼠脑组织水通道蛋白4表达并减轻脑水肿*
2018-08-27傅兴宁刘丽冰张志杰祝世功
傅兴宁, 刘丽冰, 张志杰, 师 婷, 祝世功
(1潍坊市益都中心医院, 山东 青州 262500;2山西医科学大学汾阳学院,山西 汾阳 032200;3北京大学医学部基础医学院, 北京 100191)
可卡因及苯丙胺调节转录物(cocaine- and amphetamine-regulated transcript,CART)肽是一种神经内分泌活性肽,因其mRNA表达可受可卡因和苯丙胺调节而得名[1]。CART肽在人体内参与多种生理过程[2-3],例如摄食、能量平衡、内分泌和睡眠、肥胖、糖尿病、焦虑,应激及药物依赖等。近年来,越来越多的研究发现CART肽具有神经保护作用,我们的前期工作证实CART肽可抑制缺血再灌注诱导的内质网应激,从而减轻神经元损伤[4];CART肽可以通过上调脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)促进海马神经元的存活[5];CART肽抑制N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)诱导的海马神经元凋亡[6]。Jia等[7]报道,CART肽可通过激活细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路而减轻脑缺血再灌注引起的神经元损伤;Sha等[8]报道,CART肽可增加线粒体呼吸链复合物II活性,从而抑制糖氧剥夺诱导的神经元损伤。
脑缺血再灌注损伤常见于缺血性血管疾病,具有严重后果和社会危害。脑水肿是脑缺血后引起死亡的最主要并发症,大量严重中风的病人死于脑水肿。脑水肿及其引起的高颅内压挤压脑的重要区域,并导致脑神经细胞的二次损伤[9]。目前已知,水通道蛋白4(aquaporin 4,AQP-4)和血脑屏障(blood-brain barrier,BBB)完整性与脑水肿的形成密切相关[10]。AQP-4在脑内高表达,主要分布于脑微血管周围星形胶质细胞的终足和室管膜细胞上,具有保持脑内水平衡的作用[11]。有研究报道,脑缺血再灌注损伤模型中,AQP-4的表达增多并加重脑水肿[12]。然而,CART肽是否对AQP-4具有作用,尚未见研究报道。我们推断CART肽减轻脑缺血再灌注损伤而发挥神经保护的作用机制可能与AQP-4及血脑屏障通透性有关。本实验采用小鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型进行了研究。
材 料 和 方 法
1 实验动物和分组
清洁级雄性ICR小鼠(25~28 g),购于北京大学医学部实验动物中心,许可证号为SYXK(京)2016-0041。室温下每天光照 12 h, 黑暗 12 h,自由饮食水。将动物随机分为假手术(sham)组、缺血(MCAO)组和CART肽(CART)组。CART组在脑缺血2 h后经尾静脉给予CART肽(2.5 μg/kg)处理,其它2组尾静脉给予等量生理盐水。
2 实验方法
2.1MCAO动物模型的制作[13]动物术前禁食禁水12 h,手术时室温控制在大约25 ℃左右。 将小鼠以10%水合氯醛(35 mg/kg)腹腔注射进行麻醉。仰卧位固定于操作台上,备皮后做颈部正中切口,暴露出左侧颈总动脉、颈内动脉和颈外动脉。将颈总动脉夹闭,并将颈外动脉和颈内动脉结扎。将颈外动脉由近心端剪断,将预先用硅橡胶漆及肝素处理过的头端约0.15 mm的鱼线由颈外动脉缺口处插入,松开颈内动脉,将鱼线经过颈内动脉插入颅内,直到插入颈内动脉约(10±1)mm,感觉有轻微阻力时停止。将鱼线从颈内动脉上扎紧固定,消毒后缝合皮肤。2 h后将栓线拔出,恢复其再灌注。麻醉清醒后观察其行为学,若出现对侧前肢运动障碍及同侧Horner氏综合征则判为模型建立成功。假手术组条件同上,线栓进入长度约5 mm。
2.2脑梗死及脑水肿体积测定 脑梗死体积测量参照贾增强等[14]的方法,脑水肿体积测量方法参照Panahpour等[15]的方法。再灌注22 h后,将各组动物处死,取脑并将脑组织置于-20 ℃冰冻5 min,然后用刀片将脑组织由前向后冠状切成2 mm的组织片。将组织片浸泡于0.5% 2,3,5-三苯基氯化四氮唑(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)磷酸缓冲液中,37 ℃避光孵育15~20 min,然后用4%多聚甲醛溶液固定。梗死及水肿体积的百分比计算公式如下:梗死百分比(%)=(右侧半球体积-左侧半球未梗死体积)/右侧半球体积×100%,脑水肿百分比(%)=(左侧半球体积-右侧半球体积)/右侧半球体积×100%。
2.3脑组织中水含量的测定 参照Panahpour等[15]的方法,再灌注22 h后,将各组动物处死,取脑并将左右半球分离。分别称量左右半球的湿重,然后将脑组织置于80 ℃干燥烤箱中烘烤24 h。将脑组织取出后立即称量各半球的干重,然后按照以下公式进行计算:脑组织含水量(%)=(湿重-干重)/湿重×100%。得到各半球脑组织水含量后,再分别将同一只动物的左侧半球脑组织水含量除以右侧半球脑组织水含量,得到半球脑组织水含量之比。
2.4脑组织伊文思蓝(Evans blue)漏出率测定 方法同前人所述[16],动物再灌注18 h后,通过尾静脉向小鼠体内注射100 μL 2%伊文思蓝溶液,并循环4 h。将小鼠麻醉后,开胸暴露心脏,经左心室至升主动脉插管,用足量的生理盐水快速灌流,直至剪开的右心耳处流出清澈液体为止。取脑并将左右半球分离,称量各半球湿重,然后将各半球脑组织置于500 μL 二甲基甲酰胺中,匀浆,避光处理,60 ℃水浴24 h,12 000 r/min离心15 min,取上清液在635 nm测定吸光度(A)值,根据标准曲线求得上清液中伊文思蓝的浓度,进而得到各半球中伊文思蓝的总含量。将各半球中伊文思蓝的总含量除以半球湿重得到左右两侧脑半球组织中伊文思蓝浓度。
2.5免疫荧光观察AQP-4表达变化 再灌注22 h后,将各组动物处死,4%多聚甲醛灌流固定后取脑,常规制作10 μm冰冻切片,5% BSA室温封闭30 min,加兔抗AQP-4抗体(1 ∶400,Santa Cruz),4 ℃过夜,次日在暗室中加入山羊抗兔的荧光Ⅱ抗,室温孵育2 h后盖上盖玻片在荧光显微镜下观察脑皮质半影区。
2.6Western blot检测AQP-4的表达水平 各组小鼠取脑后分离出缺血侧半球脑皮质,加入RIPA裂解液(碧云天),电动匀浆器匀浆,12 000 r/min,4 ℃离心30 min;取上清,BCA法(Thermo Fisher Scientific)定量蛋白浓度;10% SDS-PAGE分离蛋白,湿法转膜;5%脱脂牛奶封闭1 h,加入兔抗AQP-4抗体(Santa Cruz)和β-action抗体(CST),4 ℃过夜;加入HRP标记的Ⅱ抗(中杉金桥),ECL试剂盒显色检测蛋白条带。采用Quantity One软件进行图像灰度值分析,以β-action灰度值作为内参照。
3 统计学处理
以GraphPad Prism 5.0软件分析作图。所有实验结果以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 CART肽减少脑缺血再灌注后的脑水肿和梗死体积
经过缺血2 h及再灌注22 h,脑梗死体积TTC染色结果见图1A。与缺血组比较,CART肽明显减轻了脑梗死体积百分比(P<0.01),见图1B。同时,CART肽明显降低了脑水肿体积百分比(P<0.01),见图1C。
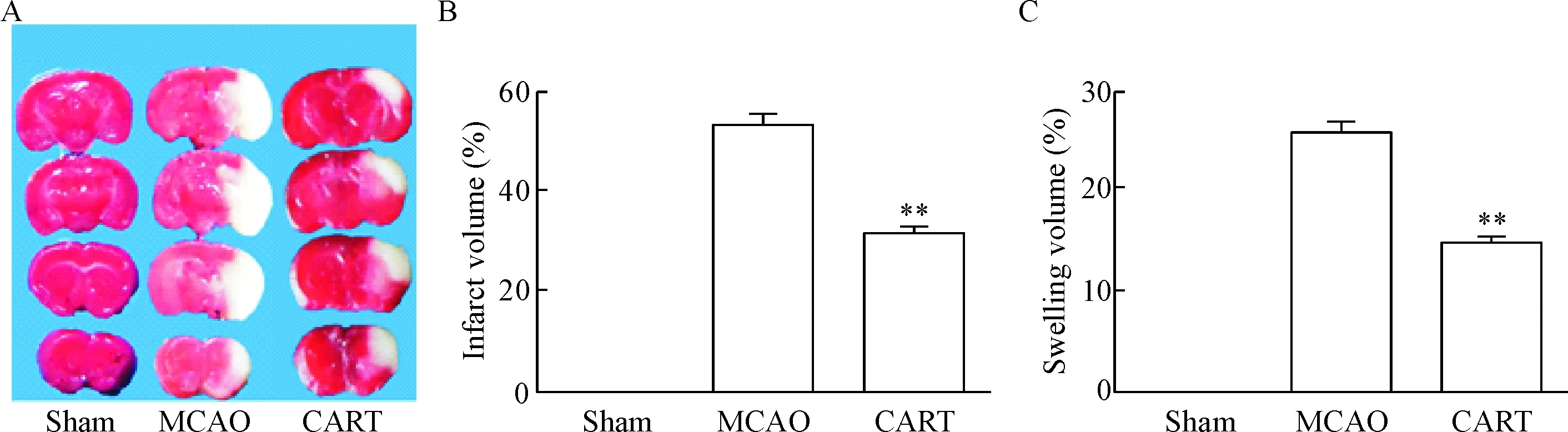
Figure 1. The effect of CART peptide on the infarct volume and swelling volume in the mice after cerebral ischemia/reperfusion. A: TTC staining; B: infarct volume; C: swelling volume. Mean±SD.n=4.** P<0.01vsMCAO group.
2 CART肽可明显减轻脑缺血再灌注后脑水含量
与假手术组相比,缺血组中左侧半球脑水含量明显增加(P<0.01);CART肽处理后,左侧半球脑水含量明显降低(P<0.01)。假手术组、缺血组和CART组中,右侧半球的脑水含量差异不大,见图2。
3 CART肽可降低脑缺血再灌注后血脑屏障的破坏程度
为检验脑缺血后血脑屏障的完整程度,我们检测了伊文思蓝的漏出率。与假手术组相比,缺血组左侧脑半球伊文思蓝的组织含量明显升高(P<0.01);CART肽处理则明显减轻了这种升高(P<0.05)。假手术组、缺血组和CART组中,右侧脑半球伊文思蓝含量差异并不大,见图3。
4 CART肽抑制脑缺血再灌注后小鼠脑组织AQP-4表达的上调
免疫荧光观察半影区发现AQP-4阳性表达主要分布于脑微血管周围。肉眼观测MCAO组大脑皮层AQP-4阳性表达的微血管亮度高于sham组,而CART处理组相同脑区中AQP-4阳性表达的微血管亮度不及MCAO组,见图4。

Figure 2. The effects of CART peptide on the water content in the brain tissue of the mice after cerebral ischemia/reperfusion. Mean±SD.n=4.##P<0.01vssham group;** P<0.01vsMCAO group.
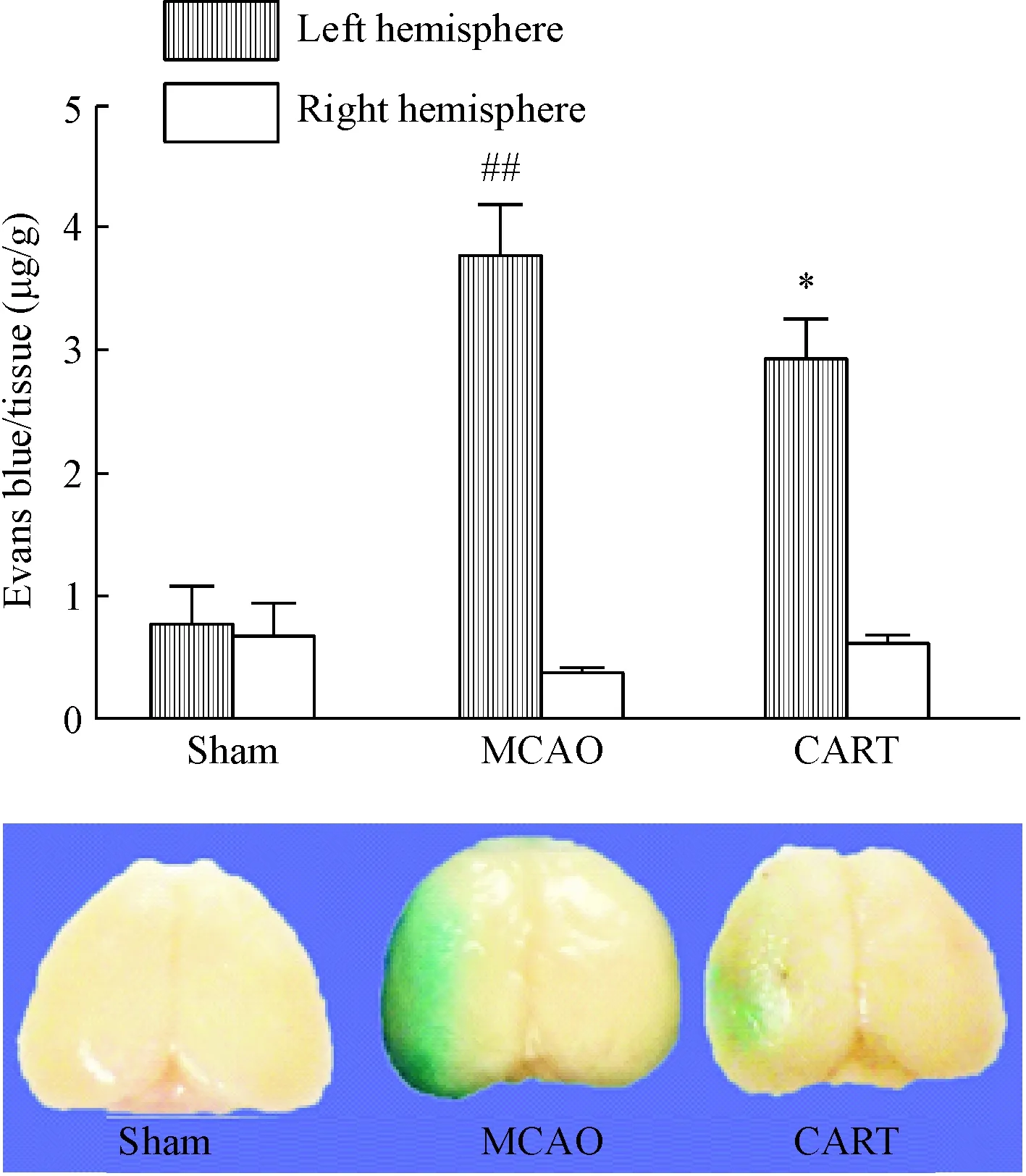
Figure 3. The effects of CART peptide on the Evens blue leakage after cerebral ischemia/reperfusion in mice. Mean±SD.n=4.##P<0.01vssham group;*P<0.05vsMCAO group.
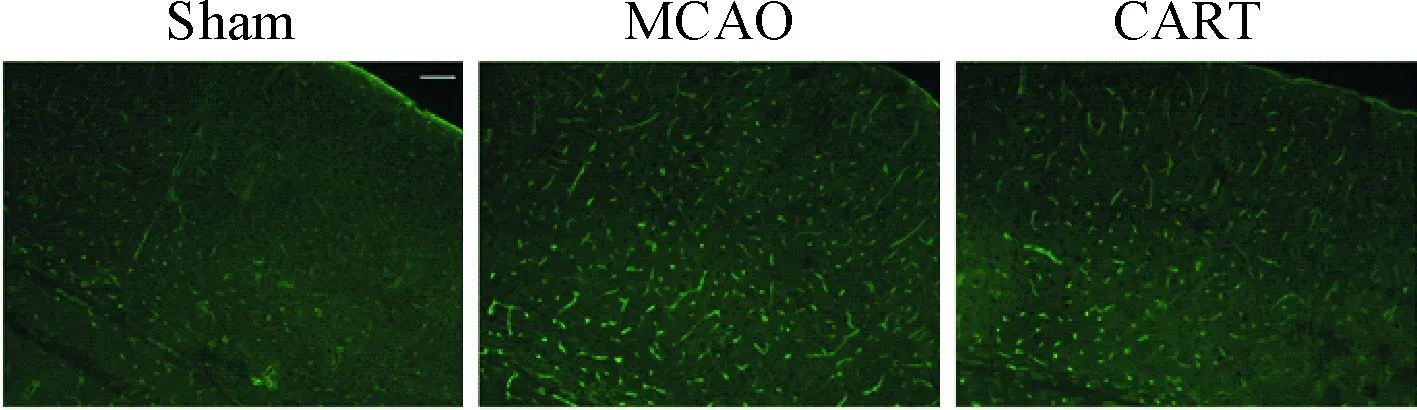
Figure 4. The effect of CART on the expression of AQP-4 in mice cortex after cerebral ischemia/reperfusion detected by immunohistochemistry staining (×200).
Western blot检测半影区AQP-4表达,sham组的脑组织有一定量慢性表达, MCAO组脑组织中的AQP-4表达水平明显升高(P<0.05),而给予CART肽处理后,脑组织中AQP-4表达较MCAO组明显减少(P<0.05),见图5。
讨 论
缺血性脑血管疾病目前是临床上一类常见的疾病,具有高致死、高致残及并发症难以治愈等特点[17]。脑缺血引起脑功能障碍的主要原因是脑水肿和脑细胞坏死,脑水肿作为脑缺血后最严重的并发症,是目前导致缺血性脑卒中患者死亡的最主要原因。由于脑细胞坏死是不可逆的,因而防治脑水肿是临床上治疗的重点。脑梗塞后脑水肿有细胞毒性脑水肿和血管源性脑水肿2类。细胞毒性脑水肿,主要见于多种原因引起的急性缺氧如心跳骤停、窒息和脑循环中断,此类脑水肿的微血管通透性不增高;血管源性脑水肿为最常见的一种,见于脑外伤、脑梗塞和血栓形成等,主要特点是脑微血管通透性增高,血脑屏障完整性被破坏。
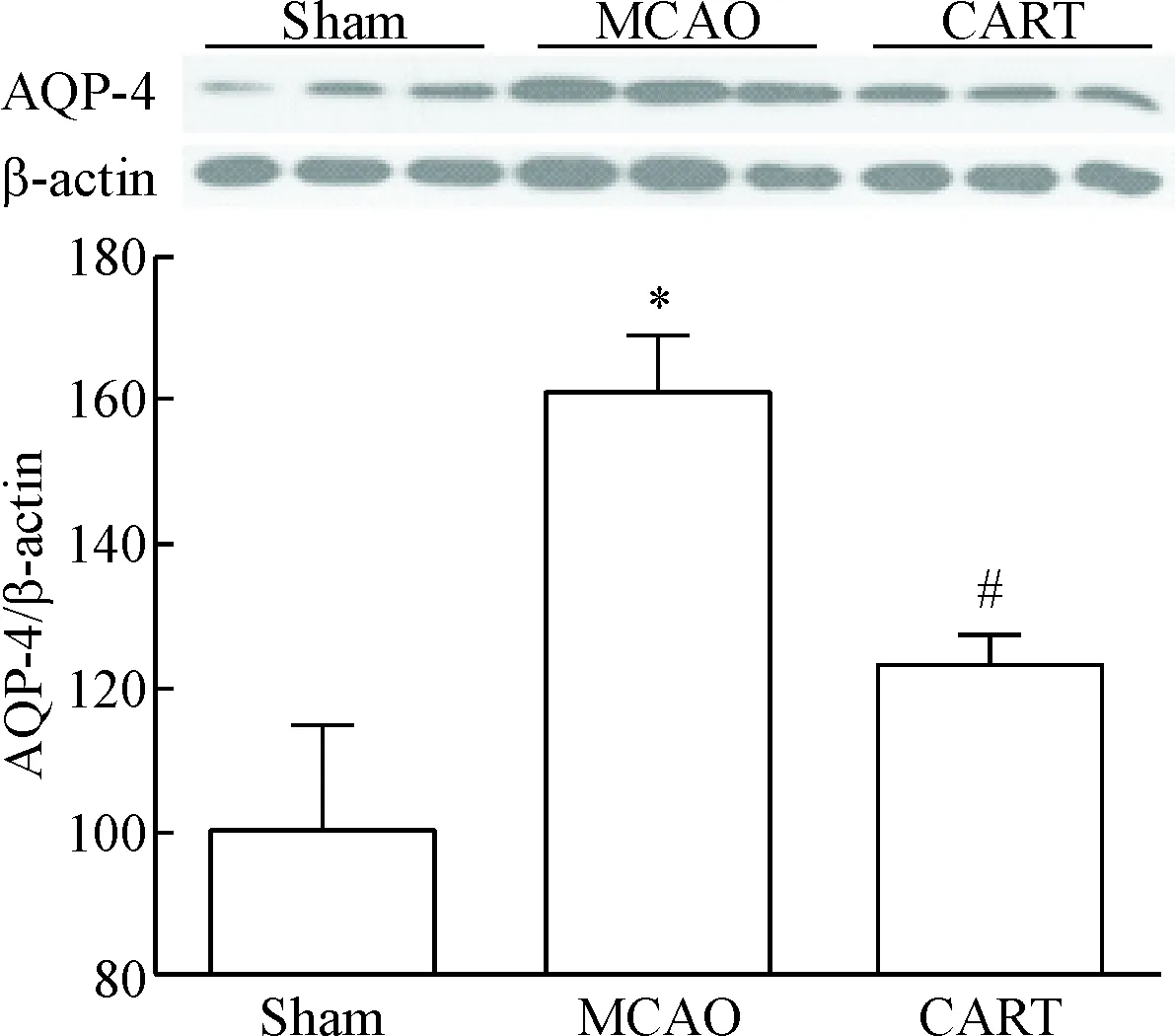
Figure 5. The effect of CART peptide on the expression of AQP-4 in mouse cortex after cerebral ischemia/reperfusion detected by Western blot. Mean±SD.n=4.*P<0.05vssham group;#P<0.05vsMCAO group.
CART肽是近些年新发现的内源性活性肽。虽然其受体至今尚未鉴定成功,但其广泛的生物学作用,以及与临床疾病的关系研究已积累的不少资料,近年来其神经保护作用和临床意义受到关注。我们的前期工作证实CART肽具有神经营养作用,并可以通过上调BDNF保护海马神经元的存活,抑制内质网应激减轻脑缺血再灌注引起的神经元凋亡[4-6];Jia等[7]报道,CART肽可通过激活ERK通路而减轻脑缺血再灌注引起的神经元损伤。这些神经保护保护作用研究主要集中于对脑缺血后损伤的神经元本身的保护,而对脑缺血引起的脑功能相关的血脑屏障,颅内压及脑水肿的作用缺乏研究。本实验结果证明了我们的推断,给予脑缺血再灌注损伤小鼠CART肽,能够明显减小脑的梗死体积及水肿体积,减少缺血侧脑内脑水含量。这说明CART肽在缺血再灌注的急性期不仅可以减小梗死体积,缓解症状,还可以减轻颅脑体积的增大,降低颅内压,减轻发生颅脑挤压对神经元的损伤。
缺血后脑水肿的形成机制目前还不是很清楚,现代医学认为其发生发展过程涉及多种学说,如自由基学说,兴奋性氨基酸学说、脑微循环和血脑屏障学说等。AQP-4作为水通道家族成员,其在脑内含量最多,主要分布于脑微血管周围星形胶质细胞的终足和室管膜细胞上,被公认与脑水肿的形成具有重要关系[18],有研究报道,在脑缺血再灌注损伤模型中,AQP- 4的表达增多并加重脑水肿[19]。在本实验中,我们通过免疫荧光观察及Western blot定量检测发现,AQP-4主要是伴随血管表达,给予CART肽处理后明显抑制了脑缺血引起AQP-4高表达,同时CART也抑制脑缺血引起的血脑屏障通透性增高。这说明CART肽可能通过对AQP-4的抑制作用,减轻脑缺血引起的血脑屏障的破坏和通透性增加,进而减轻脑水肿程度。这提示AQP-4可能是CART肽减轻脑缺血再灌注损伤的重要作用靶分子。而CART肽抑制AQP-4表达的详细分子机制,尚有待今后进一步深入探讨。
