重组法国梧桐花粉过敏原2(rPla a2)对诱导型一氧化氮合酶(NOS2)基因启动子活性及基因表达的影响①
2018-08-24乔笑芹王进雅周国平
乔笑芹 王进雅 路 康 曹 倩 周国平
(南京医科大学第一附属医院儿科,南京 210029)
哮喘是一种以可变的气道阻塞、气道高反应性和气道重塑为特征的慢性变态反应性炎症性疾病[1,2],其发病机制较为复杂,主要与遗传、过敏原及环境因素相关[3-5]。其中花粉过敏原是过敏性哮喘及变应性鼻炎发病的主要危险因素之一[6]。悬铃木(Platanus acerifolia,Pla)即法国梧桐作为南京、上海等国内多个大城市的常见绿化树木,其花粉过敏原为一种气传过敏原,悬铃木花粉过敏原2(Pla a2)经纯化、克隆证实与过敏性哮喘、变应性鼻炎及皮炎等变态反应性疾病发作密切相关[7,8]。
哮喘患者的呼出气体中一氧化氮含量(FeNO)显著增高[9-12],流行病学资料显示FeNO水平能预测新发哮喘及儿童哮喘的风险[13,14],有研究证实在近50%的哮喘儿童中FeNO水平可作为独立的呼吸道炎症指标[15]。呼出气体中的一氧化氮(NO)主要在感染、过敏原刺激等病理条件下由诱导型一氧化氮合酶(NOS2)合成[16-18],可见NOS2基因的表达水平是哮喘发病的重要因素,抑制NOS2表达及抑制大量NO的产生对哮喘治疗有重要意义,研究吸入性植物过敏原对NOS2基因的调控作用,以期为哮喘治疗提供新思路。且NOS2表达后会产生大量NO,不受细胞内钙离子浓度的调节[19],提示我们对NOS2调控的研究主要于转录及转录前水平进行。
本研究成功构建含NOS2启动子区的重组报告质粒,利用人胚肾细胞(HEK 293T细胞)进行双荧光素酶活性分析实验,克隆并鉴定NOS2启动子活性、研究rPla a2对NOS2启动子活性的影响;利用人支气管上皮细胞系(Beas-2B细胞)进行实时荧光定量PCR实验,研究rPla a2对人NOS2基因mRNA表达的影响。
1 材料与方法
1.1实验材料与试剂 HEK293T细胞、Beas-2B细胞(美国典型培养物保藏中心(American Type Culture Collection,ATCC);感受态大肠杆菌E.coli DH5α、重组法国梧桐花粉过敏原rPla a2为本院国家生殖医学中心重点实验室保存;高糖DMEM细胞培养基(Hyclone公司,美国);胎牛血清、青霉素、链霉素(杭州四季青生物技术有限公司);限制性内切酶Mlu Ⅰ和XhoⅠ、T4DNA连接酶(Thermo公司,美国);切胶回收纯化试剂盒、质粒提取试剂盒(Omega公司,美国);基因组DNA提取试剂盒TIANamp Genomic DNA kit(天根生化公司,北京);转染试剂LipofectamineTM3000、RNA提取试剂TRIzol(Invitrogen公司,美国);双萤光素酶活性检测试剂盒、双萤光素酶报告基因分析检测质粒pGL3-Basic、内参报告基因质粒pRL-TK(Promega公司,美国);发光光度计ModulusTMLuminometer仪(TURN-ER Biosystems公司,美国);DNA Marker、PrimeSTAR系列高保真酶、Prime Script RT系列逆转录试剂、实时定量PCR试剂盒(TaKaRa公司,日本)。
1.2方法
1.2.1细胞培养 HEK293T细胞和Beas-2B细胞均采用高糖DMEM培养基培养,培养基中血清和双抗含量分别为:胎牛血清100 ml/L、青霉素100 U/ml、链霉素100 μg/ml,培养箱条件设置为37℃,5%CO2。
1.2.2重组报告质粒的构建与鉴定 ①引物设计:根据美国国立生物技术中心数据库NCBI获得人NOS2序列,据GenBank中NOS2的转录起始位点上游1 000 bp,用Primer5.0设计引物,上下游引物分别引入限制性内切酶Mlu Ⅰ和XhoⅠ酶切位点,NOS2-F为5′-CGACGCGTGAGCTTCAGAGTTCGAG-ACC-3′,NOS2-R为5′-CCGCTCGAGAGCCTCAGTT-TTCGACTCGC-3′,(下划线为酶切保护碱基和酶切位点),实时荧光定量PCR引物为:NOS2上游引物5′-ATGGCCTGTCCTTGGAAATT-3′,下游引物5′-TCAGAGCGCTGACATCTCCA-3′,引物合成与测序由上海英骏公司完成。②PCR扩增:以人类基因组DNA(用TIANamp Genomic DNA kit 提取人Beas-2B细胞总DNA)为模板,按照PrimeSTAR说明书配制高保真酶体系进行PCR扩增,反应条件为98℃ 10 s,60℃ 15 s,68℃ 1 min,循环35次。用1%的琼脂糖凝胶对扩增产物进行电泳检测。③NOS2重组报告质粒的构建与鉴定:用胶回收试剂盒回收琼脂糖电泳产物。回收产物与pGL3-Basic载体均用限制性内切酶MluⅠ、XhoⅠ以37℃水浴1 h进行双酶切,酶切产物用切胶回收纯化试剂盒纯化。纯化后的产物与纯化后的pGL3-Basic载体以T4连接酶在37℃连接30 min。将连接产物转化至大肠杆菌E.coli DH5α中,转化条件为:4℃ 冰盒 3 min,42℃ 水浴 1 min 20 s,4℃ 冰盒30 min。取转化好的菌液加入1 ml不含氨苄青霉素的LB培养液置于37℃摇床倒置扩增50 min,将扩增好的菌液涂至含有氨苄青霉素的固体LB培养板于培养箱倒置培养16 h,培养箱条件设置为:37℃,5%CO2。在长出菌落的LB板上挑取单克隆菌落加入含有氨苄青霉素的LB培养液中于37℃摇床倒置扩增3 h,以扩增后的菌液为模板进行PCR扩增,PCR反应条件及所用高保真酶同前。用1%琼脂糖凝胶对PCR产物进行电泳25 min,选取阳性条带菌液进行测序,将经测序鉴定正确的菌液加入含氨苄青霉素的LB培养液中于37℃摇床扩增12~16 h,扩增后的菌液用质粒提取试剂盒提取含有目的片段的质粒。
1.2.3瞬时转染 在细胞生长对数期按照(1.5~2.0)×105个/ml细胞数接种铺板,HEK293T细胞接种于96孔板、Beas-2B细胞接种于6孔板中,培养板中细胞培养基均为含100 ml/L胎牛血清而不含双抗的高糖DMEM培养基。当HEK293T细胞融合度约为80%时,将pGL3-Basic载体(100 ng)、pRL-TK质粒(4 ng)、NOS2重组报告质粒(100 ng)按 LipofectamineTM3000说明书进行转染。培养24 h后收集细胞,检测荧光素酶活性。为检测rPla a2对NOS2启动子活性的影响,将pGL3-Basic(100 ng)、pRL-TK(4 ng)和重组NOS2质粒(100 ng)按照LipofectamineTM3000说明书转染HEK293T细胞 24 h,予rPla a2刺激24 h后收集细胞,进行荧光素酶检测。每组3复孔,重复3次独立实验。细胞培养条件均为:37℃,5%CO2。
1.2.4双荧光素酶活性检测 收集96孔培养板中的HEK293T细胞,弃去原培养基,加入1×磷酸缓冲盐溶液(Phosphate buffer saline,PBS)洗净培养基,弃去PBS加入1×裂解缓冲液(Passive lysis buffer,PLB),室温振荡30 min充分裂解细胞。按照双萤光素酶活性检测试剂盒说明书每孔取20 μl裂解液分别加入20 μl的底物缓冲液和20 μl终止缓冲液,混合后分别测定萤火虫荧光值(A)和海肾荧光值(B);相对萤光素酶活性单位(RLU)即荧光活性比值(A/B)与报告基因启动子活性呈正相关。
1.2.5实时定量PCR检测Beas-2B细胞NOS2 mRNA水平相对表达量 当Beas-2B细胞融合度为70%时,加入不同浓度(0、1、5、10 μg/ml)的 rPla a2刺激24 h后收集细胞,用Trizol法提取总RNA,用Prime Script RT Master Mix Perfect Real Time Kit系列逆转录试剂将RNA逆转录为cDNA,用实时定量PCR试剂盒进行qPCR扩增,扩增模板为该cDNA。qPCR扩增条件为:94℃预变性5 min;90℃ 变性15 s,60℃退火15 s,72℃延伸 1 min,循环40次;72℃ 延伸5 min。反应仪器为Step One Plus Quantitative Real-time PCR System。记录各反应孔对应CT值以计算mRNA相对表达量。内参基因为GAPDH,目的基因为人NOS2,NOS2 mRNA的相对表达量(2-ΔΔCt)=NOS2 mRNA拷贝数/GAPDH mRNA拷贝数;ΔΔCt=(Ct刺激组NOS2-Ct刺激组GAPDH)-(Ct对照组NOS2-Ct对照组GAPDH)。设对照组mRNA相对表达量为1。重复3次独立实验。
1.3统计学处理 对实验数据应用SPSS20.0软件进行统计学分析,组间比较采用独立样本t检验,多组比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1NOS2重组报告质粒构建 以人类基因组DNA(正常人支气管上皮细胞,Beas-2B细胞总DNA)为模板,用NOS2上下游引物进行PCR扩增,用1%琼脂糖凝胶对产物进行电泳检测,成功扩增出NOS2基因启动子片段,大小约为1 000 bp,与目的基因大小相符。经切胶回收、纯化、双酶切后将目的片段与pGL3-Basic载体连接后转化至感受态大肠杆菌E.coli DH5α中培养,挑选单克隆菌落进行PCR鉴定,可见阳性克隆大小约为1 000 bp,与目的基因大小相符(图1)。将此4个阳性克隆进行测序,结果与NCBI参考序列一致,将构建成功的重组质粒用限制性内切酶MluⅠ、XhoⅠ进行双酶切鉴定,可见到pGL3-Basic载体片段(4 818 bp)和NOS2启动子片段(1 000 bp)(图2),说明含NOS2启动子的质粒构建成功。
2.2双荧光素酶活性检测 将pGL3-Basic载体(100 ng)、pRL-TK质粒(4 ng)和重组NOS2质粒(100 ng)转染HEK293T细胞,24 h后检测相对荧光强度,结果(图3)可见重组质粒转染组荧光素酶活性显著增高,与pGL3-Basic转染组相比差异有统计学意义(P<0.05),说明所构建质粒有启动子活性。将pGL3-Basic载体(100 ng)、pRL-TK(4 ng)和重组NOS2质粒(100 ng) 转染HEK293T细胞,转染24 h后加入rPla a2刺激,刺激满24 h后收集细胞,检测相对荧光强度(图4)可见rPla a2显著增强NOS2启动子活性,与不加刺激组(NOS2)相比,NOS2启动子活性增加358%,差异有统计学意义(P<0.05)。
图1 DNA 2000 Marker及菌落PCR产物 Fig.1 DNA 2000 Marker and E.coli-PCR productNote:M.DNA 2000 Marker;1-4.E.coli-PCR product.
图2 含NOS2 的重组质粒双酶切产物Fig.2 Enzyme-digested product of NOS2 recombin-tion plasmidNote:M.DNA 5000 Marker.

图3 NOS2启动子重组报告质粒荧光素酶活性Fig.3 NOS2 reporter plasmid promoter activityNote:***.P<0.001 vs pGL3-Basic.
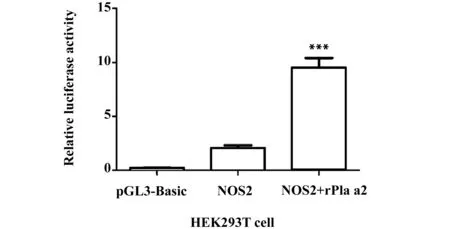
图4 rPla a2增加NOS2启动子重组报告质粒荧光素酶活性Fig.4 rPla a2 promoted NOS2 reporter plasmid promoter activityNote:***.P<0.001 vs NOS2.
2.3实时定量PCR检测Beas-2B细胞NOS2 mRNA水平 在Beas-2B细胞进行实时荧光定量PCR检测rPla a2对人NOS2 mRNA表达的影响,设置不同浓度rPla a2(0、1、5、10 μg/ml)分别刺激Beas-2B 细胞,24 h后收集细胞,Trizol法提取Beas-2B细胞总RNA并逆转录为cDNA,进行实时荧光定量PCR检测人NOS2 mRNA相对表达量,结果(图5)显示,与对照组(rPla a2 0 μg/ml)相比,加rPla a2刺激组mRNA表达量显著升高,多组单因素方差分析P<0.05,差异有统计学意义,证明rPla a2上调NOS2 mRNA的表达。其中当rPla a2刺激浓度为10 μg/ml时NOS2 mRNA相对表达量升高最显著,但是组间独立样本t检验P>0.05,差异无统计学意义。

图5 rPla a2上调NOS2 mRNA相对表达水平Fig.5 rPla a2 induced mRNA expression of NOS2Note:***.P<0.001 vs 0 μg/ml rPla a2.
3 讨论
目前国内外已有大量研究证实NOS2基因在哮喘的发病与发展中起重要作用,但多数传统观点认为其主要通过2型辅助细胞(Th2)因子如IL-13[20]、感染产物如LPS[21]等刺激发挥作用,与以往研究不同,本研究是以气传过敏原rPla a2为刺激条件,探讨NOS2基因在过敏性条件刺激下相对表达情况,本研究发现重组法国梧桐花粉过敏原rPla a2可上调人支气管上皮细胞系Beas-2B细胞中NOS2基因的mRNA相对表达水平。以上结果为后续进一步深入研究气传过敏原对NOS2基因的转录调控机制打下基础,并丰富了NOS2基因在哮喘发病中的作用机制,同时也为后续进一步研究过敏原致哮喘发病机制提供了新的研究方向。
NOS2基因定位于染色体17q11.2,编码区约43 733 bp,共27个外显子,所编码的蛋白质由1 153个氨基酸组成。启动子为基因的重要组成部分,是位于基因5′-端上游区域的一段DNA序列,其主要功能是结合转录因子从而在转录或转录后水平调控基因的表达。因此分析启动子的活性有助于明确基因转录调控的具体机制,本研究成功构建了人NOS2基因启动子区重组报告质粒,并利用双荧光素酶活性分析法在HEK293T细胞证实了NOS2启动子活性。本研究发现重组法国梧桐花粉过敏原rPla a2可增强人NOS2基因启动子活性,该结果提示花粉过敏原可能通过转录因子与NOS2基因启动子结合从而上调NOS2基因转录表达,产生过量NO从而致哮喘发病。本课题组后期通过Genomatix及JASPAR等生物信息学方法预测NOS2启动子区存在GATA3、STAT6、NF-κB、IRF-1等多个潜在转录因子结合序列,相关文献报道发现GATA3、STAT6、NF-κB、IRF-1等转录因子在哮喘的发生发展中也起重要作用[22-24]。本研究尚浅显,接下来还需在体内外试验中进一步研究rPla a2 对NOS2基因的转录调控是否有其他关键转录因子参与,本研究为后续吸入性过敏原及人NOS2基因的深入研究提供一定基础。
目前国内外已有关于法国梧桐花粉过敏原Pla a1、 Pla a2与过敏性疾病相关的报道[25,26],但仍较少见,关于重组法国梧桐花粉过敏原rPla a2对NOS2基因的影响尚未见报道,亦未见有关于rPla a2对NOS2基因启动子转录活性调控的相关研究。本研究首次发现rPla a2在启动子水平以及转录水平均可影响NOS2基因的转录调控。在启动子水平,rPla a2增强人NOS2基因的启动子活性;在转录水平,rPla a2上调NOS2基因mRNA的表达。以上结果提示我们:吸入性植物过敏原可能通过调控NOS2基因诱发过敏性哮喘发病,这为过敏性哮喘脱敏治疗提供新思路,未来亦可能为其他临床变应性疾病的预防与治疗提供新靶点。
