抑制或过表达GRK5基因对星形胶质细胞凋亡及IL-1β和TNF-α表达的影响
2018-08-24贾蕾史娟
贾 蕾 史 娟
(延安大学附属医院神经内科,延安 716000)
星形胶质细胞(Astrocyte,AS)是中枢神经系统中主要的一种神经胶质细胞,在神经胶质细胞中占的体积最大,参与多种疾病的病理过程[1]。有研究发现,缺氧可引起脑损伤,并可使AS活性及增殖明显增强,抑制AS的活化可明显提高围产期脑损伤预后[2,3],这提示AS在脑损伤中的重要作用。G蛋白偶联受体激酶5(G-protein-coupled receptor kinase 5,GRK5)是一类丝苏氨酸激酶,是GRK家族中的一员,在动物体内分布广泛,有研究发现,GRK5在体内缺陷可增加阿尔茨海默病动物海马内的病理改变,可增加小鼠脑内的β-淀粉样蛋白的生成[4,5];GRK5表达沉默可引起AS的活化,而正常表达可抑制AS活化相关的氧化应激及炎症反应[6],但GRK5对AS凋亡及机制研究的还未清楚。因此,本研究通过抑制或过表达GRK5,检测其对AS凋亡及L-1β和TNF-α表达的影响,并进一步研究诱导凋亡的机制。
1 材料与方法
1.1主要试剂和仪器 DMEM培养基购自美国Sigma;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙锭(PI)细胞凋亡试剂盒及流式细胞仪均购自美国BD公司;RT-PCR试剂盒上海生工;GRK5、p53、STAT3和磷酸化的信号转导与转录因子3(Phosphorylated signal transducers and activators of transcription 3,p-STAT3)抗体均购自美国ABcam公司。
1.2方法
1.2.1实验动物及AS培养 出生3 d内的SPF级SD大鼠,雌雄不限,购自延安大学医学院;无菌条件下取出大鼠大脑皮质,通过机械吹打分散细胞,逐步取上清液中的单细胞,离心,获取沉淀,DMEM培养液(含胎牛血清)吹打使之成为单细胞悬液(锥虫蓝计数细胞存活率为90%),以不低于105/cm2密度接种细胞于涂有多聚赖氨酸的培养瓶中,置于含5%体积分数的CO2培养箱中在37℃条件下培养,细胞长满瓶底时用胰酶消化后传代,传代3次即可得到纯化的AS,AS的鉴定采用间接免疫荧光法检测GFAP,GFAP是阳性细胞即为AS,免疫荧光染色显示AS阳性率达95%左右。
1.2.2抑制或过表达GRK5转染AS 参照脂质体LipofectamineTM2000转染说明分别将干扰GRK5表达的siRNA(GRK5-siRNA)及GRK5的过表达质粒(pcDNA3.1-GRK5)分别转染AS,并同时转染阴性对照组(NC-siRNA)及pcDNA3.1组,细胞不经特殊处理的为空白对照组,收集转染24 h的细胞用于实验研究。
1.2.3Western blot 细胞中加入按照1∶100混合的PMSF溶液和RIPA裂解液提取总蛋白,BCA蛋白定量试剂盒测定蛋白浓度,取适量蛋白样品行SDS-PAGE,转膜、封闭后孵育一抗,其中GRK5、p53、STAT3和p-STAT3抗体按照1∶500稀释,内参GAPDH按照1∶1 000稀释,洗膜后孵育HRP标记的羊抗兔二抗(1∶10 000稀释),常温孵育1 h,洗膜,ECL工作液显色,暗室中显影定量。
1.2.4细胞凋亡检测 细胞分为四组:(1)对照组:培养的AS无任何处理;(2)缺氧组:细胞在1%的O2、5%的CO2及94%的N2混合气体中培养24 h;(3)缺氧+pcDNA3.1-GRK5组:在缺氧处理前24 h 加入pcDNA3.1-GRK5;(4)缺氧+GRK5-siRNA组:在缺氧处理前24 h加入GRK5-siRNA。各组细胞处理至规定时间后利用Annexin V-FITC/PI标记,通过流式细胞仪检测凋亡率。具体步骤参照试剂盒说明。
1.2.5活性氧簇(Reactive oxygen species,ROS)含量检测 收集已处理至规定时间的各组细胞,加入PBS洗涤,胰蛋白酶消化,离心弃上清,加入1 ml的2′,7′-二氯二氢荧光素黄二乙酸酯(DCFH-DA)重悬细胞,37℃避光30 min,再次离心后弃上清,PBS重悬细胞,重复2次此操作,流式细胞仪检测。由于检测的荧光强度与ROS水平呈现出正相关,所以用此可间接反映细胞内的ROS水平。实验重复3次。
1.2.6IL-1β和TNF-α表达检测 提取细胞总RNA,逆转录为cDNA,以cDNA为模板,GAPDH为内参基因,使用20 μl的反应体系通过荧光定量PCR仪进行IL-1β和TNF-α的扩增。其中IL-1β、TNF-α的引物分别为TNF-α:上游引物5′-CCAACAAGGAGGAGAAGTTCC-3′,下游引物5′-CTCTGCTTGGTGGTTTGCTAC-3′;IL-1β:上游引物5′-GGAACCCGTGTCTTCCTAAAG-3′,下游引物5′-CTGACTTGGCAGAGGACAAAG-3′。PCR反应体系为94℃预变性5 min,94℃变性30 s,60℃退火30 s,72℃延伸60 s,72℃终延伸10 min,最后4℃保存。
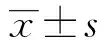
2 结果
2.1GRK5在转染的AS中的表达 将GRK5-siRNA和pcDNA3.1-GRK5分别转染AS,Western blot检测转染后细胞中GRK5蛋白的表达,结果如图1所示,空白组、siRNA-NC组、GRK5-siRNA组、pcDNA3.1-组和pcDNA3.1-GRK5组GRK5的蛋白表达分别为0.215±0.024、0.228±0.026、0.063±0.009、0.220±0.025、0.667±0.068,经单因素方差分析,5组GRK5蛋白的比较差异显著,具有统计学意义(F=118.150,P=0.000),组间两两比较经SNK-q检验,siRNA-NC组和pcDNA3.1组GRK5的表达与空白组差异无统计学意义(P>0.05),GRK5-siRNA组GRK5的表达显著低于空白组(P<0.05),pcDNA3.1-GRK5组GRK5的表达显著高于空白组(P<0.05)。
2.2GRK5对缺氧诱导的AS凋亡的影响 流式细胞仪检测抑制或过表达GRK5对缺氧诱导的AS凋亡的影响,结果如图2所示,空白组、缺氧组、缺氧+pcDNA3.1-GRK5组和缺氧+GRK5-siRNA组的细胞凋亡率分别为(1.25±0.23)%、(4.18±0.56)%、(2.02±0.41)%、(7.63±0.71)%,4组的细胞凋亡率比较差异具有统计学意义(F=94.274,P=0.000);与空白组比较,缺氧组细胞凋亡率显著升高(P<0.05);与缺氧组比较,缺氧+pcDNA3.1-GRK5组细胞凋亡率显著降低(P<0.05),缺氧+GRK5-siRNA组细胞凋亡率显著升高(P<0.05)。
2.3GRK5对缺氧诱导的AS中ROS水平的影响 以流式细胞仪检测的各组细胞的荧光强度衡量细胞内的ROS水平,检测结果如图3所示,空白组、缺氧组、缺氧+pcDNA3.1-GRK5组和缺氧+GRK5-siRNA组ROS水平分别为59.62±4.13、91.38±6.22、70.15±5.16、122.43±7.47,各组ROS水平比较差异具有统计学意义(F=66.676,P=0.000);缺氧组ROS水平显著高于空白组(t=66.676,P=0.000),缺氧+pcDNA3.1-GRK5组ROS水平显著低于缺氧组(P<0.05),缺氧+GRK5-siRNA组ROS水平显著高于缺氧组(P<0.05)。
2.4GRK5对缺氧诱导的AS中IL-1β和TNF-α的mRNA表达的影响 RT-PCR检测各组细胞中IL-1β和TNF-α的mRNA表达,结果如图4所示,空白组、缺氧组、缺氧+pcDNA3.1-GRK5组和缺氧+GRK5-siRNA组IL-1β的表达分别为1、6.785±0.741、3.224±0.554、10.127±1.123;TNF-α的表达分别为1、2.774±0.263、1.262±0.201、5.262±0.687;3组IL-1β的表达和TNF-α的表达比较差异具有统计学意义(F1=50.659,P1=0.000,F2=63.133,P2=0.000);与空白组比较,缺氧组IL-1β和TNF-α的表达均显著升高(P<0.05);与缺氧组比较,缺氧+pcDNA3.1-GRK5组IL-1β和TNF-α的表达均显著降低(P<0.05),缺氧+GRK5-siRNA组IL-1β和TNF-α的表达均显著升高(P<0.05)。
2.5GRK5对缺氧诱导的AS中凋亡蛋白及STAT3信号通路的影响 空白组、缺氧组、缺氧+pcDNA3.1-GRK5组和缺氧+GRK5-siRNA组p53的蛋白表达分别为0.114±0.015、0.292±0.035、0.163±0.018、0.547±0.063;STAT3的蛋白表达分别为0.368±0.042、0.347±0.046、0.350±0.044、0.364±0.048;p-STAT3的蛋白表达分别为0.031±0.007、0.120±0.013、0.053±0.009、0.234±0.031,4组p53蛋白表达和p-STAT3蛋白表达比较差异具有统计学意义(F1=78.478,P1=0.000,F2=79.254,P2=0.000),而4组的STAT3的蛋白表达比较无统计学意义(F=0.157,P=0.922);与空白组比较,缺氧组p53和p-STAT3的蛋白表达均显著升高(P<0.05);与缺氧组比较,缺氧+pcDNA3.1-GRK5组p53和p-STAT3的蛋白表达均显著降低(P<0.05),缺氧+GRK5-siRNA组p53和p-STAT3的蛋白表达均显著升高(P<0.05)。见图5。

图1 GRK5在转染的AS的表达Fig.1 Expression of GRK5 in transfected astrocytesNote:A.Western blot was used to detect the protein expression of GRK5;B.The relative expression of GRK5 protein in the cells of each group;compared with the blank group,*.P<0.05.

图2 GRK5对缺氧诱导的AS凋亡的影响Fig.2 Effect of GRK5 on apoptosis of astrocytes through hypoxia inductionNote:A.Flow cytometry was used to detect the apoptosis rate of each group;B.The rate of apoptosis in each group;compared with the blank group,*.P<0.05;compared with the hypoxia group,#.P<0.05.

图3 GRK5对缺氧诱导的AS中ROS水平的影响Fig.3 Effect of GRK5 on ROS level of astrocytes through hypoxia inductionNote:Compared with the blank group,*.P<0.05;compared with the hypoxia group,#.P<0.05.
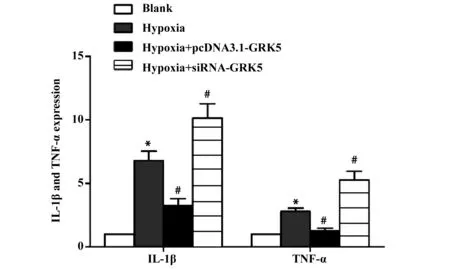
图4 GRK5对缺氧诱导的AS中IL-1β和TNF-α的mRNA表达的影响Fig.4 Effect of GRK5 on IL-1β and TNF-α expression of astrocytes through hypoxia inductionNote:Compared with the blank group,*.P<0.05;compared with the hypoxia group,#.P<0.05.
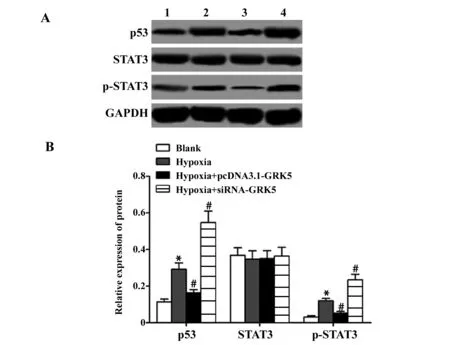
图5 GRK5对缺氧诱导的AS中p53、STAT3及p-STAT3蛋白表达的影响Fig.5 Effect of GRK5 on p53,STAT3 and p-STAT3 protein expression of astrocytes through hypoxia inductionNote:A.The results of Western blot detection;B.The relative expression of p53,STAT3 and p-STAT3 protein;1.Blank group;2.Hypoxia group;3.Hypoxia+pcDNA3.1-GRK5 group;4.Hypoxia+siRNA-GRK5 group;compared with the blank group,*.P<0.05;compared with the hypoxia group,#.P<0.05.
3 讨论
有研究发现,AS不仅可保护和支持神经元,且可参与神经元突触形成和轴突生长调节,脑损伤后可引起AS功能及结构发生变化,影响神经的康复[7,8]。缺氧、缺血是继发脑损伤的一个常见因素,可增加AS活性[9,10]。GRK5为一类丝苏氨酸激酶,在多种与神经紊乱有关的疾病中发挥作用[11]。有研究显示,敲除GRK5的小鼠在老化时β-淀粉样蛋白生成量增多,引起炎症反应和细胞凋亡[12]。沉默GRK5的表达可刺激NF-κB表达,增加AS的活化[13],GRK5对AS细胞凋亡的影响怎样目前还未清楚。本研究中抑制或过表达GRK5,并通过缺氧处理,试图检测GRK5表达的改变对AS的影响。流式细胞仪检测细胞凋亡结果发现,缺氧可引起AS的凋亡,而过表达GRK5可降低AS的凋亡,抑制GRK5的表达反之,这提示GRK5表达的升高可能对脑损伤起到保护作用。
大量研究显示,多种炎症因子,如TNF-α等的分泌可使AS活化,AS的活化在损伤早期可加快TNF-α和IL-1β等致炎因子的释放,进而加重炎症变化,在多项研究中发现TNF-α和IL-1β可增加AS的凋亡[14,15]。本研究检测抑制或过表达GRK5后对缺氧诱导的AS中TNF-α和IL-1β表达的影响,发现缺氧可增加TNF-α和IL-1β表达,过表达GRK5可降低TNF-α和IL-1β表达,而抑制GRK5表达后TNF-α和IL-1β表达升高,这提示GRK5表达升高可减轻炎症反应。细胞凋亡受到多种途径的影响,如细胞内ROS含量及一些凋亡因子等。ROS的堆积过度可引起蛋白质的氧化损伤,细胞的代谢、功能和结构的异常等,最终将导致细胞的凋亡和坏死,神经细胞死亡的一个关键因素就是细胞内的ROS含量增多[16,17]。p53为一个凋亡促进因子,研究发现,敲除小鼠p53后可降低癫痫导致的细胞凋亡,AS中p53的表达增强可引起细胞凋亡[18,19]。本研究检测GRK5引起AS凋亡的途径,发现缺氧可引起ROS含量和p53增加,过表达GRK5可降低ROS含量和p53表达,抑制GRK5表达反之。这提示GRK5可通过调节ROS含量和p53表达影响AS的凋亡。STAT3信号通路是一个重要的跨膜信号转导途径,参与细胞的增殖、凋亡、分化等过程,缺氧、癫痫、炎症刺激等多种因素均可激活脑内的STAT3,受到刺激后STAT3发生磷酸化[20-22]。研究发现,STAT3的活化可增加AS的反应性增生,抑制STAT3信号可对脑损伤起到保护作用[23]。本研究的结果显示,缺氧可诱导磷酸化的STAT3表达,而对STAT3表达无影响,过表达GRK5可抑制磷酸化的STAT3表达,抑制GRK5表达可增强磷酸化的STAT3表达。这提示GRK5可通过下调STAT3信号影响AS。
综上所述,过表达GRK5可降低AS凋亡及ROS水平,下调L-1β、TNF-α、p53表达及STAT3信号通路,抑制GRK5表达反之。本研究可能为脑损伤的分子靶向治疗提供了新的方法,值得进一步从体内实验进行验证。
