过表达或抑制肿瘤相关巨噬细胞B7-H1基因对卵巢癌增殖侵袭的机制研究
2018-08-24瞿秋红韦立蓓
瞿秋红 韦立蓓 尹 伶
(武汉科技大学附属天佑医院妇产科,武汉 430064)
卵巢癌是常见的妇科肿瘤之一,近些年的发病率呈现上升趋势,且大多数患者确诊时已处于晚期。目前主要以手术治疗辅助放化疗的治疗方式,但患者的总体预后差,且五年的生存率低,因此,急需寻找有效的治疗途径[1,2]。近些年来,卵巢癌的免疫治疗研究有了很大的突破,但临床的治疗效果却不佳,其主要原因是肿瘤的免疫逃逸[3]。B7-H1为B7家族成员之一,通过结合于T细胞受体PD-1,抑制T细胞和B细胞的功能,引起肿瘤的免疫逃逸[4]。已有多项研究表明,在肿瘤相关巨噬细胞(TAM)上B7-H1出现高表达,可传递出共抑制信号而使T细胞的功能受到抑制[5,6]。卵巢癌组织中B7-H1出现高表达,与生存期短、预后差等相关,可作为免疫靶向治疗卵巢癌的一个思路[7]。卵巢癌与巨噬细胞共培养后可引起B7-H1表达的升高[8]。目前TAM B7-H1的表达对卵巢癌生物学特性的影响还未清楚。因此,本研究在体外刺激人单核THP-1细胞成为巨噬细胞,并诱导为TAM,通过腺病毒载体系统过表达或抑制TAM中的B7-H1基因,检测对卵巢癌细胞增殖侵袭的影响,并进一步研究其作用机制。
1 材料与方法
1.1材料 人卵巢癌CAOV3细胞及人单核THP-1细胞株均购自美国ATCC细胞库;过表达及B7-H1 siRNA腺病毒载体及表达RFP对照的腺病毒载体购自上海泽叶生物科技有限公司;总RNA提取试剂盒及逆转录试剂盒购自日本TaKaRa公司;CCK8试剂购自上海同仁研究所;Transwell板购自美国Corning公司;二喹啉甲酸(Bicinchoninic acid,BCA)蛋白定量试剂盒购自碧云天生物技术研究所;B7-H1、Ki67、基质金属蛋白2(Matrix metalloproteinase 2,MMP-2)、基质金属蛋白9(Matrix metalloproteinase 9,MMP-9)、磷酸化的蛋白酪氨酸激酶2(phosphorylated Janus kinase2,p-JAK2)和磷酸化的信号转导与转录因子3(phosphorylated signal transducers and activators of transcription 3,p-STAT3)抗体均购自美国CST公司;酶标仪购自美国Thermo Labsystem公司;实时荧光定量PCR仪购自美国Bio-Rad。
1.2方法
1.2.1人M2型肿瘤相关巨噬细胞(TAM)的诱导建立 参照文献[9,10]方法对M2型巨噬细胞进行诱导:用PMA(10 ng/ml)处理THP-1细胞3 d,细胞被诱导贴壁并分化为成巨噬细胞,再用MCSF(10 ng/ml)处理细胞,使细胞最终分化成为M2型巨噬细胞。
1.2.2腺病毒转染TAM及转染后的细胞中B7-H1的表达 扩增B7-H1过表达腺病毒载体、B7-H1 siRNA腺病毒载体及表达RFP对照的腺病毒载体,其中表达RFP的载体系统携带RFP荧光蛋白,可用于测定巨噬细胞感染力,将细胞转染M2巨噬细胞,并设置空白对照组。通过RT-PCR及Western blot检测转染后的细胞中B7-H1的表达。
1.2.3B7-H1的mRNA表达检测 总RNA提取试剂盒提取各组细胞总RNA,参照逆转录试剂盒反转录总RNA为cDNA,以cDNA为模板,20 μl体系,GAPDH为内参基因,通过荧光定量PCR对B7-H1的表达进行检测。B7-H1和GAPDH的引物分别为:B7-H1:F:5′-GGTGGTGCCGACTACAAG-3′,R:5′-ATTGGTGGTGGTGGTCTTAC-3′;GAPDH :F:5′-GTCACCAGGGCTGCTTTTAACTC-3′,R:5′-CAGCATCGCCCC-ACTTGATTTTG-3′。PCR反应条件为:95℃预变性30 s,95℃变性10 s,64℃退火20 s,72℃延伸30 s,共39个循环。采用2-ΔΔCt比较法根据RT-PCR得出的Ct均值计算B7-H1的mRNA相对含量。
1.2.4B7-H1的蛋白表达检测 细胞中加入裂解液裂解30 min,离心后收集上清,BCA法对蛋白含量进行检测,每泳道取等量蛋白样品行SDS-PAGE,电泳结束后将蛋白电转移至硝酸纤维素膜,含5%牛奶的封闭液封闭1 h,4℃孵育B7-H1和GAPDH抗体(分别按照1∶500和1∶1 000稀释),洗膜,加入二抗,孵育1 h后洗膜,ECL显色液显色,置于暗室中显影曝光条带。
1.2.5M2型巨噬细胞与卵巢癌细胞共培养 将处理后的M2型巨噬细胞分别与人卵巢癌CAOV3细胞共培养,使用只允许可溶性的细胞因子通过的0.4 μm Transwell小室于6孔培养板中,接种不同处理的TAM于每个小室内,6孔板接种卵巢癌细胞,共培养两种细胞7 d进行后续的实验研究。
1.2.6细胞活力检测 通过CCK8法,消化离心单独培养及与不同处理的TAM同培养7 d的卵巢癌细胞,制成单细胞悬液,接种96孔板,每组一个孔板,并设置3个复孔,培养箱内培养,观察到细胞刚贴壁时开始计时,于培养的24、36、48 h,在每孔细胞中加CCK8试剂10 μl,37℃孵育1 h,酶标仪测定450 nm处的吸光度值(A)。实验重复3次。
1.2.7细胞侵袭检测 将Matrigel胶用无血清培养基稀释至终浓度为1 mg/ml,整个过程在冰上操作,Transwell小室上室加入稀释后的Matrigel胶100 μl,37℃温育4~5 h使之成为胶状,上室中加入单独培养及与不同处理的TAM同培养的卵巢癌细胞,下室中加入600 μl含血清的培养液,孵育箱中孵育2 h,取出小室,甲醇固定30 min,Giemsa染色30 min,显微镜下随机选择9个视野进行计数,统计结果。
1.2.8Ki67、MMP-2、MMP-9、p-JAK2、p-STAT3蛋白表达检测 各组细胞中Ki67、MMP-2、MMP-9、p-JAK2、p-STAT3蛋白表达检测参照1.2.4。
2 结果
2.1转染后的巨噬细胞中B7-H1的表达 通过RT-PCR及Western blot检测过表达及抑制B7-H1表达后的巨噬细胞中B7-H1的表达,结果如图1和表1所示,Ad-RFP组B7-H1表达与对照组差异无统计学意义(P>0.05),而Ad-siB7-H1组B7-H1的表达显著低于对照组(P<0.05),Ad-B7-H1组B7-H1的表达显著高于对照组(P<0.05)。
2.2转染过表达或抑制B7-H1的TAM对卵巢癌细胞活力的影响 通过CCK8法检测单独培养及与过表达或抑制B7-H1的TAM共培养的卵巢癌细胞的活力,结果如表2所示,与单独培养组比较,TAM组在24、36和48 h的细胞活力均显著升高,与RFP-TAM组比较,siB7-H1-TAM组在24、36和48 h的细胞活力均显著降低,B7-H1-TAM组在24、36和48 h的细胞活力均显著升高,差异均具有统计学意义(P<0.05)。
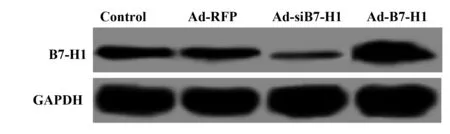
图1 转染后的巨噬细胞中B7-H1的蛋白表达Fig.1 Protein expression of B7-H1 in macrophages after transfection
表1转染后的巨噬细胞中B7-H1的mRNA及蛋白表达
Tab.1mRNAandproteinexpressionofB7-H1inmacrophagesaftertransfection

GroupsmRNA expressionof B7-H1Protein expressionof B7-H1Control group10.168±0.021Ad-RFP group1.018±0.1420.176±0.023Ad-siB7-H1 group0.217±0.0321)0.034±0.0081)Ad-B7-H1 group6.887±0.6471)0.715±0.0791)F 261.134 150.058P 0.000 0.000
Note:Compared with the control group,1)P<0.05.
2.3转染过表达或抑制B7-H1的TAM对卵巢癌细胞侵袭的影响 Alone组、TAM组、RFP-TAM组、siB7-H1-TAM组和B7-H1-TAM组细胞的侵袭率分别为(100.00±8.6)、(354.2±18.8)、(351.8±17.8)、(207.4±21.4)、(547.5±36.7),5组细胞的侵袭率经单因素方差分析,差异具有统计学意义(F=168.752,P=0.000),与Alone组比较,TAM组细胞侵袭能力显著升高,与RFP-TAM组比较,siB7-H1-TAM组细胞侵袭能力显著降低,B7-H1-TAM组细胞侵袭能力显著升高,差异均具有统计学意义(P<0.05),见图2。
表2转染过表达或抑制B7-H1的TAM对卵巢癌细胞活力的影响
Tab.2EffectofoverexpressionorinhibitionofB7-H1TAMonviabilityofovariancancercells
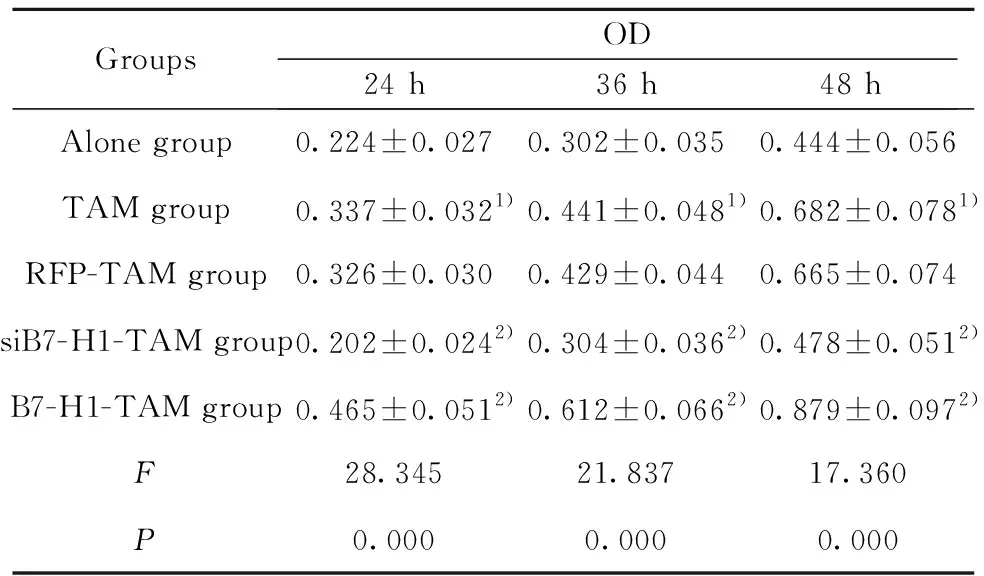
GroupsOD24 h36 h48 hAlone group0.224±0.0270.302±0.0350.444±0.056TAM group0.337±0.0321)0.441±0.0481)0.682±0.0781)RFP-TAM group0.326±0.0300.429±0.0440.665±0.074siB7-H1-TAM group0.202±0.0242)0.304±0.0362)0.478±0.0512)B7-H1-TAM group0.465±0.0512)0.612±0.0662)0.879±0.0972)F28.34521.83717.360P0.0000.0000.000
Note:Compared with the alone group,1)P<0.05;compared with the RFP-TAM group,2)P<0.05.
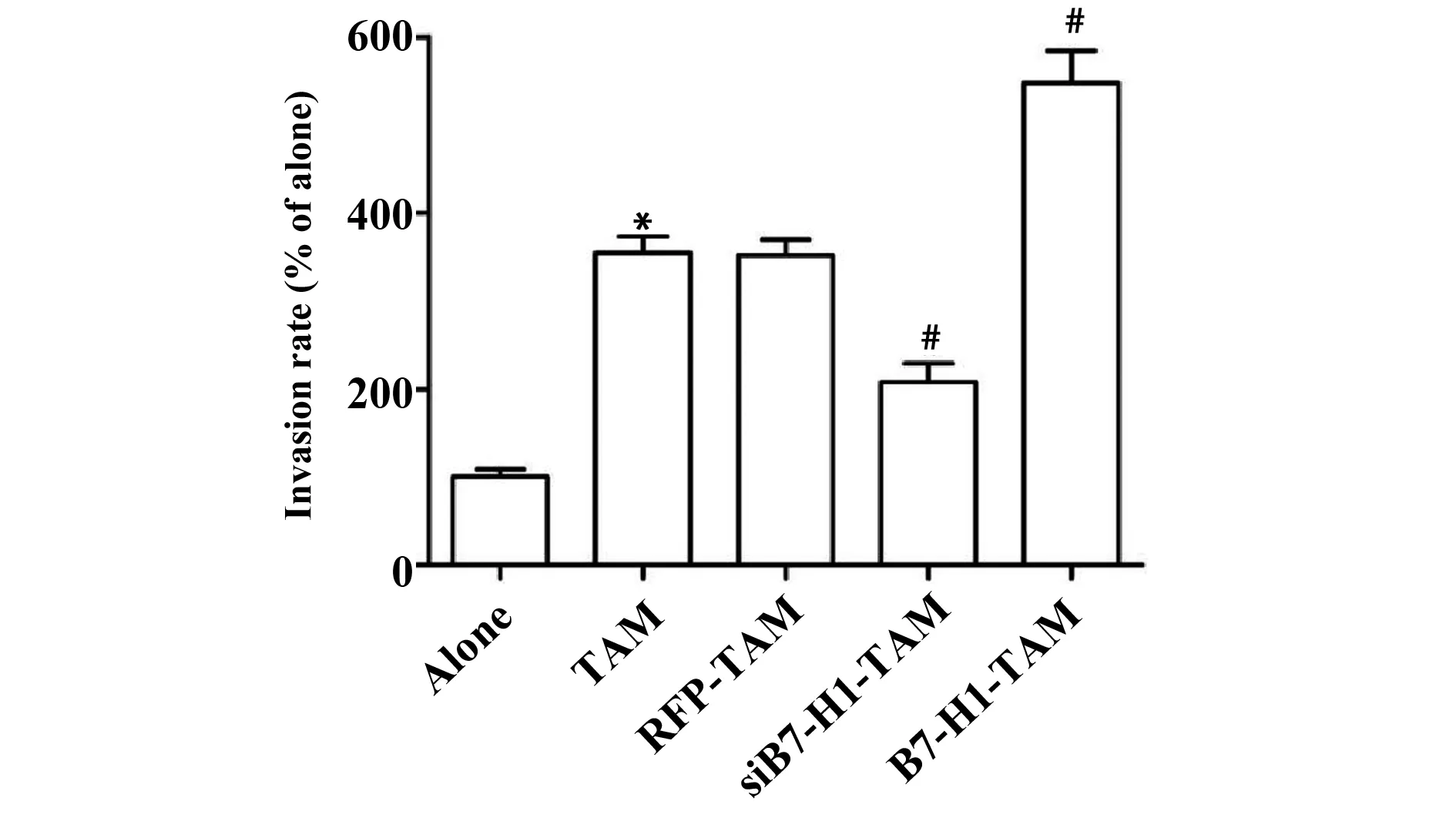
图2 转染过表达或抑制B7-H1的TAM对卵巢癌细胞侵袭的影响Fig.2 Effect of overexpression or inhibition of B7-H1 TAM on invasion of ovarian cancer cellsNote:Compared with the alone group,*.P<0.05;compared with the RFP-TAM group,#.P<0.05.

图3 转染过表达或抑制B7-H1的TAM对卵巢癌细胞Ki67、MMP-2和MMP-9蛋白表达的影响Fig.3 Effect of overexpression or inhibition of B7-H1 TAM on expression of Ki67,MMP-2 and MMP-9 protein in ovarian cancer cells
表3转染过表达或抑制B7-H1的TAM对卵巢癌细胞Ki67、MMP-2和MMP-9蛋白表达的影响
Tab.3EffectofoverexpressionorinhibitionofB7-H1TAMonexpressionofKi67,MMP-2andMMP-9proteininovariancancercells
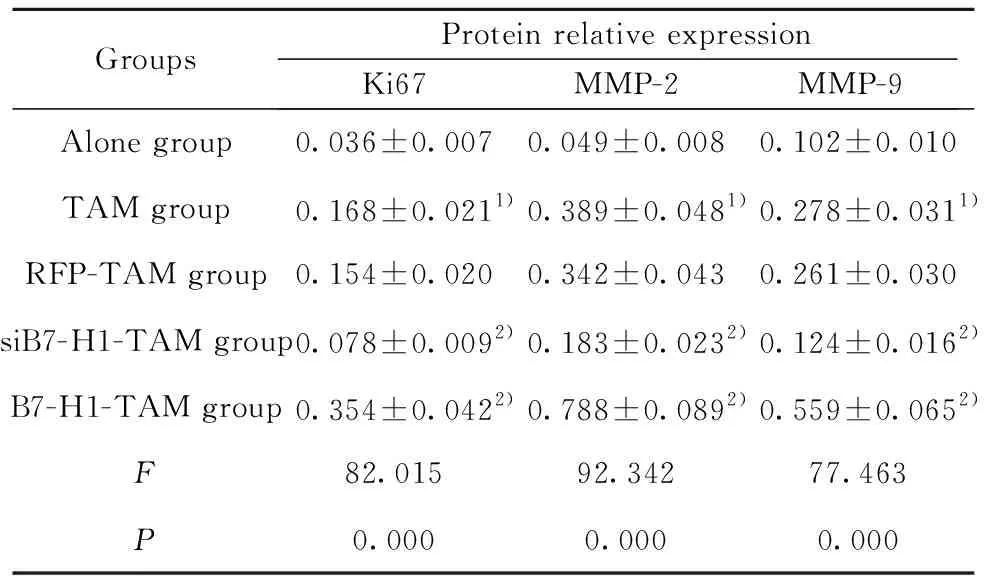
GroupsProtein relative expressionKi67MMP-2MMP-9Alone group0.036±0.0070.049±0.0080.102±0.010TAM group0.168±0.0211)0.389±0.0481)0.278±0.0311)RFP-TAM group0.154±0.0200.342±0.0430.261±0.030siB7-H1-TAM group0.078±0.0092)0.183±0.0232)0.124±0.0162)B7-H1-TAM group0.354±0.0422)0.788±0.0892)0.559±0.0652)F82.01592.34277.463P0.0000.0000.000
Note:Compared with the alone group,1)P<0.05;compared with the RFP-TAM group,2)P<0.05.
2.4转染过表达或抑制B7-H1的TAM对卵巢癌细胞增殖侵袭蛋白表达的影响 通过Western blot检测转染过表达或抑制B7-H1的TAM对卵巢癌细胞增殖相关蛋白Ki67、侵袭相关蛋白MMP-2和MMP-9蛋白表达的影响,结果如图3和表3所示,与Alone组比较,TAM组Ki67、MMP-2和MMP-9的蛋白表达均显著升高,与RFP-TAM组比较,siB7-H1-TAM组Ki67、MMP-2和MMP-9的蛋白表达均显著降低,B7-H1-TAM组Ki67、MMP-2和MMP-9的蛋白表达均显著升高,差异具有统计学意义(P<0.05)。
2.5转染过表达或抑制B7- H1的TAM对卵巢癌

图4 转染过表达或抑制B7-H1的TAM对卵巢癌细胞JAK2/STAT3信号通路的影响Fig.4 Effect of overexpressing or inhibiting B7-H1 TAM on JAK2/STAT3 signaling pathway in ovarian cancer cells
表4转染过表达或抑制B7-H1的TAM对卵巢癌细胞JAK2/STAT3信号通路的影响
Tab.4EffectofoverexpressingorinhibitingB7-H1TAMonJAK2/STAT3signalingpathwayinovariancancercells

GroupsProtein relative expressionp-JAK2p-STAT3TAM group0.145±0.0191)0.263±0.0341)RFP-TAM group0.137±0.0170.245±0.032siB7-H1-TAM group0.068±0.0092)0.133±0.0182)B7-H1-TAM group0.348±0.0402)0.388±0.0462)F90.78153.509P0.0000.000
Note:Compared with the Alone group,1)P<0.05;compared with the RFP-TAM group,2)P<0.05.
细胞JAK2/STAT3信号通路的影响 Western blot检测转染过表达或抑制B7-H1的TAM对卵巢癌细胞JAK2/STAT3信号通路磷酸化的JAK2和STAT3的蛋白表达的影响,结果如图4和表4所示,与Alone组比较,TAM组p-JAK2和p-STAT3的蛋白表达均显著升高(P<0.05),与RFP-TAM组比较,siB7-H1-TAM组p-JAK2和p-STAT3的蛋白表达均显著降低(P<0.05),B7-H1-TAM组p-JAK2和p-STAT3的蛋白表达均显著升高(P<0.05)。
3 讨论
研究肿瘤的免疫治疗为治疗肿瘤带来了希望,但在临床上的实际治疗效果并不理想,其中肿瘤介导的免疫逃逸是对多种肿瘤治疗的一个主要障碍。因此,研究卵巢癌及其免疫系统间的关系,并寻找有效的治疗策略具有重要意义。肿瘤组织中的巨噬细胞称为TAM,TAM在促进肿瘤进展及抗肿瘤免疫中发挥作用,TAM可通过上调基质金属蛋白酶、蛋白水解酶等表达,溶解细胞外的基质及破坏基底膜,从而增加肿瘤的浸润与转移[11,12]。有研究显示,M2型TAM与前列腺癌、肝癌等多种肿瘤的预后有关,可能成为治疗肿瘤的靶点[13,14]。B7-H1是一个重要的负性调控分子,在免疫抑制微环境的维持及免疫逃逸中有重要作用,在很多慢性病患者、肿瘤组织等有高表达,在肿瘤中的异常表达与预后及恶性程度有关,其高表达患者恶性程度高,且预后差[15,16]。有研究显示,下调脑胶质瘤中B7-H1的表达可抑制细胞的增殖和促进细胞凋亡[17];B7-H1的表达影响胃腺癌患者的TAM数量[18],B7-H1在卵巢癌中高表达,卵巢癌与TAM共培养可上调B7-H1的表达[8],改变TAM中B7-H1的表达对卵巢癌生物学特性的影响还未清楚。
本研究通过腺病毒载体系统过表达或抑制TAM中的B7-H1基因,通过CCK8法及Transwell小室分别检测卵巢癌细胞增殖及侵袭能力,结果显示,卵巢癌与巨噬细胞共培养相对于单独培养B7-H1的表达升高,而下调B7-H1的表达后癌细胞的增殖及侵袭能力均明显降低,上调B7-H1的表达反之。Ki67是一个细胞增殖核抗原,是检测细胞增殖活性的一个可靠指标,与肿瘤细胞及组织的生长、转移、侵袭和复发相关[19,20]。有研究显示,乳腺癌组织中Ki67与B7-H1呈正相关[21]。MMP-2和MMP-9为MMPs家族的两个重要成员,在卵巢的侵袭及转移过程中有重要作用,影响卵巢癌的预后及进展[22]。有研究发现,TAM在受到趋化性细胞因子刺激后,可释放出MMPs,肿瘤细胞易发生脱落,从而间接引起肿瘤的侵袭和转移[23]。肺癌细胞与TAM共培养后可增加细胞内MMP-9的表达[24];胃癌与TAM共培养后MMP-2和MMP-9的表达均明显上调[25]。本研究的结果显示,卵巢癌与TAM共培养后Ki67、MMP-2和MMP-9的表达相对于单独培养升高,这与前人在其他肿瘤中的研究是一致的,下调B7-H1的表达后细胞中Ki67、MMP-2和MMP-9的表达均显著降低,而上调B7-H1表达反之。这提示B7-H1可通过调节Ki67、MMP-2和MMP-9的表达影响卵巢癌的增殖和侵袭能力。JAK2/STAT3信号通路的持续激活可引起异常的细胞增殖及恶性转化,导致多种人类肿瘤的发生[26]。卵巢癌细胞中可通过调节JAK2/STAT3信号通路降低癌细胞的增殖及诱导凋亡[27]。阻断JAK2/STAT3信号通路可降低B7-H1的表达[28]。本研究检测JAK2/STAT3信号通路p-JAK2和p-STAT3的表达,结果显示,卵巢癌与TAM共培养后p-JAK2和p-STAT3的表达均显著升高,而抑制B7-H1的表达后可降低p-JAK2和p-STAT3的表达,过表达B7-H1反之。这提示B7-H1可通过抑制JAK2/STAT3信号通路影响卵巢癌生物学特性。
综上所述,抑制TAM B7-H1基因可抑制卵巢癌细胞活力及侵袭能力,下调JAK2/STAT3信号通路,过表达B7-H1可增强卵巢癌细胞活力和侵袭能力,上调JAK2/STAT3信号通路。其中对细胞增殖侵袭作用方式是下调Ki67、MMP-2和MMP-9表达。本研究提示B7-H1可能是卵巢癌免疫治疗的一个新的靶点,但本研究内容有限,且未在体内实验验证。但TAM中B7-H1的作用值得进一步深入探讨。
