羚羊角与钩藤联合用药抑制热性惊厥大鼠脑损伤作用机制研究①
2018-08-24帅云飞荀春铮麻玲霞
帅云飞 谢 静 李 鑫 荀春铮 麻玲霞 饶 慧
(湖南中医药大学第一附属医院,长沙 410007)
热性惊厥(Febrile seizure,FS)是好发于6个月~5岁儿童的临床常见惊厥性疾病,反复或长时间发作的FS可以造成脑损伤[1]。FS患病率高达3%~5%,复发率约为30%~40%。FS发病机制尚未完全明确,研究认为与免疫炎症过程、细胞因子激活及遗传因素相互作用密切相关[2]。研究表明,内源性致热因子TNF-α、IL-1β介导COX2、PGE2等炎症因子大量表达从而引起机体发热[2-6],而发热引起下丘脑及海马等脑区神经元兴奋,形成异位放电从而导致FS发生[7,8]。TNF-α、IL-1β等促炎性细胞因子也可促进神经元兴奋性增加,从而促进Glu、Asp等兴奋性神经递质大量表达,介导“神经毒”导致FS脑损伤[9]。
羚羊角、钩藤均具有“息风止痉”之功效,临床单用治疗FS具有一定疗效,但其作用强度较弱[10,11]。临床治疗FS时,羚羊角与钩藤也常配伍使用[12],即中药七情配伍理论之“相须”为用,以羚羊角与钩藤为君药的羚角钩藤汤治疗FS临床疗效显著[13]。然而,羚羊角与钩藤联合用药的药效作用与羚羊角及钩藤单用是否异同,其作用环节是否异同?前期研究明确了羚羊角与钩藤联合用药的最佳剂量,并发现最佳剂量较羚羊角及钩藤单用显著增加惊厥潜伏时间,抑制惊厥持续时间。本研究基于促炎性因子TNF-α及IL-1β及介导神经毒的Glu、Asp探求其作用环节的异同,以期为其临床应用提供科学的实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级SD大鼠,21日龄,雌雄各半,体质量(50±10)g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2013-0004,合格证号:43004700024978。
1.1.2受试药物 羚羊角(批号:20160912)、钩藤(批号:20160909)均采用三九配方颗粒,购自湖南中医药大学第一附属医院药剂科。
1.1.3仪器及试剂 HH-W420数显恒温水浴箱(金坛市科析仪器有限公司),手持式匀浆器(德国IKA公司),高速冷冻离心机(5180R,德国Eppendorf公司),酶标仪(iMARK,美国Bio-Rad 公司),奥林巴斯BH-2 光学显微镜(日本 Olympus),数字摄像仪TK-C1381(日本Vietor公司),图像分析系统(北京航空航天大学研制)。Glu检测试剂盒、Asp检测试剂盒(上海优予生物科技有限公司,批号:20160928),TNF-α检测试剂盒、IL-1β检测试剂盒(武汉博士德生物工程有限公司,批号:20161015)。
1.2方法
1.2.1热性惊厥大鼠模型的建立及处理 采用热水浴建立FS大鼠模型[14,15],取SD大鼠,置于(44.5±0.5)℃恒温水浴箱,水深以大鼠仅露出头部为宜,热水浴时间为5 min。5 min内出现惊厥者,纳入实验,未惊厥者,剔除。随机抽取10只鼠作为空白对照组,其余45只鼠进行筛选,共有40只鼠进入实验组,成模率88.89%。取符合实验要求的大鼠,按体质量分层随机分为模型组、羚羊角组(0.405 g/kg)、钩藤组(0.81 g/kg)、羚羊角(0.405 g/kg)与钩藤(0.81 g/kg)联合用药组,每组10只。各药物组大鼠,按10 ml/kg给予相应药液,1次/d,连续21 d。末次给药24 h后,置于(44.5±0.5)℃恒温水浴箱中,造模,隔日一次,连续10次。
1.2.2羚羊角与钩藤联合用药对海马区组织形态学影响 末次给药24 h后,安乐处死各组大鼠,冰上取脑组织,采用HE法观察羚羊角与钩藤联合用药对热性惊厥大鼠海马区组织形态学改变情况。
1.2.3羚羊角与钩藤联合用药对大鼠脑组织Glu、Asp、TNF-α及IL-1β含量影响 安乐处死大鼠,冰上取脑组织,4℃、3 000 r/min、15 min匀浆,取上清液,按ELISA法检测大鼠Glu、Asp、TNF-α及IL-1β含量。
1.2.4羚羊角与钩藤联合用药对大鼠海马区TNF-α、IL-1β表达影响 安乐处死大鼠,冰上取脑组织,多聚甲醛固定,采用免疫组化法检测海马区TNF-α、IL-1β表达情况,每张切片随机选取5个视野,拍照,并进行图像分析。
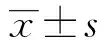
2 结果
2.1对FS大鼠海马区组织形态学影响 模型组部分神经细胞肿胀、脱失,海马带宽窄不一,CA1、CA3区锥体细胞数目减少,排列紊乱,细胞极向差;细胞轮廓模糊,细胞膜皱缩,呈不规则形、三角形;细胞核不规则,空泡变性。羚羊角与钩藤联合用药组细胞形态、大小基本正常,胞体边界较清晰;细胞浆染色深浅基本均匀,胞核呈大致椭圆形、圆形,且清晰;神经纤维轮廓及排列清晰;海马带整齐;位于CA1、CA3区锥体细胞排列基本紧密、整齐,且层次清晰、细胞极性好。羚羊角组与钩藤组海马形态变化大致相同。结果见图1。
2.2对FS大鼠Asp和Glu含量影响 研究结果显示,羚羊角与钩藤联合用药组、羚羊角组及钩藤组Asp、Glu含量均较模型组显著降低(P<0.01,P<0.05)。羚羊角与钩藤联合用药组Asp较钩藤组显著降低(P<0.05)。结果见表1。
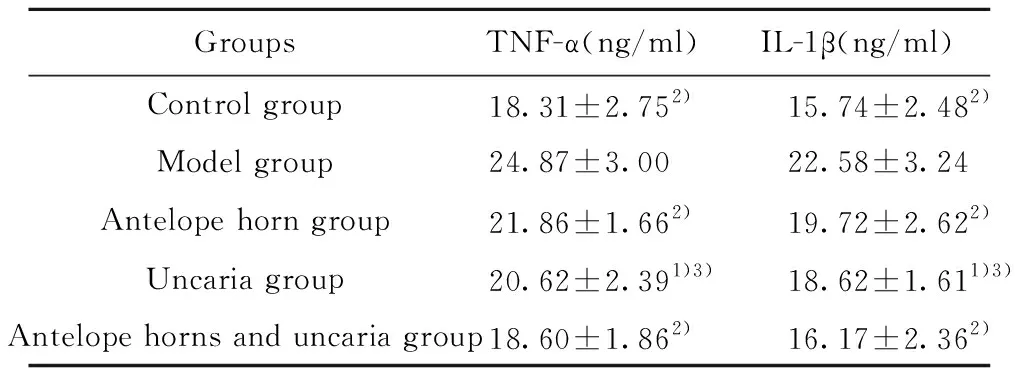
2.3对FS大鼠脑组织TNF-α及IL-1β含量影响 研究结果表明,羚羊角与钩藤联合用药组、羚羊角组及钩藤组TNF-α及IL-1β含量均较模型组显著降低(P<0.01,P<0.05)。羚羊角与钩藤联合用药组TNF-α及IL-1β较钩藤组显著降低(P<0.05)。结果见表2。
2.4对FS大鼠海马区TNF-α和IL-1β表达影响 研究结果显示,羚羊角与钩藤联合用药组、羚羊角组及钩藤组海马区TNF-α、IL-1β表达量均较模型组显著降低(P<0.01,P<0.05)。羚羊角与钩藤联合用药组海马区TNF-α较羚羊角组、钩藤组显著降低(P<0.05);羚羊角与钩藤联合用药组海马区IL-1β较钩藤组表达显著降低(P<0.05)。结果见表3,图2、3。

图1 羚羊角与钩藤联合用药对热性惊厥大鼠的海马组织病理学检查(×400)Fig.1 Histopathological examination of hippocampus in hyperthermia rats with antelope horn and uncaria combined(× 400)Note:A.Blank group;B.Model group;C.Uncaria group;D.Antelope horn group;E.Antelope horns and uncaria group.

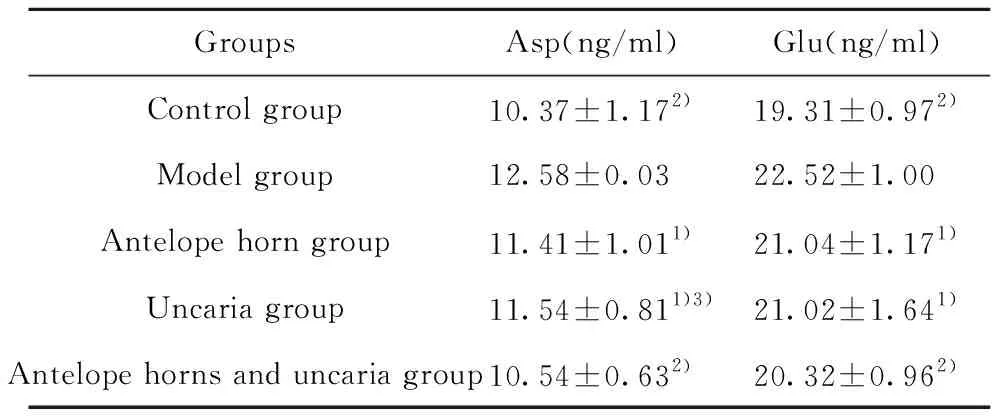
GroupsAsp(ng/ml)Glu(ng/ml)Control group10.37±1.172)19.31±0.972)Model group12.58±0.0322.52±1.00Antelope horn group11.41±1.011)21.04±1.171)Uncaria group11.54±0.811)3)21.02±1.641)Antelope horns and uncaria group10.54±0.632)20.32±0.962)
Note:Vs model group,1)P<0.05,2)P<0.01;vs antelope horns and uncaria group,3)P<0.05.

GroupsTNF-α(ng/ml)IL-1β(ng/ml)Control group18.31±2.752)15.74±2.482)Model group24.87±3.0022.58±3.24Antelope horn group21.86±1.662)19.72±2.622)Uncaria group20.62±2.391)3)18.62±1.611)3)Antelope horns and uncaria group18.60±1.862)16.17±2.362)
Note:Vs model group,1)P<0.05,2)P<0.01;vs antelope horns and uncaria group,3)P<0.05.

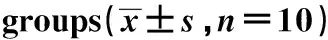

GroupsTNF-αIL-1βControl group0.30±0.082)0.30±0.052)Model group0.61±0.110.63±0.10Antelope horn group0.46±0.112)3)0.43±0.091)Uncaria group0.50±0.111)3)0.53±0.071)3)Antelope horns and uncaria group0.35±0.091)0.36±0.092)
Note:Vs model group,1)P<0.05,2)P<0.01;vs antelope horns and uncaria group,3)P<0.05.

图2 羚羊角与钩藤联合用药对热性惊厥大鼠的海马组织TNF-α的影响(×400)Fig.2 Effect of antelope horn and uncaria combined on expression of TNF-α in hippocampus of rats with febrile seizures(×400)Note:A.Control group;B.Model group;C.Uncaria group;D.Antelope horn group;E.Antelope horns and uncaria group.

图3 羚羊角与钩藤联合用药对热性惊厥大鼠的海马组织IL-1β的影响(×400)Fig.3 Effect of antelope horn and uncariae on expression of IL-1β in hippocampus of rats with febrile seizures(×400)Note:A.Control group;B.Model group;C.Uncaria group;D.Antelope horn group;E.Antelope horns and uncaria group.
3 讨论
FS是小儿时期最常见的惊厥发作性疾病,也是小儿常见急症。FS病因尚未完全明确,多以突发性的全身或者局限性肌群强制性、阵挛性收缩,并伴有意识障碍为主要临床特征[16]。FS发病机制复杂,免疫炎症过程、细胞因子激活与其发生发展密切相关[2]。
FS属中医学“急惊风”范畴,中医学认为,外风挟外邪侵袭人体,外风感召、引动内风,加上平素内火旺,风动助火,风火相煽,从而出现肝经热盛,热极动风,发为急惊风,临床常用羚羊角、钩藤等息风止痉药治疗。有研究表明,羚羊角、钩藤单用治疗FS具有一定疗效,但其作用强度较弱[10,11]。羚羊角与钩藤也常配伍使用[12,13],即中药七情配伍理论之“相须”为用。中药七情配伍理论认为,相须是指性能功效相类似药物配伍应用,可增加其原有疗效,即产生药效学的协同增效作用[17]。
研究表明,TNF-α、IL-1β是介导FS的关键促炎性细胞因子[2-6]。TNF-α、IL-1β介导PGE2、IL-6、ICAM-1等炎症介质大量释放,从而引起机体发热,而发热又引起下丘脑及海马等脑区神经元兴奋性增高,形成异位放电从而导致FS发生[2-6]。研究表明,FS患者血液TNF-α、IL-1β表达水平显著增高[18,19]。本研究显示,模型组TNF-α及IL-1β较正常组显著升高,与报道一致。经联用组、羚羊角组及钩藤组治疗后,各组脑组织及海马区TNF-α及IL-1β表达量均较模型组显著降低(P<0.01,P<0.05)。且联用组脑组织及海马区TNF-α及IL-1β表达较羚羊角组显著降低(P<0.05)。提示,联用组通过同时抑制前炎症因子TNF-α及IL-1β表达而发挥脑损伤保护作用,且疗效优于羚羊角与钩藤。
Glu与Asp是重要兴奋性神经递质[20,21]。研究发现,TNF-α、IL-1β等促炎性细胞因子可促进神经元兴奋性增加,从而促进Glu、Asp等兴奋性神经递质大量表达,介导“神经毒”导致FS脑损伤[9,22]。有研究显示,FS大鼠Glu、Asp显著升高,GABA的含量显著降低[9]。本研究结果显示,模型组Glu、Asp含量较正常组显著升高,与报道一致。经联用组、羚羊角组及钩藤组治疗后,各组Asp、Glu含量均较模型组显著降低(P<0.01,P<0.05)。联用组Asp较钩藤组显著降低(P<0.05)。研究结果提示,联用组通过同时抑制Asp、Glu等兴奋性神经递质的释放而脑损伤保护作用,且疗效优于羚羊角与钩藤。
综上,联用组可显著抑制FS所致大鼠脑损伤,其作用强度优于羚羊角、钩藤单独使用,其作用机制可能与抑制促炎症因子TNF-α、IL-1β及兴奋性氨基酸Asp、Glu表达有关。
