Th17/Treg相关因子对T84细胞单层模拟的肠黏膜屏障通透性的影响①
2018-08-24张目涵赵美华李林静冯百岁
贺 欣 张目涵 路 瑶 赵美华 马 娜 龚 陈 李林静 冯百岁
(郑州大学第二附属医院,郑州 450014)
炎症性肠病(Inflammatory bowel disease,IBD)是一种以腹痛、腹泻和黏液脓血便为主要临床表现的反复发作的慢性非特异性肠道炎症性疾病。其主要包括克罗恩病(Crohn′s disease,CD)和溃疡性结肠炎(Ulcerative colitis,UC)两种。目前为止IBD的病因和发病机制目前为止仍不是十分清楚,但多数认为是由遗传和环境因素,肠道菌群的改变和免疫调节紊乱等共同造成了肠黏膜屏障功能的损伤,继而导致疾病的发生[1]。肠上皮细胞作为肠黏膜屏障的重要组成成分,对于抵御肠腔内有害物质的入侵和参与肠黏膜免疫反应的调节等均具有重要作用[2]。而近年来不断有研究发现存在于肠道内辅助性T细胞(Th细胞)亚群中的Th17细胞与IBD疾病的发生发展过程有着密切的联系。Th17细胞及其分泌的特异性免疫因子IL-17和IL-22等可以在肠黏膜内介导Th17型免疫反应,从而进一步诱导IBD尤其是CD疾病的发生[3,4]。而调节性T细胞(Treg cell)可以通过分泌特异性免疫抑制因子IL-10的方式对肠黏膜免疫过程起到负向调节的抑制作用[5]。因此,近年来Th17/Treg细胞的免疫平衡作为新兴的细胞免疫平衡机制在肠黏膜免疫过程中起到非常重要的作用。本实验通过在Transwell细胞跨膜培养系统中培养T84细胞单层的方式用于体外环境下模拟肠黏膜屏障,通过测量模拟肠黏膜屏障中跨上皮电阻(Transepithelial electric resistance,TER)值和辣根过氧化物酶(Horseradish peroxidase,HRP)通过率在不同浓度和不同时间IL-17、IL-22和IL-10干预前后的改变,并对测量结果进行纵向和横向的对比,从而在模拟肠黏膜屏障的体外环境下探究不同浓度和不同作用时间的Th17/Treg相关因子对T84细胞单层通透性的影响,并为进一步明确IBD疾病中肠黏膜屏障Th17/Treg的免疫平衡以及对IBD疾病相关免疫机制的探究提供新的方法和思路。
1 材料与方法
1.1实验材料和试剂 人类结肠癌腺癌T84细胞株(购于中科院上海细胞所),重组人IL-17A/IL-22/IL-10(购于美国PeproTech公司),DMEM/F12培养基,胎牛血清(购于美国Gibco-BRL公司),辣根过氧化物酶(HRP)(购于鼎国生物有限公司),过氧化物酶标记的链霉卵白素染色试剂盒、二氨基联苯胺(DAB)显色试剂盒(购于博奥森生物技术公司)。
1.2方法
1.2.1T84细胞单层的培养 用DMEM/F12培养基对T84细胞株进行培养。在培养基中加入15 mmol/L HEPES和100 U/ml青霉素,于37℃,5%CO2的条件在细胞培养箱中进行培养。隔日换液并每日观察细胞生长状态。当培养基内细胞已经融合至80%左右时,使用0.25%胰酶-EDTA进行消化并传代。
1.2.2T84细胞单层通透性的检测 将(5×105~1×106)cells/cm2的T84细胞种植在Transwell细胞跨膜培养系统内(如图1),以T84细胞单层的跨上皮电阻(TER)和大分子辣根过氧化物酶(HRP)通过率作为评价T84细胞单层通透性的指标。从培养第3天开始检测TER值的变化,一般再培养7~11 d 以后TER即可达到1 000/cm2以上,满足后续实验要求。
1.2.3T84细胞TER的测定 T84细胞单层接种到Transwell细胞跨膜培养系统后,每日使用Millicell-ERS细胞电阻仪对T84细胞单层的TER值进行检测。当TER达到1 000 Ω/cm2以上时,以每4个跨膜培养系统为一组,将各个Transwell细胞跨膜培养系统随机分为正常对照组和单因子实验组。把不同浓度(10、20、40、60、80、100、500 ng/ml)的IL-17、IL-22和IL-10细胞因子加入到相应各组跨膜培养系统的肠腔侧中,分别在0、6、12、24和48 h时测量T84细胞的TER变化。计算公式为:TER值=(实际测量值-空白孔测量值)×Transwell培养系统的有效膜面积,最终结果单位用Ω/cm2表示。
1.2.4T84细胞HRP通过率的检测 使用改良版的Jacob等[8]报道的检测HRP通过率的方法,作为评价T84细胞单层通透性的指标。具体如下:①在Transwell培养系统中T84细胞模拟肠黏膜屏障的肠腔侧加入各种不同浓度(10、20、40、60、80、100、500 ng/ml)的IL-17、IL-22和IL-10细胞因子。②加入细胞因子后的0、6、12、24和48 h时将Transwell培养系统的上下腔培养基进行更换,并在培养基的上室中加入0.001 mmol/L的HRP,并放置在细胞培养箱中继续培养。③再过2 h之后收集上下两室的细胞培养上清,并在6、24和48时分别采用ELISA方法检测基底膜侧HRP的通过率。计算公式为:HRP通过率=Ca×Va/(Cb×Vb +Ca×Va),其中Ca代表基底侧HRP浓度,Va代表基底侧培养液体积,Cb代表肠腔侧HRP浓度, Vb代表肠腔侧培养液体积,计算结果用百分比表示。

图1 Transwell细胞跨膜培养系统Fig.1 Transwell cell transmembrane culture system
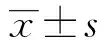
2 结果
2.1不同浓度和时间的IL-17对T84细胞单层模拟的肠黏膜屏障功能的影响 如图2、3。不同浓度组IL-17中的TER值相比差异具有统计学意义(F=25.574,P<0.001),不同时间对各组的TER值相比差异也具有统计学意义(F=1302.853,P<0.001),并且不同浓度和时间对各组TER值均存在交互作用(F=67.632,P<0.001)。
不同浓度组IL-17中的HRP值相比较也具有统计学意义(F=104.431,P<0.001),不同时间对各组HRP值的效应也有统计学意义(F=352.458,P<0.001),并且不同浓度和时间对各组TER值均存在交互作用(F=47.122,P<0.001)。
2.2不同浓度和时间的IL-22对T84细胞单层模拟的肠黏膜屏障功能的影响 如图4、5。不同浓度IL-22组中的TER值相比差异具有统计学意义(F=64.913,P<0.001),不同时间对各组的TER值相比差异也具有统计学意义(F=583.675,P<0.001),并且不同浓度和时间对各组TER值均存在交互作用(F=15.892,P<0.001)。

图2 不同浓度IL-17对T84细胞单层Transwell中相对TER的比较Fig.2 Comparison of comparative TER in T84 cell monolayer Transwell with different concentr-ations of IL-17Note:*.P<0.05.
不同浓度组IL-22中的HRP值相比较也具有统计学意义(F=236.325,P<0.001),不同时间对各组HRP值的效应也有统计学意义(F=1 008.014,P<0.001),并且不同浓度和时间对各组TER值均存在交互作用(F=49.150,P<0.001)。
2.3不同浓度和时间的IL-10对T84细胞单层模拟的肠黏膜屏障功能的影响 如图6、7。不同浓度IL-10组中的TER值相比组间没有差别,不具有统计学意义(F=1.486,P=0.267),不同时间对各组TER值的效应不具有统计学意义(F=1.076,P=0.403),并且不同浓度和不同时间下各组对TER值并不存在一定的交互作用(F=0.436 1,P=0.781)。

图3 不同浓度IL-17对T84细胞单层Transwell中HRP通过率的比较Fig.3 Comparison of HRP passing rates in T84 cell monolayer Transwell at different concentrations of IL-17Note:*.P<0.05.

图4 不同浓度IL-22对T84细胞单层Transwell中相对TER的比较Fig.4 Comparison of comparative TER in T84 cell monolayer Transwell with different concentra-tions of IL-22Note:*.P<0.05.
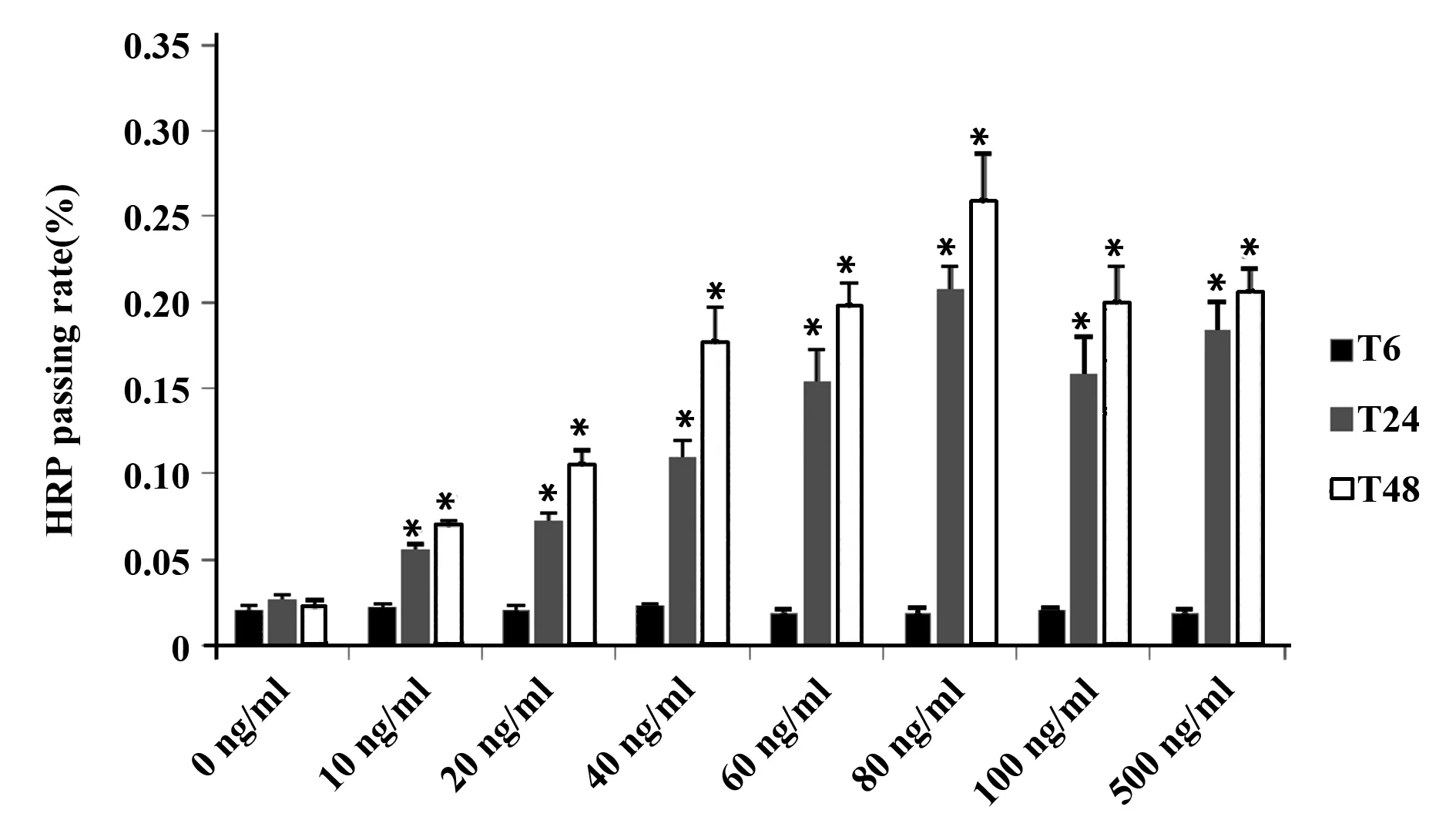
图5 不同浓度IL-22对T84细胞单层Transwell中HRP通过率的比较Fig.5 Comparison of HRP passing rates in T84 cell monolayer Transwell at different concentrations of IL-22Note:*.P<0.05.
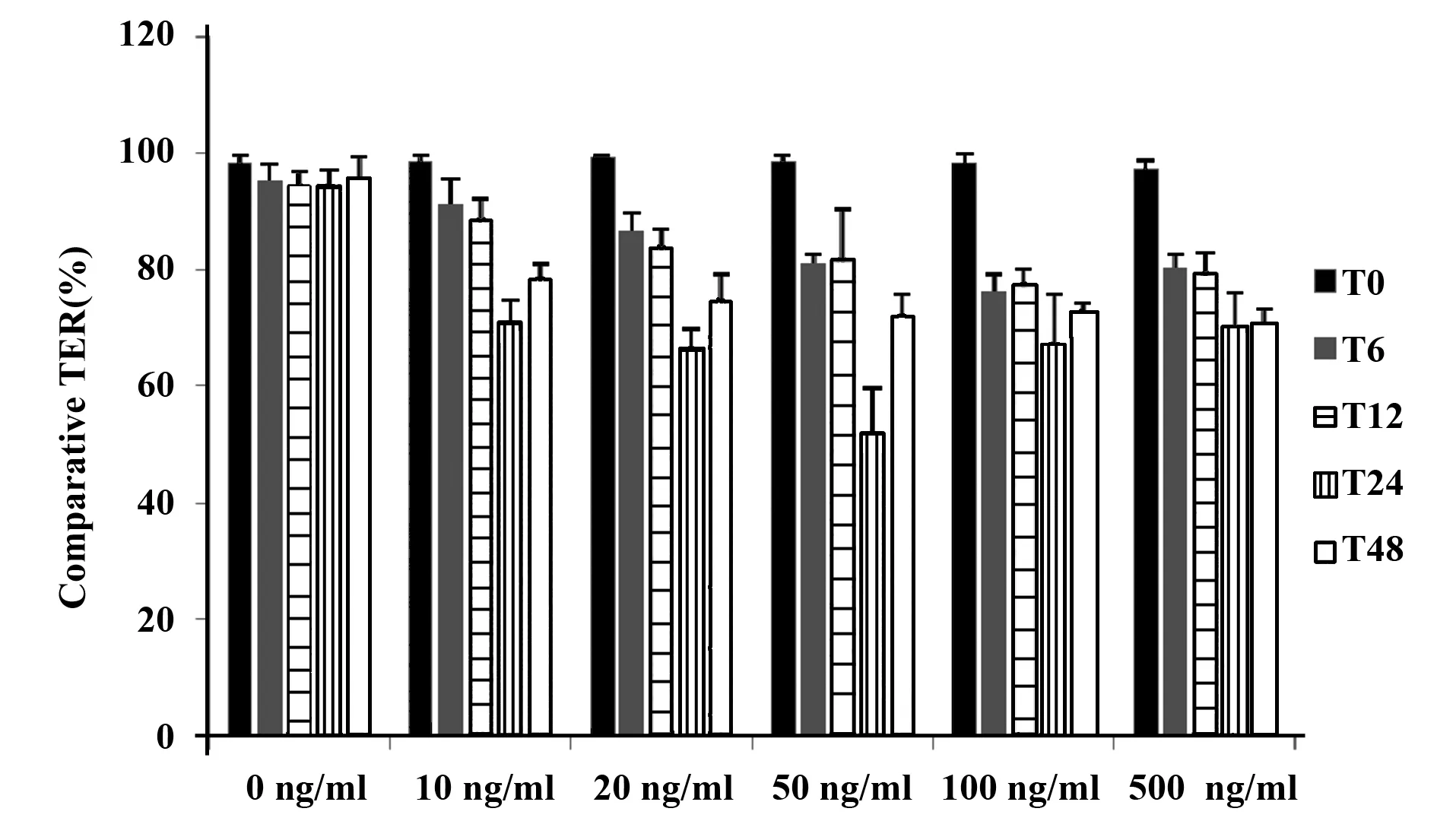
图6 不同浓度IL-10对T84细胞单层Transwell中相对TER的比较Fig.6 Comparison of comparative TER in T84 cell monolayer Transwell with different concentrat-ions of IL-10
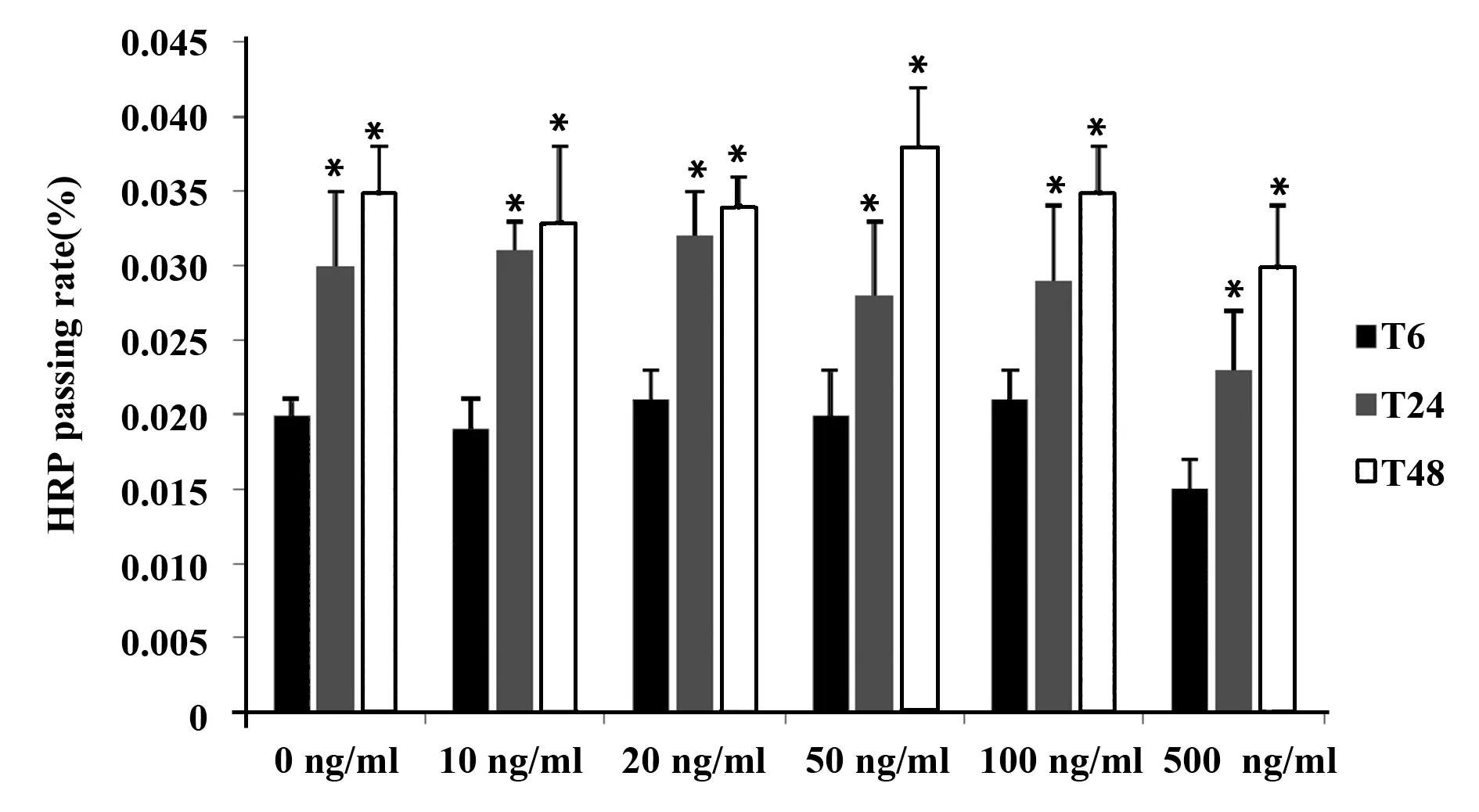
图7 不同浓度IL-10对T84细胞单层Transwell中HRP通过率的比较Fig.7 Comparison of HRP passing rates in T84 cell monolayers Transwell at different concentrations of IL-10Note:*.P<0.05.
不同浓度IL-10组中的HRP值相比也不具有统计学意义(F=0.576,P=0.684),不同时间对各组HRP值的效应具有统计学意义(F=85.547,P<0.001),但不同浓度和不同时间对各组TER值也不存在明显交互作用(F=0.761,P=0.546)。
3 讨论
IBD是一种病因尚不是十分清楚的累及肠道各个部位的特发性炎症性疾病。流行病学研究显示不同国家和地区人群中IBD的发病率存在显著差异,并且近年来其在发展中国家的发病率也呈逐年增高的趋势[9]。近年来越来越多的研究表明Th细胞和Treg细胞及其分泌的各种免疫因子之间的失衡被认为是IBD发病免疫机制中的一个重要环节。存在于肠道内的Th细胞主要分为Th1、Th2和Th17细胞三种,其中Th1和Th17细胞可以共同介导CD疾病的免疫反应,而Th2细胞则主要介导UC疾病免疫反应的过程[10]。一般情况下在IBD的发病机制中存在着Th1/Th2免疫反应的平衡[11,12],而Th17细胞是近几年来被发现的存在于Th细胞中的新亚型之一,活化后的Th17细胞主要分泌IL-17和IL-22等特异性免疫因子,并在自身免疫性疾病和机体防御反应中具有重要的意义[3]。Treg细胞在IBD的发病中主要起到抑制肠黏膜免疫的负向调节作用,肠黏膜内的Th1、Th2和Th17型免疫反应均可以激活Treg细胞并产生高水平的免疫抑制因子IL-10和TGF-β,继而通过接触抑制Th1和Th2细胞的方式对IBD发病过程中Th1/Th2细胞之间的免疫平衡起到一定的维持作用[13]。除此之外,肠黏膜的Treg细胞还可以与Th17细胞共同进行双向的调控和转化,从而在IBD过程中与Th17细胞形成了更加重要的Th17/Treg细胞免疫平衡,而主要由Th17细胞分泌的IL-17和IL-22,以及主要由Th10细胞分泌的IL-10这三种细胞因子也被称为Th17/Treg细胞因子[14]。
正常人体内主要由众多肠上皮细胞构成肠黏膜屏障的主体,此外相邻上皮细胞之间的紧密连接和各种紧密连接蛋白在参与构成肠黏膜屏障中同等重要。成熟的肠黏膜屏障不仅可以在肠道中作为天然屏障阻挡外来有害物质的入侵,还可以参与抗原提呈等肠黏膜内多种免疫反应并维持肠道免疫的稳态[15]。同样有关肠黏膜屏障的通透性除了包括在肠上皮细胞内部进行的跨肠上皮细胞途径之外,还同样包括从肠上皮细胞旁边的紧密连接蛋白通过的细胞旁途径[16]。本实验采用Transwell细胞跨膜培养系统所建立的肠黏膜屏障体外模型,并在该培养系统中培养T84细胞单层,通过对T84细胞单层TER数值的改变以及HRP通过率的变化进行检测,以此作为衡量肠黏膜屏障功能的指标。Transwell细胞跨膜培养系统是一种体外的模拟肠黏膜屏障系统,该系统的底层有一层带有微孔的人工膜,可以像人体肠黏膜一样具有通透性。T84细胞株来源于人结肠腺癌细胞。该细胞不仅可以在Transwell细胞跨膜培养系统中自发形成极化的单层上皮,并且可以像真实肠黏膜屏障一样具有很高的跨上皮电阻[17]。TER数值的改变主要与T84细胞单层的完整性密切相关[18],而HRP是一种相对分子质量为44 000的大分子蛋白质,当肠黏膜屏障健康完整时只有少于0.05%的极少量HRP可被转运至皮下。因此当T84细胞单层被破坏时就会有较多的HRP漏到下室[19]。IL-17是一种主要由Th17细胞分泌的可以在肠道局部组织中出现炎症反应的重要促炎因子。有研究发现在IBD患者外周血以及结肠黏膜组织中,均可以发现IL-17的表达水平明显高于正常,从而提示其在IBD发病过程中发挥重要作用[20]。在本实验中也发现,用不同浓度IL-17作用于T84细胞,当处理时间小于6 h时,在基底膜侧检测到的HRP通过率均少于0.05%,并且T84细胞单层的TER值也依然大于1 000 Ω/cm2。但当处理时间大于6 h时,随着时间的延长TER值会逐渐下降并且HRP通过率也会逐渐增加。因此可以说明当IL-17作用时间较短时不会破坏肠上皮细胞的完整性。当IL-17浓度小于20 ng/ml时,各组的TER值和HRP通过率均无明显变化,因此可以说明小剂量的IL-17不会破坏上皮细胞的完整性,甚至可以刺激肠黏膜发生一定的免疫耐受。但当IL-17浓度大于 20 ng/ml 时,T84细胞单层的TER值会随着IL-17浓度的增加开始逐渐下降,HRP通过率也会随着IL-17浓度的增加而不断增加。因此说明在一定的剂量范围内,IL-17可以破坏T84细胞单层所模拟的肠黏膜屏障并增加其通透性。但当IL-17浓度大于100 ng/ml时,继续增加IL-17浓度,与100 ng/ml浓度组相比TER值和HRP通过率并未发生明显变化,从而说明当浓度达到100 ng/ml时,TER值及HRP的通过率均已经达到极值。而IL-22是最近几年来新发现的一种多由Th17细胞分泌的重要细胞因子。很多研究表明IL-22不仅可以参与STAT3信号通路的活化,放大炎症反应并增强抗凋亡和促增殖基因的转录,还可以在急性结肠炎中诱导黏蛋白的表达和杯状细胞的重塑,甚至可以诱导肠上皮细胞的再生[21]。本实验的结果也表明,不同浓度IL-22作用于T84细胞后,当处理时间小于6 h时,在基底膜侧检测到的HRP的通过率均小于0.05%,并且T84细胞单层的TER值也均大于1 000 Ω/cm2。但当处理时间大于6 h时,随着时间的延长TER值逐渐下降并且HRP通过率逐渐增高,因此可以说明当作用时间较短时IL-22不会破坏上皮细胞的完整性。当IL-22的浓度继续增加时,各组T84细胞单层的TER值也会继续下降,并且各组的HRP通过率也会继续增加,因此说明IL-22也可以造成肠黏膜屏障的受损,并使其通透性明显增加。但当IL-22的浓度大于100 ng/ml时,继续增加IL-22浓度之后可以发现TER值略有回升,HRP的通过率反而略有下降,因此可能说明较高浓度的IL-22反而可以发挥修复肠黏膜细胞完整性的作用。IL-10是Treg细胞分泌的重要的抑炎因子之一。IL-10可以维持肠道黏膜屏障的完整性,协助肠道益生菌改善肠黏膜炎症反应,并防止IBD过程的发生和恶化[22]。已有动物研究表明当IL-10缺失时可直接损伤肠黏膜屏障,从而导致由Th17细胞介导的自发性的类似于CD的结肠炎的发生[23]。而在本实验中,不同浓度IL-10作用于T84细胞之后,随着时间和浓度的增加TER值及HRP通过率均未发生明显变化。因此可以说明IL-10作用于T84细胞单层后既不破坏肠黏膜屏障的完整性,又不引起肠上皮细胞通透性的增加,这也再次证实了Treg细胞及其相关免疫因子在IBD疾病的发病过程中可能起到保护作用。
综上所述,IL-17和IL-22在一定浓度范围内可以增加T84细胞单层所模拟肠黏反而膜屏障的通透性,并且随着IL-17和IL-22这两种因子作用时间的延长和作用浓度的增高,T84细胞单层通透性的破坏也会越来越明显。但IL-10因子并不引起T84细胞单层通透性发生变化。由于Transwell细胞跨膜培养系统在体外模拟肠黏膜屏障的局限性,并且有关Th17/Treg免疫平衡在T84细胞单层模拟的肠黏膜屏障通透性的具体作用机制仍不完全清楚,因此期待其他动物试验甚至是人体体内肠黏膜试验等更多的后续实验对此进行更加深入的研究。
