体外冲击波治疗大鼠肌筋膜疼痛及其机制初探*
2018-08-20沃春新徐正涛于子龙张忠杰
沃春新 徐正涛 秦 乐 于子龙 张忠杰 陆 巍 姚 旌 王 林△
(1贵州医科大学附属医院疼痛科,贵阳550001;2贵州医科大学麻醉系,贵阳550001)
骨骼肌是人体最大的器官,约占体重的40%。随着年龄的增加、不良的生活习惯及社会因素等导致肌筋膜病变成为人体发生疼痛的常见原因。流行病学调查显示85%的疼痛门诊病人都涉及到肌筋膜疼痛[1]。目前被广泛接受的发生机制主要是Simons 在对“能量危机假说”补充修正后提出的“激痛点综合假说”。治疗上除传统医学、非甾体药物、痛点阻滞等疗法外,近年来体外冲击波在治疗肌筋膜疼痛也取得了良好的临床疗效。但对于体外冲击波治疗MPS的机制上国内外较少报道。故本实验拟通过建立MPS大鼠模型,采用体外冲击波治疗,观察局部病理组织改变、肌电图变化、热痛阈的改变及脊髓组织nNOS、SP、5-HT、β-EP的表达。初步对体外冲击波治疗MPS大鼠的疗效及机制进行探讨,为临床治疗MPS提供理论依据。
方 法
1.动物与分组
成年健康SD大鼠24只,体重300~350 g,由贵州医科大学动物实验中心提供。按随机数字表法将大鼠随机分为三组:C组、M组和S组,每组各8只。C组不进行任何干预措施,正常饲养(室温下,颗粒饲料饲养,持续喂养),M组造模完成后正常饲养,S组于造模后治疗。
2.MPS模型制备
本课题组以改良后韩蓓的方法,已经成功复制出大鼠MPS模型。方法:1% 戊巴比妥钠溶液(北京索莱宝生物科技有限公司,批号:20150326)3 ml/kg行腹腔麻醉。大鼠仰卧、固定,自制重量为1 000 g的木质打击器,自20 cm的高度自由下落,打击右侧股内侧肌,造成局部钝挫伤。打击接触面积约为1 cm2,皮肤无破损。第2、3天,将大鼠放置于-16°电动跑台(四通道WI32812,东西仪科技有限公司)上下坡跑(速度16米/分)持续90 min,采用声和电驱赶大鼠以保证效果,后休息4天,以此方法连续干预8周。
3.体外冲击波治疗
造模后正常饲养4周,同上述麻醉方法后S组大鼠右股内侧肌处涂抹适量耦合剂后行冲击波治疗(瑞典storz MP100 冲击波治疗仪),用F15探头0.16 mJ/mm2,300次,1.3 Hz,每5天一次,连续治疗3次后正常饲养。
4.检测指标
(1)肌电图:分别于T1、T2时点测肌电图(T1实验第12周,即模型复制完成时,T2:实验第16周,即S组治疗后第3周)。方法:将麻醉后大鼠,仔细寻找右股内侧肌部位紧张带,用肌电图仪(海神医电 SN:ME 098)电极针缓慢插入紧张带处,缓慢移动电极针约每次1 mm,至肌电图显示出自发电活动时,记录下发生频率。
(2)热痛阈:分别于T1、T2时点测热痛阈。用热板实验法,热平板温度为 52 ± 0.2℃,将大鼠置于热平板上,记录大鼠自接触平板到抬起后爪或舔后爪的时间间隔。测量时间不超过45 s,以免造成组织损伤。连续测量3次,每次间隔时间大于20 min,取平均值做为热痛阈值。
(3)病理形态学检测及免疫组化法检测脊髓nNOS、SP、5-HT、β-EP:1%戊巴比妥钠3 ml/kg腹腔麻醉后右侧股内侧肌肉,行4%多聚甲醛固定。石蜡包埋、切片、HE染色,光镜 200 倍下观察肌纤维的形态、 排列等变化。麻醉后大鼠,暴露心脏,将动脉套管针自左心室插入升主动脉,固定套管针,于右心耳处剪一小口,灌注4%多聚甲醛固定液100 ml固定。灌流后取大鼠脊髓L4-6腰膨大浸泡于4%多聚甲醛固定液中,置于4℃冰箱过夜保存。常规固定、脱水、石蜡包埋,4 µm切片后予以3%过氧化氢灭活,1:100兔抗鼠一抗4℃孵育过夜,后山羊抗兔二抗室温孵育30 min, 加SABC试剂20 min,二氨基联苯胺 (DAB) 显色,期间用PBS缓冲液冲洗,而后脱水、透明、封片。光镜观察切片,200倍视野下随机选取4个,用数码显微镜下摄片,阳性细胞率计数,取平均值。
5.统计学方法
所有统计数据,采用 SPSS 19.0 统计软件进行统计学处理分析,符合正态分布的计量资料用均数±标准差(x±SD)表示,两组均数的比较用单因素方差分析,计数资料采用卡方检验,P< 0.05为差异有统计学意义。
结 果
1.肌电图
T1时,C组无自发电活动,因此放电频率显著低于M组和S组(P< 0.01);M组和S组均见频发的自发电活动,但两组比较差异无统计学意义;T2时,M组仍见频发自发电活动,但S组自发放电频率与M组相比显著降低(P< 0.01,见表1)。

表1 三组大鼠右股内侧肌自发电活动、热痛阈的比较(n= 8,x±SD)Table1 Spontaneous electrical activities of right vastusmedialis muscle and thermal pain threshold in three groups (n= 8,x±SD)
2.热痛阈
T1时,M组和S组热痛阈值与C组比显著缩短(P< 0.01),M组和S组比较差异无统计学意义;但T2时S组热痛阈时间延长(P< 0.01,见表1),说明冲击波可以缓解大鼠的肌肉痛。
3.脊髓组织nNOS表达
nNOS 阳性染色为胞浆棕黄色。图像分析结果显示:与C组比较,M组nNOS显著升高(P< 0.05),而S组的nNOS较M组明显下降(P< 0.05,见表2和图1)。

表2 脊髓NOS、SP、5-HT、b-EP表达(n= 8,x±SD)Table2 Comparison of the expression of nNOS, SP and 5-HT in spinal cord between three groups (n= 8,x±SD)
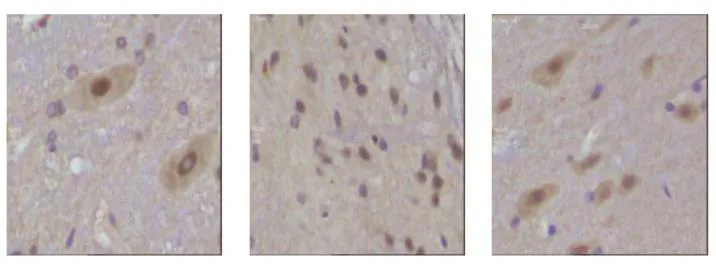
图1 大鼠脊髓nNOS 表达A:C组;B:M组;C:S组。标尺 = 50 µmFig.1 The expression of nNOS in the spinal cordA: Normal, group C; B: Model, group M; C: Shock wave, group S.Bar = 50 µm.
4.脊髓组织SP表达
与C组比较,M组大鼠脊髓SP 表达显著升高,而S组大鼠脊髓SP 显著低于M组,差异均有统计学意义(P< 0.05,见表2和图2)。
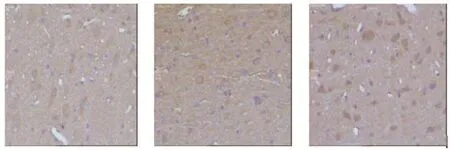
图2 大鼠脊髓 SP 表达A:C组;B:M组;C:S组。标尺 = 50 µmFig.2 The expression of SP in the spinal cordA: Normal, group C; B: Model, group M; C: Shock wave, group S.Bar = 50 µm.
5.脊髓组织5-HT表达
三组大鼠脊髓5-HT 阳性表达无差异(见表2和图3)。

图3 大鼠脊髓 5-HT 表达A:C组;B:M组;C:S组。标尺 = 100 µmFig.3 The expression of 5-HT in the spinal cordA: Normal, group C; B: Model, group M; C: Shock wave, group S.Bar = 100 µm.
6.脊髓组织b-EP表达
三组大鼠脊髓b-EP的表达无差异(见表2和图4)。
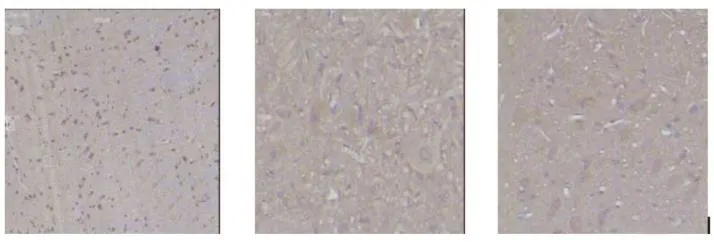
图4 大鼠脊髓 b-EP表达A:C组;B:M组;C:S组。标尺 = 100 µmFig.4 The expression of β-EP in the spinal cordA: Normal, group C; B: Model, group M; C: Shock wave, group S.Bar = 100 µm.
7.病理形态学改变
C组大鼠肌肉纵切面显示肌纤维紧密并规律,粗细均匀,细胞核多分散于肌纤维膜下且规则。M组大鼠肌肉组织纵切面肌纤维呈现粗细不同、排列紊乱及不同程度的粘连,并炎性细胞浸润现象。S组横切面可见肌纤维形态接近正常,但有少量不同程度的肌纤维轻微萎缩及变性(见图5)。
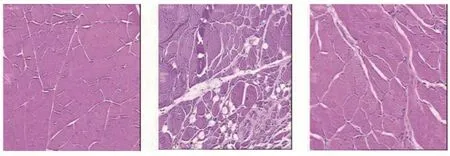
图5 右股内侧肌HE染色A:C组;B:M组;C:S组。标尺 = 200 µmFig.5 HE staining of right vastusmedialis muscleA: Normal, group C; B: Model, group M; C: Shock wave, group S.Bar = 200 µm.
讨 论
肌筋膜疼痛综合征 (myofascial pain syndromes,MPS) 是以慢性肌肉疼痛且伴有一个或多个激痛点(trigger points,Trps) 为主要特征的常见软组织疾病,是原发于肌肉、筋膜等结缔组织且以颈肩腰背痛为特征的综合征,主要因肌肉和筋膜无菌性炎症而产生局部黏连挛缩而引起长期疼痛,迁延不愈。MPS到目前为止还没有统一的诊断标准和治疗方案。本实验参照韩蓓[2]大鼠MPS动物模型的制作进行改良,大鼠经打击加运动损伤后出现频发右股内侧肌自发电活动、热痛阈显著降低,这可能是肌梭异常放电引起的,此类肌梭放电为不正常兴奋的交感神经刺激肌梭内的肌纤维收缩所致;组织病理学可见模型组大鼠肌肉组织纵切面肌纤维呈现粗细不同、排列紊乱及不同程度的粘连,并炎性细胞浸润现象、梭形结节等,这与赵贞研等[3]关于大鼠肌筋膜疼痛激痛点的研究一致,进一步证实MPS模型制备成功[4]。
目前临床上针对肌筋膜激痛点的治疗如注射局麻药、口服非甾体抗炎药、应用肌肉松弛药、物理疗法和针刺疗法等方面却难以取得长时程的治疗效果[5]。况且药物的相关副作用及注射治疗的创伤性,很多病人难以接受或不能依从。自1980年Chaussy[6]用体外冲击波治疗肾结石后,体外冲击波的治疗范围逐渐从碎石、治疗骨折不愈合、康复治疗等转向慢性疼痛治疗领域,并因其治疗的操作简单、无创、不良反应小、效果显著等方面得到广泛认可。体外冲击波疗法作为一种非侵入性的物理治疗方法逐渐被用于MPS治疗中。而关于其对MPS的治疗机制上却很少报道。在本实验中,经体外冲击波治疗后大鼠组织病理切片中横切面可见肌纤维形态与正常肌纤维接近;肌电图检查发现频发自发电活动频率明显降低;热痛阈测量时间延长。均是体现体外冲击波对MPS大鼠治疗有效的最直观指标。其治疗机制可能是:由于打击加运动损伤后出现局部肌组织缺血和缺氧可刺激神经血管反应物质的释放,这些物质使传入神经致敏其结果是:一方面损害了局部循环;另一方面是降低肌纤维组织的氧耐量,从而加重肌纤维的损害形成恶性循环,最终产生能量的代谢危机[7,8],形成紧张性肌纤维。多个紧张性肌纤维形成紧张性索条,即激痛点。而冲击波是一种机械波,沿其传播的方向引起介质压缩与膨胀,在交界面处产生机械应力,从而引起软组织间的弹性变形、松解;另一方面可以促进血管扩张,刺激血液循环和促使新的组织形成,同时刺激血管内皮细胞产生的NO(氮氧化物)也有血管扩张作用,增强胶原物质合成,帮助肌腱的恢复[9]。其他相关报道:体外冲击波的机械效应与推拿作用类似,都可以松解粘连,降低肌张力,另外ESWT的空化效应可以进一步促进微循环;化学效应能够促进抑制疼痛物质的释放[10]。体外冲击波在治疗早期骨关节疾病、肌腱末端疾病以及糖尿病性溃疡等疾病中都有独特的治疗优势,特别是在软组织疼痛治疗中,对肌肉、肌腱、肌腱附着点及筋膜处有明显的缓解疼痛及松解作用。Silvia Ramon[11]认为:冲击波能够对痛觉神经感受器的刺激,改变了感受器对疼痛的接受频率及其周围化学介质的组成,抑制神经末梢细胞,使神经冲动无法传递,因此可缓解局部肌组织的疼痛。
此外,我们在本实验中还发现冲击波治疗不仅能对外周肌筋膜起到镇痛及缓解作用,还对脊髓水平神经递质有一定影响。首先Mense认为肌筋膜扳机点产生的外周伤害性刺激信号不断向中枢神经系统传入,若相同或不同的骨骼肌上存在多个肌筋膜扳机点或肌筋膜扳机点持续存在能激活脊髓神经元和脊髓以上的脑结构。Kuan 等人发现在引起脊髓背角神经元可塑性变化方面肌筋膜激痛点与脊髓之间的连接比正常组织(非肌筋膜激痛点)更有效,并且是与大量伤害性感受神经元或小的感觉神经元之间发生连接[12]。氧化氮是机体重要的信号分子,在细胞、神经信息传递、血压调节以及免疫活性中起重要作用。然而当NOS促使NO生成过多,就成为引起神经变性失调和神经病理性痛的基本原因之一。一氧化氮NO已被证明是体内重要的致痛信号物质。一氧化氮是由 L-精氨酸和氧经过多步氧化还原反应生成,一氧化氮合酶是其生成的关键酶。NOS对疼痛的调控部位主要集中在脊髓背角的I和II层。在脊髓水平,炎症等伤害性刺激可影响脊髓背角合成和释放一氧化氮, 而使用基因剔除术或NOS阻断剂,可阻镇痛觉过敏的形成;NO升高在福尔马林大鼠致痛模型中起着致痛的作用。NO可能参与腰椎间盘突出所引起的神经根性疼痛, 腰椎间盘突出症病人脑脊液中NO代谢产物含量明显升高。在大鼠髓核移植模型的实验中,术后1周移植的髓核组织NOS阳性细胞明显增多,并且热痛觉敏感性变化在此时最明显,表明产生于移植椎间盘组织的NO可能与热痛觉过敏有关, 临床上应用NO抑制剂或拮抗剂治疗腰椎间盘突出所引起的神经根性疼痛也许会有好的疗效[13]。本实验研究显示:经过体外冲击波治疗MPS的大鼠,其脊髓nNOS水平显著低于模型组大鼠,从而提高大鼠痛阈,减轻疼痛,这可能是其镇痛治疗机制之一。
脊髓背角浅层是将外周来源的伤害性信息及上位脑结构发出的下行调节信息进行综合处理的重要区域,也是下行抑制系统实现其镇痛效应的主要部位。研究结果表明:在多种慢性疼痛中,SP作为疼痛递质通过感觉神经传入纤维向上传递至脊髓中枢,参与疼痛在脊髓中枢的传导和调制。SP作为神经递质在疼痛的感觉传递和镇痛机制中发挥着重要作用,大剂量时可直接引起感觉神经元兴奋,导致痛觉过敏。SP样阳性纤维丰富地分布在脊髓背角的I、Ⅱ层,随C或Aδ 纤维转运至脊髓背角释放,传递伤害性信息,作为痛觉信息的主要指标。胡国兴等[14]发现大鼠左侧后爪足底切口可增加同侧脊髓背角SP样免疫反应。夏智群等[15]在大鼠右后足注射甲醛2h后发现脊髓背角I、II层SP免疫阳性物表达明显增强。本实验中,M组SP 显著升高,S组大鼠脊髓SP 低于M组。提示体外冲击波治疗可降低脊髓背角SP的释放,从而抑制伤害性刺激的传入,对MPS大鼠起到镇痛作用。
单胺类物质是神经递质的一大分支,包含5-HT、多巴胺和NE,其中5-HT 同时又为致痛物质。现代医学认为,在劳损和外伤情况下,导致颈肩部软组织充血的炎症性反应,逐渐造成炎性粘连和纤维组织的增生。在病变过程中,小血管受炎症反应的影响,导致血管痉挛及5-HT和P物质等释放,这些物质可以引起疼痛感觉,加剧软组织的损伤和疼痛[16]。但我们实验结果显示5-HT指标各组间均数的差异无统计学意义。表明体外冲击波治疗对MPS大鼠脊髓水平5-HT无影响。
β-EP广泛存在于垂体中,是一种内源性的类似吗啡作用肽类物质,对中枢神经系统具有广泛的镇痛作用,可以调节伤害性感受器,若水平下降,可造成机体痛觉过敏而产生疼痛, 并同时诱导P物质的释放,使疼痛加剧[17]。Smith等[18]报道神经损伤的慢性疼痛小鼠在损伤后2、4、14 d损伤侧脊髓内脑啡肽的表达比对侧及对照组降低, 并且在损伤后14 d最明显。本实验结果三组大鼠脊髓背角β-EP的表达无统计学意义。因个别MPS大鼠脊髓β-EP较高,可能与动物个体差异有关,希望在下一次的研究中进一步加大样本量,能否得出更加全面、精确的结果。
综上所述,体外冲击波可以通过降低病变肌筋膜自发电活动、提高痛阈值、促进损伤肌筋膜的修复发挥治疗作用,其机制可能与降低脊髓nNOS及SP水平有关。
