垂直束带式胃减容术改善肥胖不育雄鼠生育力模型研究
2018-08-06李佳静王炎秋卞崔冬万晓东
李佳静,王炎秋,卞崔冬,万晓东,相 俊
1.上海交通大学医学院教学辅助中心,上海 200020;2.同济大学附属同济医院生殖医学科,上海 200065;3.同济大学附属同济医院泌尿外科,上海 200065
国际卫生组织2015年的数据表明,成年人中有23亿超重和7亿肥胖[1]。随着不健康的饮食行为和久坐的生活方式的日益普遍,肥胖已成为非胰岛素依赖性糖尿病、高血压、心血管疾病、癌症以及相关代谢和生殖的重要危险因素。肥胖对女性生育的影响众所周知,包括月经失调、无排卵、多囊卵巢综合征、流产风险增加和受孕率降低[2]。有证据表明,肥胖同样损害男性生育能力[3],表现为精液质量差,勃起功能障碍或性激素紊乱[4]。肥胖患者脂肪细胞的大小增加,使促炎性因子分泌增加[5],并减少胰岛素敏感性相关的脂肪因子—脂联素的分泌。推测脂肪细胞肥大可能因为微环境改变导致下丘脑的炎症反应,抑制了下丘脑Kisspeptin/GnRH/Kiss1信号轴的作用,从而使下丘脑介导的生殖调节紊乱[6]。
垂直束带式胃减容术是病态肥胖最常用的手术治疗方法,但如果饮食习惯没有改变,高脂肪饮食(HFD)有关的生育功能受损仍将继续存在。本研究通过创建HFD诱导的肥胖大鼠模型,评估垂直束带式胃减容术对造模雄鼠生育力的影响。垂直束带式胃减容术可能通过抑制睾丸和下丘脑对HFD的代谢异常反应,从而逆转HFD所致的生殖功能损伤。
1 材料与方法
1.1 试验动物
8周龄雄性SD大鼠购自SLAC上海实验动物有限公司,并分别置于通风笼中,恒温24~26 ℃的温度和湿度,以及12 h光照/12 h黑暗周期。大鼠可饮用自来水,喂食60%HFD(Research Diets,SLAC试验动物有限公司),持续16周以诱导肥胖。对照大鼠喂食对照饮食(CD)。所有动物均按照国立卫生研究院关于和使用实验动物的指南进行治疗。动物试验获同济大学附属同济医院试验动物许可证,经同济大学附属同济医院伦理委员会批准并备案。
1.2 手术造模
16周龄雄鼠,根据lee’s指数筛选出肥胖大鼠作为肥胖组。分为假手术对照HFD组和HFD + SG组,每组15只。手术由减肥外科医师进行[7]。步骤如下:术前禁食24 h,4%七氟烷麻醉,切开从胃窦到胃底和腺胃的前胃大弯,大约90%前胃和70%的胃腺,然后用聚二氧杂环己酮缝合线封闭切口,0.5 mL 0.25%布比卡因减少术后疼痛,术前、术后立即给予生理盐水支持治疗,必要时予丁丙诺啡0.5 mg/kg止痛,术后24 h观察伤口吻合情况,常规流质饮食3 d,然后再恢复HFD喂养8周。每周称重,见图1。
1.3 性激素测定
在24周测定性激素。 用免疫分析试剂盒检测睾酮、雌二醇(E2)、促黄体生成素(LH)和促卵泡激素(FSH)。
1.4 精子功能评估
将附睾与小鼠睾丸和附睾尾分开,解剖并置于预热至37 ℃的Tyrode’s缓冲液使精子分散。15 min后,用计算机辅助精子分析、测定精子活力、运动性和精子密度。 对于畸形精子症分析,将精子沉淀在载玻片上,干燥后,固定载玻片,按照试剂盒说明书操作,通过Diff-Quick染色,光学显微镜观察精子畸形情况。每个样本分析200个精子。
1.5 统计学分析
正态分布的计量资料采用均数±标准差。数据分析采用GraphPad Prism 5.0软件,用t检验来评估组间差异,P<0.05为统计学显着性差异。
2 结果
2.1 垂直束带式胃减容术使HFD大鼠体质量下降,血糖增加,胰岛素抵抗增加
给雄性SD大鼠喂CD或HFD 16周。然后将HFD大鼠分为接受垂直束带式胃减容术或假手术的亚组,然后再恢复饲喂8周(图1)。HFD 16周的大鼠体质量显著高于CD组,(812.6±22.15)g对(498.8±22.73)g (P<0.001)。垂直束带式胃减容术后8周,HFD大鼠的体质量显着低于假手术的HFD组大鼠,但仍显著高于CD组大鼠(图2)。

图1成功造模肥胖不育SD雄性大鼠(左侧为造模鼠,右侧为正常鼠)
Fig.1Successfulestablishmentofobesity-inducedmaleinfertilityinSDratsmodel(left:modelrat,right:normalrat)
2.2 垂直束带式胃减容术改善性激素水平和精子功能
从附睾尾部提取的精子分析显示,活力和前向运动(图3)均显著低于CD组。结果提示,垂直束带式胃减容术可以逆转精子功能。组间的精子浓度没有显著差异(图3)。 HFD组的精子畸形率高于CD和HFD+SG组,CD和HFD+SG组差异无统计学意义(P>0.05)(图3)。以上结果说明,垂直束带式胃减容术改善了精子质量并提高了生殖能力。
图2对高脂鼠进行垂直束带式胃减容术(A),其体质量明显下降(B)
CD为正常对照组,HFD为高脂造模组,HFD+SG为接受手术减重组
Fig.2Theeffectsofsleevegastrectomy(A)ontheweightofrats(B)
CD:thechowdietratgroup;HFD:thehigh-fatdietratgroup;HFD+SG:thehigh-fatdietratgroupwithsleevegastrectomy
HFD大鼠的血清雌二醇[(8.08±0.22) pg/mL]显著高于CD组[(4.44±0.42) pg/mL,P<0.001]。手术使肥胖大鼠雌二醇水平下降,与CD组相比差异无显著性,血清睾酮显著高于CD组[(1.19±0.15) ng/mL比(2.38±0.61) ng/mL,P<0.001],LH亦明显高于CD组[(0.64±0.11) ng/mL比(0.96±0.23) ng/mL,P<0.05]。术后,睾酮和LH水平与CD组无显著差异。 FSH水平在三组间差异无统计学意义(图4)。
3 讨论
肥胖已成为一种全球性的流行病,并且是包括男性不育症在内的不良健康结果的原因[8-9]。报道认为,肥胖对精液和血清性激素水平有一定影响[10],但肥胖导致男性生育功能损伤的原因尚不清楚。本研究通过对16周HFD诱导的雄性大鼠肥胖模型,研究肥胖型男性生殖功能障碍的发病机制。进一步通过垂直束带式胃减容术和额外的8周喂食HFD,研究肥胖的影响。垂直束带式胃减容术大鼠,与假手术组相比,体质量明显下降,血脂水平显著改善。
内分泌失调是肥胖的另一个典型特征,伴随着脂肪组织积聚,血清总睾酮,游离睾酮,LH,FSH水平下降,雌二醇(E2)水平升高,与文献报道结果一致[11]。雌激素的增加引起GnRH降低,抑制LH和FSH分泌,并降低睾酮分泌和精子形成[12]。本研究发现,垂直束带式胃减容术不仅减轻了HFD大鼠的体质量,同时降低了E2的表达,精子的特征变化证实了肥胖与男性生育力之间的关系。垂直束带式胃减容术可逆转肥胖相关的精子活力下降和前向运动。 CD,HFD和HFD+SG三组间精子浓度没有差异,这与之前在人类[13]和小鼠中的研究一致。垂直束带式胃减容术逆转了肥胖相关的畸精症的发生率,表明炎症反应在男性不育中起重要作用。在该模型中,肥胖导致睾丸炎症反应,包括巨噬细胞浸润增加和炎性因子表达,认为肥胖通过刺激巨噬细胞募集和活化促进睾丸炎症,最终导致精子质量下降和精子生育能力受限。
下丘脑中枢神经系统是生殖功能的调节中枢,通过下丘脑-脑垂体-性腺(HPG)轴实现。男性生殖功能的调节是由下丘脑分泌的GnRH刺激脑垂体分泌促性腺激素,在后者的作用下,睾丸分泌雄性激素和产生精子。Kisspeptin是GnRH神经内分泌系统的内源性调节剂[14],Kisspeptin在前脑的弓状核和前腹侧室旁核(AVPV)中大量表达。雌二醇和睾酮调节弓形核和AVPV中的Kiss1基因表达。然而,雌二醇和睾酮下调弓形核中的Kiss1 mRNA表达,却在AVPV中上调其表达。弓状核中的Kisspeptin神经元可能参与负反馈调节的促性腺激素分泌。Kiss1和GPR54 mRNA在青春期时显着增加,表明kisspeptin信号转导为青春期发作的神经内分泌事件。kissl在调节青春期和生育能力方面发挥作用,kissl失活降低了生育力,并且与小鼠中的不育表型相关。本研究同时发现,肥胖引起的生殖障碍也可能与下丘脑损伤有关。在本研究的HFD模型中,STAT3激活促进肥胖大鼠中的M2小胶质细胞/巨噬细胞极化,其介导下丘脑的神经炎症反应,抑制了Kiss1的表达。故认为,肥胖通过促进M2小胶质细胞/巨噬细胞极化在下丘脑中产生炎症,最终导致抑制Kiss1表达和生殖障碍的炎症反应,垂直束带式胃减容则逆转此结局。
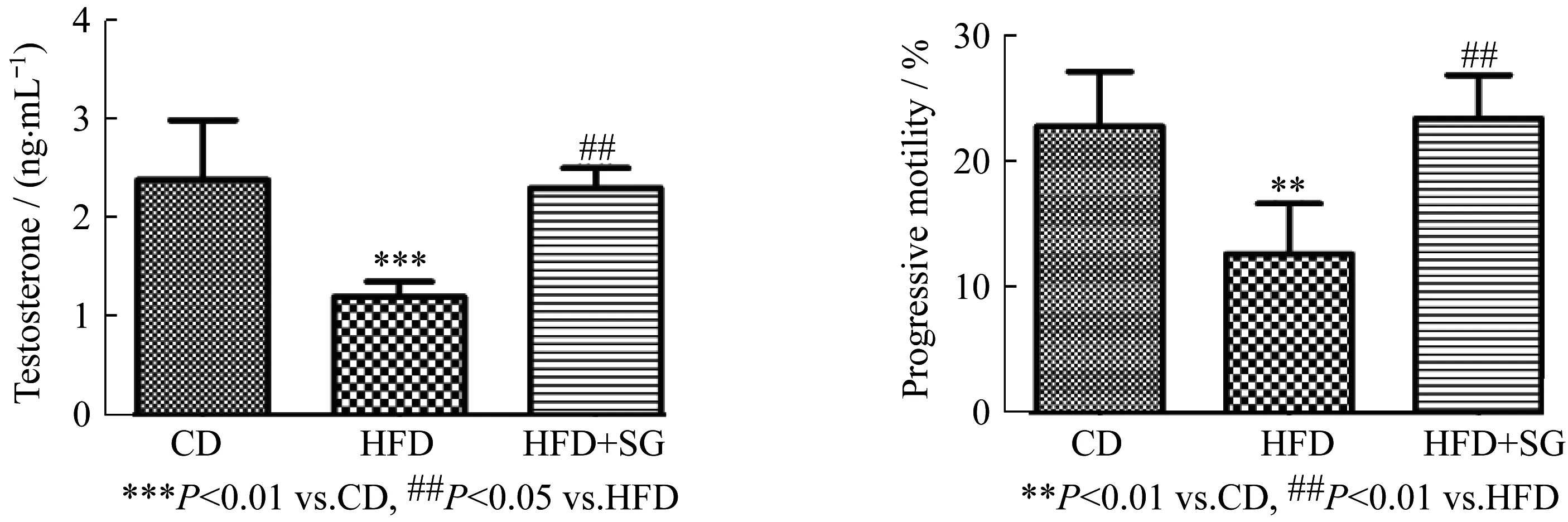
图3 对高脂鼠进行垂直束带式胃减容术后,生殖功能明显改善,雄激素水平升高(左图),精子活力增加(右图)
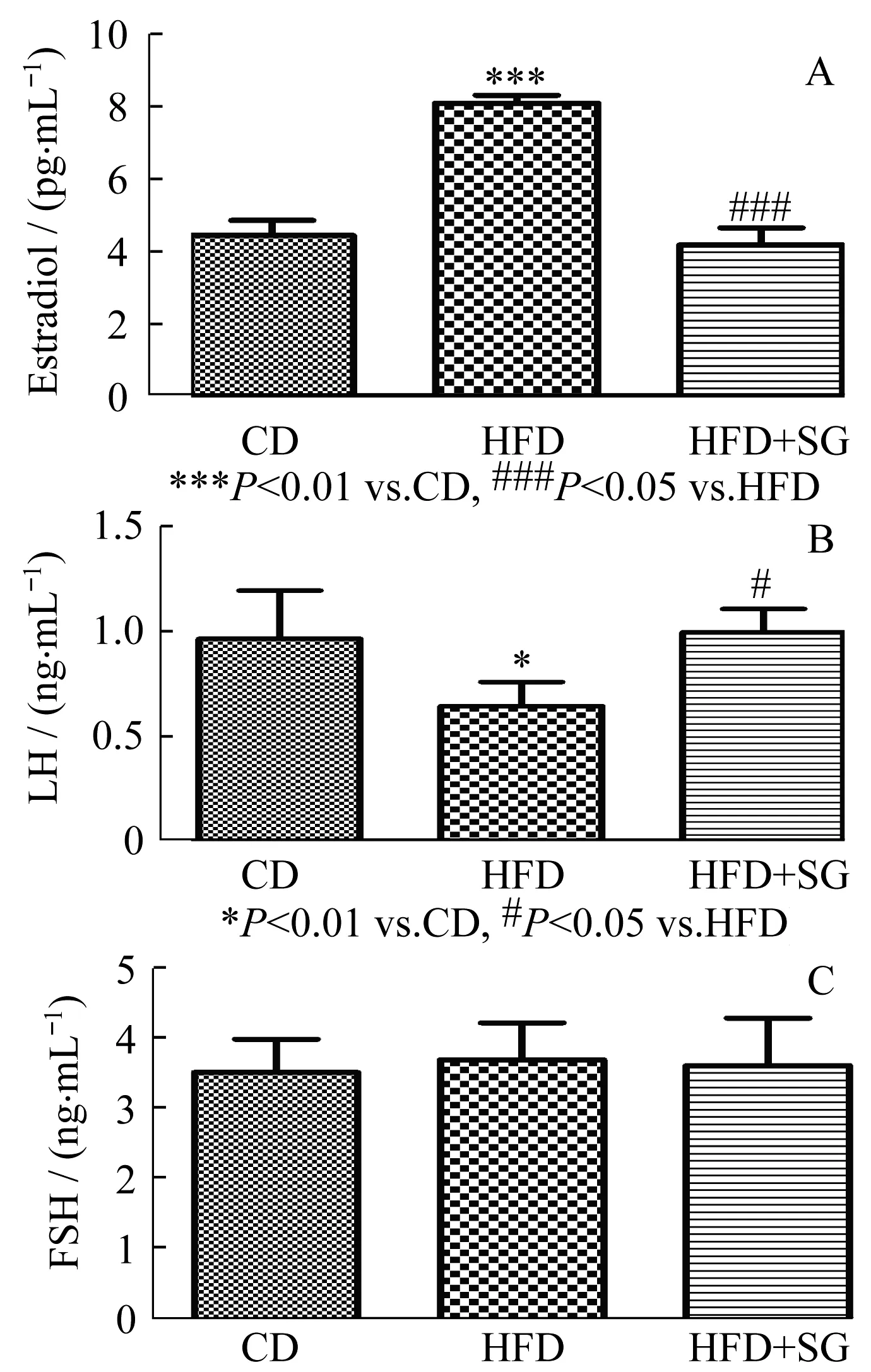
图4高脂饮食型肥胖对生殖内分泌激素存在复杂的调控机制,升高E2(A),降低LH(B),FSH无明显作用(C)
Fig.4Thecomplexeffectsofhigh-fatdietinducedobesityonreproductiveendocrinehormones,includingincreasingE2(A),decreasingLH(B),andnoeffectonFSH(C)
HFD诱导的肥胖导致生殖力受损,垂直束带式胃减容术不仅可以减肥,并且逆转肥胖引起的生殖障碍,从而为临床肥胖型男性生殖疾病的临床治疗提供新的思路。
