意大利生菜转化体系建立及EV71抗原基因表达初探
2018-08-02张同林艾佐佐刘艳梅刘旺喜
罗 雯,张同林,艾佐佐,刘艳梅,刘旺喜
(南昌师范学院生物系,中国江西南昌 330032)
由于农作物易于转化,可提供廉价的蛋白质源,所以农作物作为植物反应器生产生物产品的研究与应用,受到越来越多的科研机构和商业公司的关注。然而,在研究过程中尚有许多问题有待解决:烟草组织中含有大量的生物碱[1],不宜作为口服疫苗,且从烟草中分离纯化目的蛋白的成本较高[2];马铃薯虽是比较理想的转化试材,但不适合生食;番茄为可生食蔬菜,但果实成熟后易腐烂;用胡萝卜制备肺结核疫苗时,抗原在种子中含量较高,但在可食用的块根中含量却很低[3,4]。
生菜(Lactuca sativa L.var.ramosa Hort.)正好规避了上述缺点。生菜为菊科(Asteraceae)莴苣属(Lactuca)下的一个变种,富含维生素C和多种矿质元素,是一种食用价值较高的蔬菜类群;同时,该类群具有易繁殖、生长周期短、适宜栽培地广、栽种条件简单等特性;而且,重组蛋白在该类群叶片中可被稳定表达,不需要高温处理即可通过消化途径被人体或动物机体有效吸收,种子可长期保存[5~7]。因此,生菜已作为植物生物反应器被应用于植物转基因工程中。
生菜离体再生的成功报道首见于1967年,成功转基因于1987年实现[8],目前该研究主要集中于生菜子叶离体转化再生的条件以及导入外源基因的表达探索。邓小莉等[9]通过农杆菌介导的叶盘法将融合基因O21-O14-A21-HBcAg转入美国大速生生菜,并成功地整合到生菜基因组中,为口蹄疫疫苗的制备提供了研究资料。敬军等[10]利用生菜成功构建了含有gap-gp120基因的转基因植株,并证明外源基因已整合到北京生菜基因组中。年洪娟等[11]将胸腺肽基因导入大速生,为胸腺肽的生产提供了一条经济有效的新途径。同样以大速生为试材,中国研究者还构建获得了转基因防龋生菜,并已验证了T3、T4代转基因植株的稳定性[12,13]。
意大利生菜是生菜的一个培养品种,相对其他基因型,该作物品种更有生长周期短、一年四季可收获的优势[14]。这些特性使意大利生菜在口服疫苗等外源蛋白质的表达方面更具有独特的优势。因此本研究在前期工作基础上,进一步分析了在添加合适的抗生素后,诱导抗性愈伤组织和抗性芽分化的最佳植物生长调节剂浓度;并利用此转化体系初步探索了在生菜中共表达肠道病毒71型(Human enterovirus 71,EV71)P1和3CD基因的可行性。
EV71是小核糖核酸病毒科(Picornaviridae)内的无包膜单链RNA病毒,病毒基因组由含有P1、P2和P3区的单个开放阅读框组成。P2和P3区域编码负责病毒复制和毒力的非结构蛋白质(例如3CD),而P1区域编码P1前体,可被3CD蛋白酶切割成VP0、VP1和VP3,这3种蛋白质自发地组装成二十面体衣壳,包裹RNA基因[15],完成病毒装配。体外表达的P1前体也可被3CD蛋白酶切割,并自发组装成二十面体衣壳,形成病毒样颗粒(virus-like particle,VLP)。VLP不含病毒核酸,但引起的免疫应答强度与真实病毒刺激的差异很小,是较理想的一种疫苗形式。相比微生物和动物生物反应器,利用植物生产的口服疫苗优势明显,如低成本、良好的安全性、贮存和运输便利、可有效刺激黏膜免疫应答等[16,17]。因此,利用植物转基因制备EV71 VLP有望提供一条更加经济、有效、安全地制备EV71新型疫苗的新途径。本研究为进一步研制基于EV71 VLP的手足口病新型口服疫苗提供了重要的理论和实践依据。
1 材料与方法
1.1 材料
1.1.1 植物材料
1.1.2 菌种及质粒
对照植物基因偏性密码子优化GenBank中的EV71 P1基因(GenBank:EU812515.1),同时参照GenBank中的EV71 3CD基因序列(GenBank:EU812515.1),设计合成EV71 P1基因和3CD基因,分别克隆入植物表达载体pCAMBIA2301,构建重组双元植物表达载体pCAMBIA2301-P1-3CD(结果待发表)。农杆菌(Agrobacterium tumefaciens)LBA4404由本实验室保存。
1.1.3 主要试剂
抗生素:利福平(rifampicin,Rif)、卡那霉素(kanamycin,)、羧苄青霉素(carbenicillin,Carb)、头孢霉素(cefotaxime,Cef)、安美汀(augmentin,Aug)等,均购自生工生物工程(上海)股份有限公司。
植物生长调节剂:6-苄基腺嘌呤 (6-benzylaminopurine,6-BA)、萘乙酸(naphthylacetic acid,NAA),均为国产分析纯。
1.2 意大利生菜子叶转化体系选择剂浓度筛选
以MS培养基为基础培养基,添加浓度为0.5 mg/L的6-BA和0.2 mg/L的NAA作为意大利生菜子叶愈伤组织诱导培养基[14],在此培养基基础上添加Kan配制选择培养基,Kan浓度设为0 mg/L、25 mg/L、50 mg/L、75 mg/L、100 mg/L、150 mg/L。于25℃光照培养箱中培养,观察愈伤分化情况。实验重复3次。
1.3 意大利生菜子叶转化体系最佳抑菌剂的选择
在确定了适宜Kan浓度之后,于上述选择培养基中添加不同抑菌剂,分别为Carb:0 mg/L、100 mg/L、200 mg/L、300 mg/L、400 mg/L;Cef:0 mg/L、100 mg/L、200 mg/L、300 mg/L、400 mg/L;Aug:0 mg/L、200 mg/L、400 mg/L、1 000 mg/L、2 000 mg/L。用pCAMBIA2301-P1-3CD冻融法[18]转化LBA4404,即液氮速冻5 min后28℃温浴5 min,28℃复苏5 h后选择培养获得转化子。转化成功的农杆菌菌液浸染生菜无菌苗子叶,共培养3 d后转入添加抑菌剂的选择培养基,25℃光照培养箱中培养,观察愈伤分化情况。实验重复3次。
1.4 抗性愈伤组织诱导植物生长调节剂浓度筛选
用重组农杆菌LBA4404浸染转化无菌意大利生菜子叶,共培养3 d后,转接至以MS培养基为基础培养基,添加有选择剂Kan(50 mg/L)和抑菌剂Carb(400 mg/L),同时含有不同浓度6-BA与NAA的筛选培养基进行愈伤组织的诱导。观察子叶愈伤组织的生长状况以确定抗生素对最佳诱导植物生长调节剂浓度的影响。实验设6-BA浓度0.1 mg/L、0.2 mg/L、0.3 mg/L、0.4 mg/L、0.5 mg/L,NAA 浓度 0.05 mg/L、0.1 mg/L、0.15 mg/L、0.2 mg/L,进行全面实验,重复3次。
1.5 抗性植株的选择培养
将愈伤组织诱导选择培养基上生长良好的抗性愈伤组织转接到添加有Kan 50 mg/L和Carb 400 mg/L的MS培养基,培养基中附加0.25 mg/L 6-BA和0.2 mg/L NAA,进行芽的诱导[14]。培养4周后,将长势良好的抗性芽转接入添加Kan 50 mg/L和Carb 400 mg/L的MS培养基,诱导生根。
1.6 转化植株的DNA鉴定
参照崔学强等[19]的研究方法,适当改良,直接取抗性植株叶片进行PCR检测。切取数个约2 mm2的叶片,放入含 200 μL 0.3 mol/L NaOH的 Eppendorf管中,于沸水煮30 s后取出,添加200 μL 0.3 mol/L HCl和 100 μL 0.5 mol/L Tris-HCl(pH 8.0),再次于沸水中煮3 min,挑取经此法处理的一小片叶片作为PCR模板。参照EV71 P1和3CD基因序列设计扩增引物,分别为3CD-F:5′-CTGTTGGAAAGGTTATCGG-3′,3CD-R:5′-TAGACCAGAATGTGTCAGG-3′,P1-F:5′-AGAGTATGTTATTGGAACAGTG-3′,P1-R:5′-GCAATGAGCATCTTTCCAG-3′。PCR退火温度为55℃。以pCAMBIA2301-P1-3CD质粒为模板,设置PCR扩增阳性对照;以未转化生菜叶片为模板,设置阴性对照;1%琼脂糖凝胶电泳检测PCR产物。
1.7 转化植株叶片的Western-blot分析
参照文献的方法[20]提取总蛋白质,并检测蛋白质产物的活性,蛋白质提取缓冲液为0.2 mol/L Tris-HCl(pH 7.0)。取 0.1 g叶片,加入 50 μL 提取液,冰浴研磨后,10 000 r/min离心10 min,取上清重复离心1次。取制备的总蛋白质提取液15 μL进行SDS-PAGE和Western-blot分析,操作步骤参照生工生物工程(上海)股份有限公司Westernblot试剂盒(No.C620392)使用说明,经封闭液封闭后,与兔抗EV71 VP1多克隆抗体(生工生物工程(上海)股份有限公司制备)溶液共同孵育,最后与HRP标记的二抗(试剂盒提供)共同孵育1 h,DAB显色。
2 结果
2.1 最佳选择压力和抑菌剂的确定
生菜子叶在含有不同Kan浓度的愈伤诱导分化培养基上,光照培养4周,愈伤分化情况见表1。在添加有50 mg/L Kan的愈伤诱导培养基上,外植体全部枯死(图1),因此该浓度为较严格的筛选浓度。
确定选择压为Kan 50 mg/L后,进一步分析Cef、Carb或Aug作为抑菌剂的效果。光照培养4周后,不同质量浓度的抗生素对生菜子叶愈伤分化的影响以及对农杆菌的抑制效果见图2和表2。Carb浓度达到400 mg/L,农杆菌才能被有效抑制,此时外植体有明显愈伤分化。Aug浓度达到400 mg/L,农杆菌亦可被抑制,但是在浓度达到1 g/L后,才有愈伤分化的迹象,而且效果不如添加400 mg/L Carb的培养基。Cef虽然在200 mg/L即可抑制农杆菌生长,但在本实验设置的各浓度条件下,均未见生菜子叶有愈伤分化迹象。据此,确定抗性愈伤组织筛选培养基中抑菌剂为Carb,质量浓度以400 mg/L为宜。

图1 不同Kan浓度下意大利生菜子叶愈伤分化效果Fig.1 Callus differentiation of Italian lettuce cotyledons under different Kan concentrations
2.2 抗生素对愈伤组织诱导所需植物生长调节剂浓度的影响
虽然在添加合适的选择剂和抑菌剂后,转化的生菜子叶有愈伤分化,但愈伤组织长势不良,且不能在下一步实验中诱导成芽。因此,在添加选择剂Kan(50 mg/L)和抑菌剂Carb(400 mg/L)后,对愈伤组织诱导所需的植物生长调节剂浓度进行了重新筛选,结果见表3。生菜子叶抗性愈伤诱导效果最佳浓度组合为0.4 mg/L 6-BA+0.15 mg/L NAA和0.3 mg/L 6-BA+0.2 mg/L NAA。在后续生芽诱导试验中,源自6-BA 0.3 mg/L+NAA 0.2 mg/L的抗性愈伤组织分化成芽的效果更佳。

图2 添加不同抑菌剂后意大利生菜子叶愈伤分化效果Fig.2 Callus differentiation of Italian lettuce cotyledons under different antibacterial agents
2.3 EV71抗原基因转化植株的分析鉴定
取诱导生根的抗性植株叶片,PCR检测EV71 P1和3CD抗原基因是否成功导入意大利生菜。根据P1优化基因序列设计的引物,扩增产物约770 bp;根据3CD基因序列设计的引物,扩增产物约750 bp。经与pCAMBIA2301-P1-3CD质粒为模板的阳性对照扩增结果比对,检测结果表明在两株筛选获得的抗性植株中成功检出了EV71 P1和3CD基因(图3)。

表1 Kan浓度对意大利生菜子叶愈伤分化的影响Table 1 Effect of Kan concentration on callus differentiation of Italian lettuce cotyledons
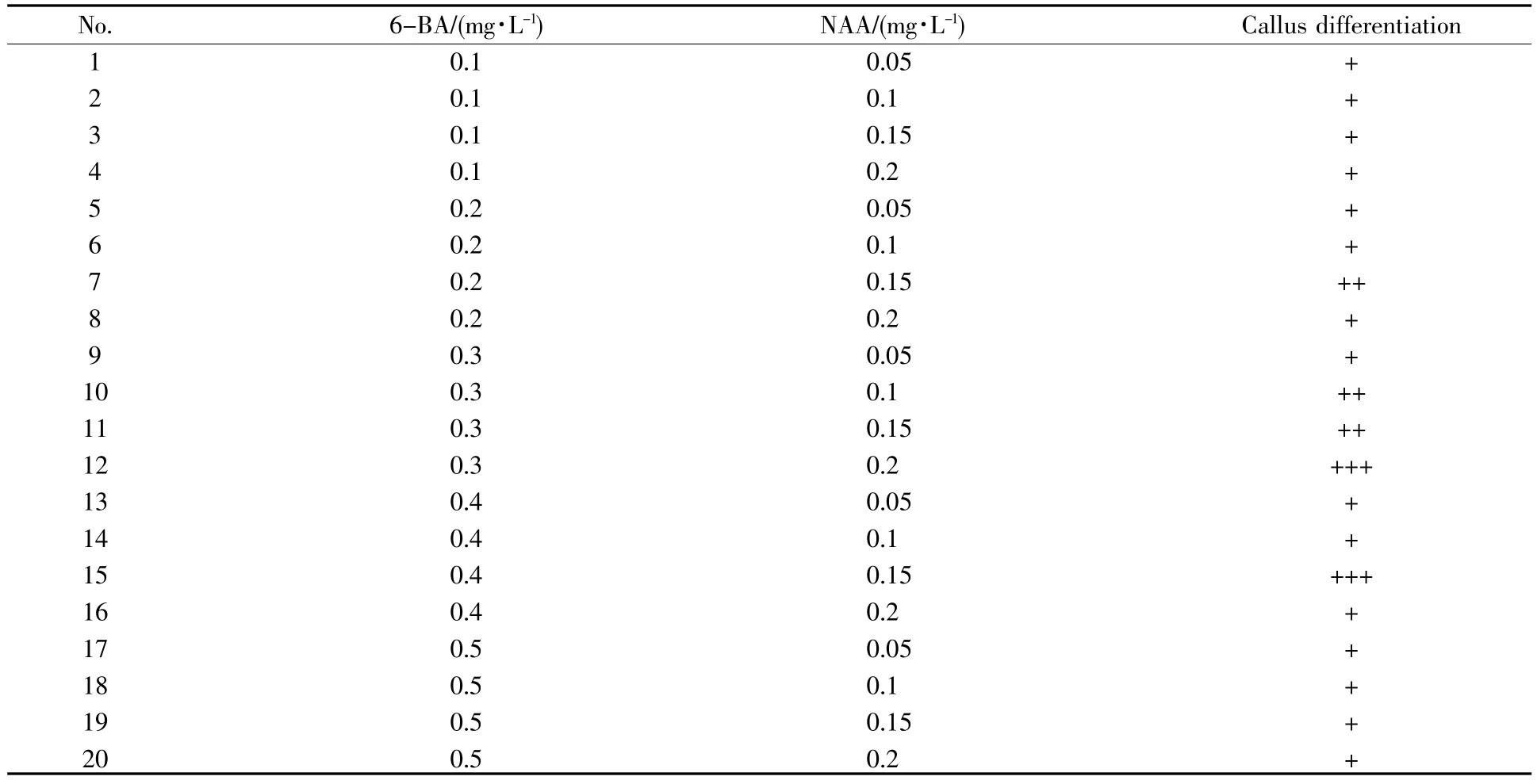
表3 意大利生菜子叶抗性愈伤组织诱导植物生长调节剂浓度的筛选Table 3 Selection of plant hormone concentration for resistant callus differentiation of Italian lettuce cotyledons
图3 转基因抗性植株叶片PCR分析Fig.3 Leaf PCR analysis of resistant plants
提取叶片总蛋白质,对这两株抗性植株进一步检测,蛋白质粗提液的Western-blot结果表明,其总蛋白质提取物可以和兔抗EV71 VP1抗体结合,酶标二抗结合后有显色反应,特异性结合条带在标准蛋白质34 kD和43 kD之间;而未转化的生菜叶片提取物和空载体pCAMBIA2301转化的叶片提取物,均不能和兔抗EV71 VP1抗体结合,Western-blot检测不显色(图 4)。
3 讨论
本实验室前期研究结果显示,意大利生菜子叶愈伤组织诱导最佳植物生长调节剂组合为0.5 mg/L 6-BA和0.2 mg/L NAA[14]。但在本研究中,添加合适的选择剂50 mg/L Kan和抑菌剂400 mg/L Carb后,通过叶盘法转化的生菜子叶却不能在此组合浓度下有效分化产生愈伤组织,推测抗生素的添加可能对愈伤诱导所需植物生长调节剂的量产生了影响。在对6-BA和NAA浓度进行重新组合筛选后,经遗传转化后的意大利生菜愈伤组织诱导有效植物生长调节剂浓度明显降低,最佳浓度组合为0.4 mg/L 6-BA+0.15 mg/L NAA或0.3 mg/L 6-BA+0.2 mg/L NAA,该结果说明抗生素对诱导生菜愈伤组织发生的植物生长调节剂浓度影响较大。有研究认为,青霉素类抗生素在植物生长中有类似于植物生长调节剂的作用[21,22],推测这是导致外植体愈伤分化所需最佳植物生长调节剂浓度下降的主要原因。
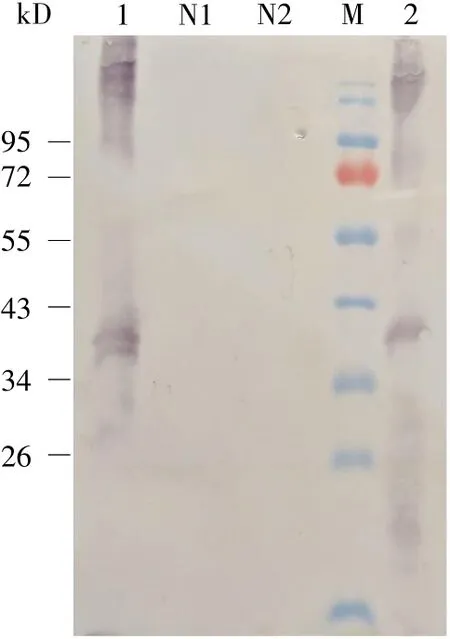
图4 遗传转化生菜叶片的Western-blot分析Fig.4 Western-blot analysis of genetically transformed leaves of lettuce
EV71是手足口病(hand-foot-and-mouth disease,HFMD)的主要病原体之一,C4型是中国主要流行基因型[23]。在EV71预防性疫苗研究中,灭活疫苗、DNA疫苗、减毒活疫苗、表位肽疫苗、亚单位疫苗和病毒样颗粒疫苗是主要的研究方向[24]。VLP是由病毒衣壳蛋白质组装成的空颗粒,没有病毒核酸,因此可以降低潜在的副作用。同时,病毒抗原和VLP表面上的表位的重复、高密度展示通常引起强烈的免疫应答,与真实病毒刺激的差异很小,是目前较为理想的一种疫苗研究形式。EV71病毒基因组中,P1区域编码P1前体,可被3CD蛋白酶切割成VP0、VP1和VP3,这3种蛋白质自发地组装成二十面体衣壳。目前,已有多个研究团队利用杆状病毒-昆虫细胞表达系统成功制备了EV71 VLP,初期研究结果表明,共表达P1和3CD装配获得的VLP明显多于共感染分别表达P1和3CD的杆状病毒[25];此后的EV71 VLP表达研究多采用这种共表达策略,都获得了预期表达产物[26~28]。动物实验表明,接种异源表达的EV71 VLP可刺激产生中和抗体[29~31];显著抑制病毒在多种组织中的增殖[32]。各项研究充分证明了EV71 VLP作为疫苗备选的可行性,但严格的培养条件和表达量低成为制约利用细胞培养生产EV71 VLP的重要瓶颈[33]。相比之下,植物生物反应器低成本、高安全性、易贮存等优点,使得利用植物转基因制备EV71 VLP有望提供一条更加经济、有效、安全地制备EV71新型疫苗的新途径。
基于此,本研究借助前期构建的EV71 P1和3CD两个基因的双元植物表达载体,通过农杆菌介导的叶盘法转化意大利生菜子叶,获得了转基因抗性植株。对叶片PCR检测阳性植株的表达产物进一步开展Western-blot分析,结果显示,表达产物中可特异性结合EV71 VP1抗体的蛋白质介于34 kD和43 kD之间,与文献报道的VP1(39 kD)大小[34,35]相近。虽然Western-blot结果中,遗传转化株的泳道均出现了相似的非VP1大小蛋白质条带,但实验中阴性对照始终没有任何可结合蛋白质条带出现,推测为前体蛋白质未切割或不完全切割所致,并非生菜叶片固有蛋白质。在多个系统中的表达研究均显示,当P1前体被3CD蛋白酶正确切割后即可成功装配出VLP,研究多以VP1的检出为评价指标[25,26,34,35]。因此推断,EV71 P1和3CD基因在生菜叶片中同步表达,3CD蛋白酶可将P1前体正确切割,具备包装产生VLP的可能性,且蛋白质表达产物具有生物学活性。
下一步,本实验室将在大量获得转基因植株叶片的基础上,提取纯化相关大小的蛋白质产物,进一步开展EV71 VLP的电镜检测和免疫学实验,对VLP装配效率和表达产物的免疫活性作出评价,为研制基于EV71 VLP的手足口病新型口服疫苗提供充足的理论和实践依据。
