长链非编码RNA的作用机制
2018-08-02史欢欢史文珍高莉洁韩楠楠汤利荣
史欢欢,李 斌,史文珍,赵 宁,陈 霞,高莉洁,何 芳,韩楠楠,汤利荣,田 晔*
(1.西安市第三医院神经内科,中国陕西西安 710016;2.延安大学医学院,中国陕西延安 716000;3.汉中市中心医院药剂科,中国陕西汉中 723000)
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200个核苷酸、缺乏完整开放阅读框、不编码蛋白质的RNA转录本[1]。截止2018年1月12日,NONCODE数据库收录人类基因组已注释的172 216种lncRNA转录本(http://www.noncode.org),数量远超过蛋白质编码基因。目前,lncRNA的研究覆盖免疫系统、神经系统等多系统及疾病的病理生理过程,已成为生物医学研究的热点。本文将从表观遗传学、转录、转录后水平对lncRNA在病理生理过程中的作用机制做一综述,并探讨目前lncRNA研究中存在的问题。
1 lncRNA的概述和分类
lncRNA广泛分布于细胞质和细胞核中,主要来源于蛋白质编码基因中断、染色质重组、非编码基因复制反移位产物、非编码RNA内部相邻片段重复以及基因中插入转座因子[2]。多数lncRNA由RNA聚合酶Ⅱ转录,可经过剪接、5′端加帽及3′端多聚腺苷酸化加工[3,4]。研究显示,lncRNA的表达呈现出组织特异性和时空特异性,即不同组织之间lncRNA的表达量不同;而同一组织或器官的不同发育阶段,lncRNA的表达量也不同。lncRNA不编码蛋白质,序列保守性低,一度被认为是基因转录的“噪音”或RNA聚合酶的“副产品”,不具备生物学功能。但随着相关研究的深入,lncRNA众多功能被发现,其在基因转录、剪接、蛋白质翻译、蛋白质定位、干细胞多能性、细胞结构完整性、热休克反应及人类疾病中发挥着重要的作用[5]。而近些年的研究发现,部分lncRNA可编码微肽,参与生物体生命活动[6]。
根据lncRNA与蛋白质编码基因的关系,可将其分为基因间型lncRNA(intergenic lncRNA)、反义型lncRNA(antisense lncRNA)、内含子型lncRNA(intronic lncRNA)、正义型 lncRNA(sense lncRNA)及双向型lncRNA(bidirectional lncRNA)5种(图1)[2,7];而根据lncRNA在分子机制中的作用,可分为信号分子(signal molecule)、诱捕分子(decoy molecule)、引导分子(guide molecule)和骨架分子(scaffold molecule)4 种(图 2)[8]。
2 lncRNA的作用机制
2.1 lncRNA在表观遗传学水平调控基因表达
2.1.1 lncRNA调控DNA甲基化
DNA甲基化是经典的表观遗传学机制。在真核细胞中,CpG岛胞嘧啶的嘧啶环上,DNA甲基转移酶转移甲基到胞嘧啶的第5个碳原子上,形成5-甲基胞嘧啶,通常表现出抑制基因转录[9]。DNA甲基化在维持基因组稳定性、调节染色质结构、X染色体失活等过程中发挥重要的作用[9]。研究发现,lncRNA在调控DNA甲基化方面呈现出双向性,即lncRNA既可以促进DNA甲基化的发生,又可发挥去甲基化的作用。促进DNA甲基化的lncRNA,如lncRNA Xist,其招募多梳蛋白抑制复合体2(polycomb repressive complex 2,PRC2)至X染色体,可使X染色体上CpG岛启动子甲基化,抑制X染色体上基因的表达[10]。而去甲基化的lncRNA,如lncRNA H19,可通过抑制DNA甲基化甲基基团的供应,从而阻断DNA甲基转移酶介导的DNA甲基化修饰[11]。
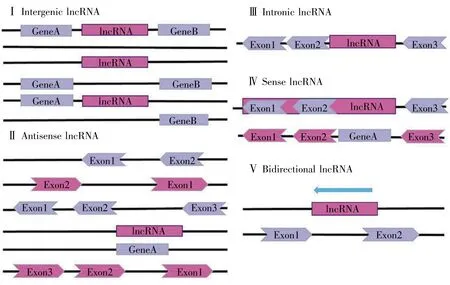
图1 lncRNA的分类(根据与蛋白质编码基因的位置关系,由文献[7]加工而来)Fig.1 Classification of lncRNAs based on the positional relationship between lncRNAs and protein-coding genes(pro原cessed from reference[7])
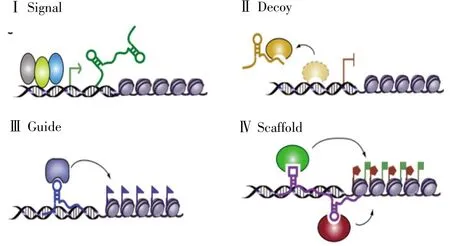
图2 lncRNA的分类(根据lncRNA在分子机制中的作用)[8]Fig.2 Classification of lncRNAs based on the role of molecular mechanisms[8]
2.1.2 lncRNA调控组蛋白修饰
生物的组蛋白以八聚体的形式与DNA序列形成核小体,其氨基末端向外游离,可被众多因子修饰,如乙酰化、甲基化和磷酸化等,继而动态调控不同位点基因的表达[12]。
lncRNA可介导组蛋白发生不同类型的修饰以调控基因表达。如lncRNA Xist募集PRC2至X染色体,除了使CpG岛启动子发生甲基化外,还可使组蛋白H3第27个氨基酸发生三甲基化(H3K27me3),从而引发整条X染色体失活[13]。Wan等[14]在毛细血管扩张性共济失调综合征患者中发现,lncRNA-JADE转录激活HBO1组蛋白乙酰化复合体的关键元件Jade1,继而诱导组蛋白H4发生乙酰化;而干扰lncRNA-JADE的表达后,Jade1转录下调,组蛋白H4乙酰化修饰也减少。这表明lncRNA-JADE可通过调节Jade1的转录表达继而调控组蛋白H4的乙酰化修饰。
2.1.3 lncRNA调控染色质重塑
真核生物的染色质呈高度折叠的致密结构,不利于RNA聚合酶、转录因子等接近染色质上的DNA,触发基因转录。因此,生物在进化过程中产生了相应的染色质重塑机制,通过对染色质结构进行动态修饰而提高RNA聚合酶、转录因子等在染色质DNA上的可接近性。染色质重塑主要包括核小体转位和染色体成环[15]。
核小体是染色质的基本功能单位。核小体转位是指核小体发生移动、隔离、替代和重组,使核小体处于合适的位置或浓度,从而在核小体之间形成更易转录的DNA区。Yu等[16]发现,linc-RAM可介导SWI/SNF重塑复合体与染色质结合,使核小体发生转位,继而促进肌分化相关基因转录。酿酒酵母中,染色质来源的lncRNA可与RNA结合蛋白质的同源体Seb1结合,Seb1募集SHREC复合体,使核小体发生转位,抑制基因转录[17]。SWI/SNF重塑复合体、SHREC复合体都是依赖分解ATP产生的能量使核小体发生转位。
染色体成环是染色质空间结构的改变,即染色质上处于不同位点的远近基因“成环”,从而使基因的转录更为高效。增强子RNA归属于lncRNA,是由增强子转录而来,可调控其靶基因形成染色体环。如在人类结直肠癌中,增强子CCAT1-L可以与染色质结构维持蛋白质CTCE结合,继而促进MYC基因启动子与增强子远程相互作用,增加MYC基因的表达[18]。lncRNA介导的染色体成环,影响短时及组织特异性基因的表达。
2.2 lncRNA在转录水平调控基因表达
lncRNA在转录水平对基因的调控具有多样性。Yu等[16]发现,linc-RAM可与MyoD基因的启动子结合,发挥增强子活性,继而增加MyoD转录表达。而Lai等[19]发现,ncRNA-a的增强子活性是由蛋白质复合物Mediator所介导。这表明lncRNA不仅可直接发挥增强子活性,还可协作复合体间接发挥增强子活性。除此之外,研究还发现lncRNA可通过影响转录因子活性来调控基因转录,如lncRNA Evf-2可特异性与转录因子Dlx-2结合,增加Dlx-5/6基因的转录活性[20]。近期研究发现,lncRNA SRG1与SER3基因启动子区域重叠,SRG1发生随机核小体沉积,隔离RNA聚合酶Ⅱ与SER3基因的结合,使SER3转录受到抑制[21]。lncRNA在转录水平对基因表达的调控,可靶向基因转录过程的不同环节,形成包括转录相关复合体、转录因子、RNA聚合酶等的复杂调控网络,精细调控基因表达。
2.3 lncRNA在转录后水平调控基因表达
lncRNA在转录后对基因表达的调控主要涉及mRNA水平、miRNA(microRNA)水平以及蛋白质水平。
研究显示,真核生物体蛋白质的数量是蛋白质编码基因数量的4倍[22]。其主要原因在于蛋白质编码基因转录后形成的前体mRNA(pre-mRNA),在翻译为蛋白质前需经过可变剪接(alternative splicing,AS)过程。AS是指通过不同的剪接模式将一个pre-mRNA剪接成多个mRNA异构体[23]。AS极大增加了mRNA的丰度,以承担生物体众多生命活动。lncRNA可通过影响剪接因子的活性,继而影响可变剪接过程。丝氨酸/精氨酸剪接因子是真核细胞重要的剪接因子,其经磷酸化获得活性后,可参与多种pre-mRNA的AS过程。肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)可调控丝氨酸/精氨酸剪接因子磷酸化-去磷酸化水平,进而影响pre-mRNA的剪接[24]。而另有研究发现,在AS过程中,lncRNA MALAT1还可作为骨架分子,募集剪接因子至pre-mRNA,从而引发剪接过程[25]。MALAT1是AS的重要调控因子,干扰MALAT1的表达或活性将显著影响机体AS过程[26]。
lncRNA也可通过STAU1(Staufen1)介导的mRNA降解途径来调控mRNA的丰度。RNA结合蛋白质STAU1识别mRNA 3′非翻译区(3′-untranslated region,3′-UTR)的 Staufen 结合位点(Staufen binding site,SBS)并募集UPF1(up-frameshift protein 1)至mRNA,引发mRNA的降解[27]。研究发现,一些1/2-sbsRNAs(half-STAU1-binding site RNAs)可通过其序列中的ALU元件与mRNA 3′-UTR的ALU元件非完美配对形成SBS,为STAU1提供结合位点,引发mRNA降解[28]。1/2-sbsRNAs中可包含多个ALU元件,可同时与多个mRNA的ALU元件结合,引发多个mRNA的降解;而1/2-sbsRNAs与mRNA ALU元件的非完美配对,也可使不同的1/2-sbsRNAs介导同一mRNA的降解。需要指出的是,虽然1/2-sbsRNAs介导的mRNA降解可以有效地调控mRNA丰度,但1/2-sbsRNAs并不能介导所有3′-UTR含有ALU元件的mRNA发生降解。
lncRNA在miRNA水平对基因表达的调控主要通过miRNA“海绵”的方式实现。miRNA是一类长度在20~22 nt范围内的非编码RNA,其可与Argonaute蛋白、核苷酸内切酶Dicer等组成RNA诱导沉默复合体(RNA-induced silencing complex,RISC),通过识别mRNA中的miRNA反应原件与mRNA结合,切割mRNA,从而使其降解[29]。研究发现,部分lncRNA序列中存在miRNA反应原件,可与RISC中的miRNA结合,继而去除RISC对mRNA的降解。如linc-MD1结合miR-133和miR-135,去除miR-133和miR-135对转录因子MAML1和MEF2C mRNA的降解作用,促进MAML1和MEF2C介导的肌分化基因的转录[30]。由此可见,lncRNA序列中可含有多个miRNA反应原件,可同时调控多个基因的表达。
lncRNA还可影响蛋白质功能的表达。研究发现lncRNA Gas5可与糖皮质激素受体的DNA结合域结合,竞争性阻止糖皮质激素与其受体的结合,影响糖皮质激素受体的功能表达[31]。lncRNA除本身可与蛋白质反应外,相关研究更是发现少数lncRNA可编码微肽,参与机体的生命活动。如上述的linc-RAM,其可编码一段由46个氨基酸组成的微肽myoregulin,特定表达于骨骼肌,通过调节Ca2+负荷而调控骨骼肌收缩[32]。
3 lncRNA研究中存在的问题
目前,lncRNA的研究虽已广泛开展,但仍存在一些问题:1)lncRNA的定义需要更新。lncRNA普遍被接受的定义为,一类长度大于200个核苷酸、不编码蛋白质的RNA。该定义中,200个核苷酸的界限主要用于将已知的短非编码RNA(如tRNA,miRNA等)从非编码RNA中区分,因此用大于200个核苷酸来定义lncRNA过于武断。其次,随着质谱蛋白质组学、深度RNA测序和核糖体分析等技术的应用,一些lncRNA被发现含有隐性开放阅读框[4],存在编码蛋白质的可能。除此之外,Williamson等[33]发现,ASCC3 short mRNA修复紫外线辐射所造成基因损伤的功能是由其序列中的非蛋白质编码序列所承担,该非蛋白质编码序列符合目前的lncRNA定义,即ASCC3 short mRNA作为lncRNA发挥功能。由此可见,mRNA与lncRNA的定义也需要进一步区别。综上所述,目前lncRNA的定义不够准确,需要更新;2)lncRNA命名缺乏统一原则。目前文献中出现的lncRNA,多由科研工作者按照功能、来源等命名,没有统一的命名原则,既不方便整理,也不方便科研工作者之间的交流;3)lncRNA的作用机制具有多样化和特异性强的特点,且其本身序列的保守性低,使得不同lncRNA研究方法之间借鉴意义不高;4)目前的研究发现,多种蛋白质存在RNA结合域,lncRNA可能主要受到RNA结合蛋白质的调节[34]。随着交联免疫共沉淀(cross-linking immunoprecipitation,CLIP)等技术的应用,越来越多RNA结合蛋白质已经得到注释并组建成数据库,未来的研究需要对数据库的数据进行分析和加工,形成与lncRNA反应的RNA结合蛋白质图谱,为lncRNA进一步的机制剖析提供便利;5)lncRNA功能的发挥主要依赖于其特定的RNA结构域与特定蛋白质的反应[34]。解析lncRNA的RNA结构域有利于进一步认识lncRNA的分子机制。但由于细胞内核糖核蛋白对RNA结构域有影响,而目前的技术尚不能获取核糖核蛋白的晶体结构[34],因此lncRNA的RNA结构域研究存在挑战;6)比较基因组学、共表达分析等生物信息学方法的应用为lncRNA功能预测提供了发展方向,但尚处在探索阶段,因此系统解析lncRNA功能的相关研究仍任重道远。
4 展望
lncRNA作为一大类非编码RNA,具有重要的生物学功能,参与多种疾病的病理过程,并在部分疾病发生发展过程中扮演着生物标记物的角色,对疾病的诊断、治疗及预后评估具有参考价值[35]。目前,该领域的研究逐渐深入,但由于lncRNA的作用机制复杂,其研究仍面临诸多挑战。未来lncRNA的研究还需创新研究方法和开发更为先进的研究技术,以期能够形成系统的研究体系,进一步阐明其精确的分子机制,为临床相关疾病的诊治提供思路。
