功能性lncRNAs在鼻咽癌研究中的进展
2018-08-02周刘颖张鹏飞
周刘颖,张鹏飞
(中南大学湘雅医院国家卫健委肿瘤蛋白质组学重点实验室,中国湖南长沙 410008)
鼻咽癌(nasopharyngeal carcinoma,NPC)是头颈部最常见的恶性肿瘤之一,具有明显的地域倾向,在世界范围内罕见,但是在北非、东南亚和东亚,尤其是中国广东,发病率特别高[1]。鼻咽癌是一种有高度转移和侵袭倾向的上皮癌,早期即可发生淋巴结转移,多数患者发现时已至晚期[2,3]。目前,鼻咽癌主要依靠其独特的临床和病理特征来诊断。在治疗上,鼻咽癌对放疗和化疗敏感[4]。尽管放疗和化疗在治疗鼻咽癌上取得了各种进展,但并没有显著提高鼻咽癌患者的5年生存率[5]。鼻咽癌的频繁复发和较差的预后对于临床来说仍然是巨大的挑战[6]。如何提高晚期鼻咽癌患者的生存率和改善患者生活质量是当今医学界的关键问题,此外,对于鼻咽癌患者的早期发现和早期治疗是改善预后并提高其治愈率的关键因素。近年来,研究人员发现了许多在鼻咽癌的发生发展过程中起着关键作用的功能性长链非编码RNAs(long non-coding RNAs,lncRNAs),探明这些功能性lncRNAs对鼻咽癌的调控机制,将有助于深入揭示鼻咽癌的发生发展机制,也可为鼻咽癌的早期诊断和早期治疗提供新的思路。
1 lncRNAs概述
人类基因组计划及其后续的DNA元件百科全书计划(The Encyclopedia of DNA Elements Project,ENCODE)研究结果表明,蛋白质编码基因序列仅占人类基因组序列的1%~3%,人类基因组中绝大部分转录的序列为lncRNAs[7]。lncRNAs是一类长度在200~1*10^5个核苷酸(nt)的内源性非编码RNAs,不能翻译成蛋白质[8]。根据lncRNAs所在的基因组位置,可大致分为五类:1)正义lncRNAs;2)反义lncRNAs;3)基因内lncRNAs;4)基因间lncRNAs;5)双向lncRNAs。越来越多的研究表明lncRNAs可以作为分子信号、诱饵、指南、支架或增强子影响基因转录[9~11]。此外,lncRNAs还有突出的生物学功能,例如基因组印记、细胞周期控制、分化调节、多能维持和发育调节[12~15]。这些发现表明lncRNAs可以通过各种机制参与细胞过程。
目前已经证明,lncRNAs在许多癌症中异常表达,如肺癌[16]、肝癌[17]、神经母细胞瘤[18]等,通过调节多种致癌基因或肿瘤抑制基因的表达而参与癌症的发生和进展[19]。现已发现,在大多数肿瘤中,lncRNAs能调节细胞生长、转移和细胞凋亡[20~22],调控机制涉及转录水平、转录后水平或表观遗传水平[23,24]。在影响肿瘤的发生发展过程中,lncRNAs几乎能在每一步的基因表达中起调节作用,主要作用机制有:1)通过DNA甲基化、胞嘧啶的共价修饰和组蛋白修饰来实现对表观遗传的调控;2)通过控制转录的启始和延伸,调控特定基因的转录,加入P53网络来实现对RNA转录的调控;3)通过选择性剪接和miRNA海绵功能来实现对转录后RNA的加工;4)参与蛋白质翻译和翻译后蛋白质修饰。
2 lncRNAs的研究方法概述
lncRNAs的研究主要包括功能性lncRNAs的筛选以及lncRNAs的鉴别、表达验证、体内和体外功能研究、机制研究。lncRNAs的功能和作用机制较为复杂,近年来出现了一系列技术以鉴定lncRNAs及解析RNA结构域、序列、结构和特征[25]。
其中,筛选功能性lncRNAs的方法包括:1)微阵列(microarray)和RNA测序(RNA-Seq),它们是高通量检测lncRNAs表达情况的有效工具;2)基于RNA-蛋白质的相互作用筛选lncRNAs,如:将RNA免疫共沉淀与微阵列(RNA immunoprecipitation chip,RIP-Chip)或测序(RIP-Seq)结合起来、交联免疫沉淀和高通量测序(CLIP-Seq)等。
鉴别lncRNAs的方法有:1)克隆lncRNAs的序列全长;2)预测lncRNAs的编码潜能;3)核糖体富集测定;4)lncRNAs的亚细胞定位,包括:分馏q-PCR和荧光原位杂交(fluorescence in situ hybridization,FISH)。验证微阵列和测序结果的真实性以及检测lncRNAs的表达,可采用的方法有:Northern印迹、qRT-PCR、原位杂交(in situ hybridization,ISH)和 FISH。
研究编码基因在细胞中功能的方法,同样能用在lncRNAs的功能研究中。识别细胞功能的典型方法是调控lncRNAs表达,包括功能丧失和功能增益。功能丧失的方法有:1)利用干扰小RNA(small interfering RNA,siRNA)和短发夹RNA(short hairpin RNA,shRNA)进行RNAi技术;2)反义寡核苷酸(antisense oligonucleotides,ASOs);3)以CRISPR/Cas系统为基础的方法。功能增益的方法主要是过表达特定的lncRNA。
调控基因表达的lncRNAs通常定位于染色质。为明确lncRNAs在染色质上的作用,确定基因组上的lncRNAs结合位点是很有必要的。其中主要方法有:1)RNA纯化的染色体分离-测序(chromatin isolation by RNA purification,ChiRP-Seq);2)RNA靶标捕获杂交分析-测序(CHART-Seq);3)RNA反义纯化-测序(RNA-Seq analysis pipeline,RAP-Seq)。
RNA-蛋白质相互作用的研究可从以下两方面着手:确定lncRNA绑定的蛋白质组;确定RNA-蛋白质-DNA的相互作用。对于前者,可通过结合质谱的RNA色谱法进行;对于后者,其相关的方法较多,具体见表1。
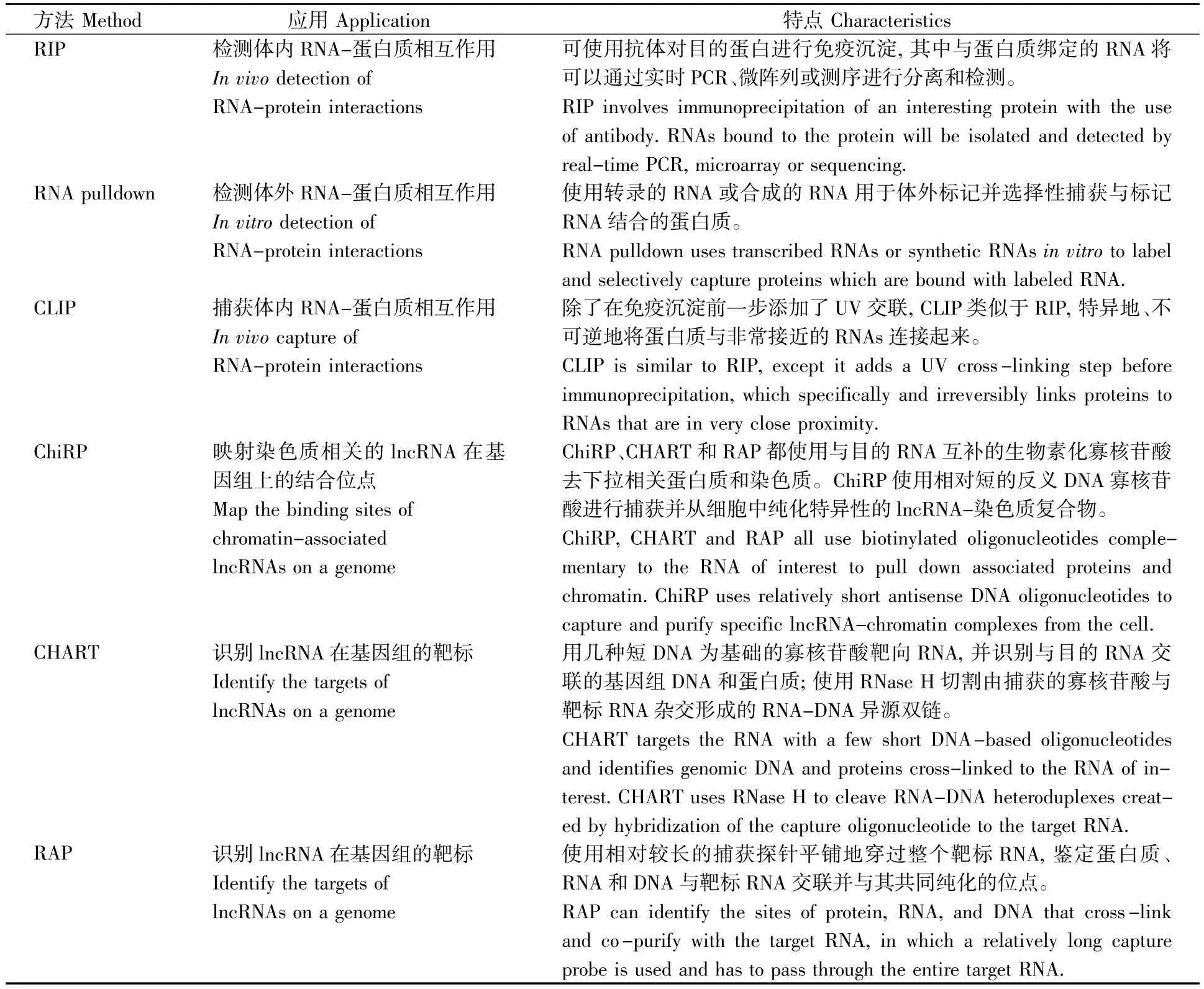
表1 鉴定lncRNA-蛋白质-DNA相互作用的方法Table 1 Methods for identifying lncRNA-protein-DNA interactions
lncRNAs的体内功能研究主要依靠lncRNAs的动物模型,比较常见的主要有:基因工程鼠(genetically engineered mouse,GEM)模型;肿瘤异种移植模型。
3 在鼻咽癌中发挥重要作用的lncRNAs
系统了解lncRNAs在不同细胞类型不同病理条件下的表达情况,筛选差异表达的lncRNAs是研究lncRNAs的第一步。一般来说,过度表达的lncRNAs被称为促癌lncRNAs,而表达下调的lncRNAs称为抑癌lncRNAs。
3.1 在鼻咽癌中发挥促癌作用的lncRNAs
3.1.1 ANRIL
ANRIL(antisense non-coding RNA in the INK4 locus,也称为CDKN2B-AS)是由19个外显子组成的3 834 nt RNA,从位于染色体9p21处的INK4BARF-INK4A基因簇反义链中转录而来。ANRIL最初是从家族性黑素瘤患者中鉴定出来的,之后越来越多的研究表明,它在各种恶性肿瘤中异常表达,如:胃癌、乳腺癌、肺癌、膀胱癌、卵巢癌等。
Zou等[26]研究发现,ANRIL在NPC组织和细胞中表达上调。多变量分析显示,ANRIL的表达可作为总体生存率(P=0.027)和无病生存率(P=0.033)的独立预测因子。ANRIL可以诱导增加侧群体细胞(SP细胞)在NPC细胞中的百分比。ANRIL主要通过两个方面来促进NPC的进展:一是通过调节mTOR信号通路来影响糖酵解中必需基因的表达,重新编程细胞葡萄糖代谢;二是诱导产生侧群干细胞样癌细胞。
有明确的证据表明lncRNAs可作为miRNA的分子海绵,并负调节其表达。Wang等[27]研究发现,在NPC组织和细胞中,ANRIL表达上调而miR-let-7a表达下调。荧光素酶测定显示ANRIL可以负调节miR-let-7a表达。此外,ANRIL的敲低可抑制NPC细胞的致瘤性并通过调节NPC细胞中的miR-let-7a来提高顺铂(cisplatin,CDDP)所致的细胞毒性。
Hu等[28]研究发现,在NPC细胞系中,ANRIL的表达上升但miR-125a的表达下调。作为miR-125a的竞争内源性RNAs(competing endogenous RNAs,ceRNAs),ANRIL敲低可抑制NPC细胞的增殖,诱导其凋亡,增强其放射敏感性;而ANRIL过表达可逆转miR-125a对NPC细胞增殖、凋亡以及放射敏感性的影响。
3.1.2 MALAT1
MALAT1(metastasis-associated lung adenocarcinoma transcript 1,肺腺癌转移相关转录本1)长度大约为8 700 nt,定位于人类染色体11q13.1,属于基因间lncRNAs。其最早是在非小细胞肺癌的研究中被发现,在健康人组织中广泛表达,而在各种肿瘤患者组织中的表达水平更高,如:前列腺癌、膀胱癌、乳腺癌和NPC等。
Jin等[29]研究发现,MALAT1在NPC细胞系和组织中显著上调。MALAT1促进癌症进展,而且MALAT1的相对表达量与患者的整体生存时间呈负相关。体内和体外实验显示,敲低MALAT1可使NPC细胞凋亡增加,使NPC细胞对辐射敏感增强。研究者还发现,MALAT1通过调控肿瘤干细胞(cancer stem cell,CSC)来调节NPC细胞对辐射的敏感性。此外,在MALAT1和miR-1之间存在相互抑制,加上凋亡相关蛋白质slug被鉴定为miR-1的下游靶标。研究者得出,MALAT1可作为miR-1的ceRNAs来调节slug的表达,从而调节CSC活性和放射抗性。
3.1.3 AFAP1-AS1
AFAP1-AS1(actin filament associated protein 1 antisense RNA1,肌动蛋白丝相关蛋白1反义RNA1)位于AFAP1蛋白编码基因的反义链处,AFAP1-AS1第二外显子和AFAP1外显子14、15和16之间有重叠和互补区域。AFAP1是连接到其他蛋白质的分子适配器,调节肌动蛋白丝完整性的变化以及诱导鳞状细胞形成。
Bo等[30]研究发现,AFAP1-AS1表达在NPC中上调,与NPC转移和预后不良有关。体外实验表明:敲低AFAP1-AS1显著抑制NPC细胞迁移和侵袭能力,但是会增加AFAP1蛋白的表达。蛋白质组学和生物信息学分析表明AFAP1-AS1影响几个小GTP酶家族成员和肌动蛋白的表达。以上研究提示,AFAP1-AS1通过调节肌动蛋白丝完整性来促进癌细胞转移。
3.1.4 Hotair
Hotair(HOXtranscriptantisenseintergenicRNA,HOX转录反义RNA)位于人类染色体12q13.13,长度约为2 200 bp。它最早被发现在乳腺癌中高表达,在其他肿瘤中也检测到Hotair的异常上调,如结肠直肠癌、宫颈癌、膀胱癌、肝细胞癌、胃肠道间质瘤和胰腺癌。其高表达与这些癌症的不良预后、进展和复发呈正相关。有研究报道,Hotair是一个标志着NPC进展和存活的独立预后标记[31]。
Fu等[32]研究发现,lncRNA Hotair在NPC细胞和组织中表达上调。进一步的研究表明Hotair敲低可显著减弱体外和体内肿瘤细胞生长和血管生成。此外,Hotair可通过直接激活血管生成因子VEGFA的转录来促进血管生成,也可通过上调GRP78介导的VEGFA和Ang2的表达来促进血管生成。
3.1.5 HNF1A-AS
HNF1A-AS(HNF1A-antisense)位于12号染色体上,长度为2 455 bp。HNF1A-AS最开始被发现,是因为它能调节食管腺癌细胞[33]和肺腺癌细胞[34]的增殖与迁移。Zhuang等[35]研究发现,HNF1A-AS在NPC组织和细胞系中的表达都上调。HNF1A-AS敲低可抑制细胞增殖和迁移能力。裸鼠的皮下移植瘤模型表明,HNF1A-AS敲低可抑制肿瘤生长。细胞周期分析显示,HNF1AAS敲低导致G0/G1期的细胞积累。此外,该研究还发现敲低HNF1A-AS可逆转上皮间充质转化(epithelial-mesenchymal transition,EMT)的过程。
3.1.6 H19
H19位于人类染色体11p15.5,20年前被鉴定为印记基因,最近发现与肿瘤转移相关。H19在多种癌症中表达上调,如胃癌、膀胱癌、胰腺导管腺癌、食管癌、结肠直肠癌和乳腺癌,可影响细胞增殖、凋亡、侵袭和EMT过程。
Li等[36]研究发现,H19在NPC组织和低分化的细胞系中表达上调,敲低H19可显著抑制NPC细胞的侵袭能力。H19可影响zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)的表达,而EZH2在NPC细胞中上调并促进细胞侵袭。进一步研究显示,H19与EZH2不是直接相互作用,而是通过抑制miR-630的活性来调节EZH2表达,miR-630是EZH2的阻遏物并以序列特异性方式与H19相互作用。此外,通过miR-630/EZH2通路,H19可抑制E-钙粘蛋白表达,促进NPC细胞的侵袭。
3.1.7 NEAT1
NEAT1(nuclear enriched abundant transcript 1,核富集的丰富转录本1)已发现在许多癌症中表达上调,包括乳腺癌、前列腺癌、结直肠癌等,并与癌症进展相关。例如,在前列腺癌中,NEAT1能够通过改变靶基因启动子的表观遗传来促进肿瘤进展[37]。
Lu等[38]研究发现,NEAT1在NPC细胞系和NPC组织中显著上调。敲低NEAT1可使NPC细胞对放射敏感。进一步研究发现,NEAT1可通过调节EMT表型来影响放射抗性,而且NEAT1和miR-204之间能相互抑制。此外,ZEB1是miR-204的下游靶标,而NEAT1可通过负调节miR-204的表达来上调ZEB1表达。因此,研究认为:NEAT1通过调节miR-204/ZEB1轴来调控NPC的EMT表型和放射抵抗性。
3.1.8 ROR
ROR长度为2.6 kb,位于染色体18,由4个外显子组成。有研究发现,它在癌症中表达上调并促进肝癌、乳腺癌和神经胶质瘤的进展。例如,ROR对缺氧敏感,它在肝细胞癌中的功能与低氧信号有关,通过miR-145 HIF-1信号模块起作用。ROR通过防止细胞应激通路的活化(包括p53应答),在调节乳腺癌的过程中起关键作用[39]。
ROR与NPC的增殖、转移和凋亡密切相关。Li等[40]研究发现,ROR在NPC组织和细胞中的表达显著上调。其通过影响EMT程序,促进NPC迁移和侵袭。此外,研究还发现:上调ROR,使NPC细胞对顺铂起临界耐药作用,因为ROR可通过p53途径增强NPC抗化疗能力。
3.1.9 EWSAT1
EWSAT1(Ewing sarcoma associated transcript 1,尤文肉瘤相关转录物1)位于染色体15,在NOX5和GLCE两个蛋白质的编码基因之间,最早在尤文肉瘤中研究发现。EWSAT1在尤文肉瘤中表达上调,有致癌的作用[41]。
Song等[42]研究发现,EWSAT1在NPC组织和细胞系中表达上调,EWSAT1高表达的NPC患者,其生存时间明显较短。进一步研究显示,EWSAT1过表达促进了NPC细胞生长,而EWSAT1敲低产生相反的效应。此外,机制分析表明,EWSAT1可作为miR-326/330-5p簇的ceRNAs,调节其表达,靶向细胞周期蛋白D1。以上研究提示,EWSAT1可作为miR-326/330-5p簇的ceRNAs来部分上调细胞周期蛋白D1,从而促进NPC细胞在体外的生长。
3.1.10 CASC9
CASC9(cancer susceptibility candidate 9)位于人类染色体8q21.11,最初被确定为食管鳞状细胞癌相关的lncRNA。
Su等[43]研究发现,CASC9在NPC组织中高度表达,其促进细胞生长并与癌症患者不良预后相关。之前有研究表明,HIF1α通过激活癌细胞糖酵解代谢的靶基因表达,来适应细胞对低氧条件的反应。而CASC9可以与HIF1α相互作用并增强HIF1α的稳定性。此外,过表达CASC9可激活HIF1α,从而促进糖酵解代谢途径和NPC细胞的肿瘤发生。
3.1.11 其他lncRNAs
XIST(X-inactive specific transcript,X灭活特异性转录本)是一种来自XIST基因的lncRNA,被发现在多种肿瘤中表达上调,包括卵巢癌、非小细胞肺癌、胶质母细胞瘤、乳腺癌和肝细胞癌。Song等[44]研究发现,XIST在NPC组织和细胞系中表达上调,XIST高表达的NPC患者,其生存时间明显较短。多变量分析表明,XIST是NPC患者预后的独立危险因素。过表达XIST可促进NPC的细胞生长,而敲低XIST产生相反效应。此外,XIST可作为miR-34a-5p的ceRNAs上调基因E2F3的表达。
LINC01420位于染色体X(p11.21)。Yang等[45]研究发现,LINC01420在NPC组织中的表达水平高于鼻咽上皮组织。此外,高LINC01420表达的NPC患者,其总生存时间明显较短。敲低LINC01420可抑制体外NPC细胞迁移和侵袭。
C22orf32-1位于人染色体22,长度为545 bp。目前,至少有27种疾病与22号染色体相关,尤其是恶性肿瘤包括急性淋巴细胞白血病、慢性髓细胞白血病和恶性横纹肌瘤。Nie等[46]研究发现,C22orf32-1的表达在NPC细胞系和NPC组织中上调。此外,C22orf32-1可以促进NPC细胞的扩散、迁移和侵袭,抑制NPC细胞凋亡。
HULC(highly upregulated in liver cancer)位于人染色体6p24.3,最早从肝细胞癌中鉴定出来。Jiang等[47]研究发现,HULC在NPC细胞系和组织中高表达,HULC的表达与NPC患者的预后呈负相关。过表达HULC可促进NPC细胞生长;敲低HULC可活化p53并诱导增加p21的表达,最终导致细胞周期停滞和细胞凋亡。
LOC100129148位于人染色体7q34,长度为463 bp。Sun等[48]研究发现,LOC100129148在NPC组织和细胞系中表达上调,并且LOC100129148表达较高的患者,其生存时间明显较短。过表达LOC100129148可促进NPC细胞增殖,而敲低LOC100129148则产生相反的效应。此外,LOC-100129148可作为miR-539-5p的ceRNAs,增强KLF12表达。
3.2 在鼻咽癌中发挥抑癌作用的lncRNAs
3.2.1 LET
LET在宫颈癌、胃癌和胆囊癌等癌组织中表达下调,在缺氧环境诱导下,组蛋白去乙酰化酶3(histone deacetylase 3,HDAC3)通过对LET启动子区的组蛋白去乙酰化来抑制LET的表达,致使与LET结合后通过泛素化修饰被降解的核因子90(nuclear factor 90,NF90)稳定存在,NF90可促进癌细胞的侵袭。
Sun等[49]研究发现,LET在NPC组织和细胞中显著下调。LET的表达与临床分期、肿瘤的大小、淋巴结肿瘤负荷呈负相关,与NPC患者生存率呈正相关。过表达LET可抑制NPC细胞增殖,同时诱导细胞凋亡,而敲低LET可产生相反的效应。此外,研究者还发现,LET启动子区的转录被EZH2-介导的H3K27组蛋白甲基化抑制。在NPC组织中,EZH2和LET的表达有显著的负相关。以上结果提示:EZH2通过对 LET启动子区的组蛋白甲基化修饰间接抑制LET的表达。
3.2.2 MEG3
MEG3(maternally expressed gene 3,母体表达基因3)是一个位于染色体14q32内的印迹基因,是NPC中常见的缺失区。
Chak等[50]研究发现,异常启动子甲基化导致MEG3失活。MEG3的异常表达,抑制体外NPC细胞系的生长和体内NPC细胞的致瘤性,并且可以显著抑制细胞增殖、集落形成,还可导致细胞周期的停滞。此外,研究者还发现,MEG3可以激活NPC细胞中的p53通路。
3.2.3 LINC0086
Guo等[51]研究发现,LINC0086的表达在NPC患者血清样本和组织中有所下降。LINC0086高表达的患者有较高的存活率。LINC0086表达与NPC组织学分期、淋巴结转移和临床分期相关。
过表达LINC0086抑制NPC细胞增殖并促进细胞凋亡。研究者在LINC0086的3′UTR中发现了miR-214的结合位点。上调LINC0086可降低C666-1和HK-1细胞中miR-214的表达。研究者还发现LINC0086可以直接与miR-214相互作用以降低miR-214的表达,从而验证了RNA诱导沉默复合体(RNA-induced silencing complex,RISC)中存在miR-214和LINC0086的观点。此外,在体外和体内实验中,过表达miR-214可逆转LINC0086对NPC细胞生长的抑制作用。
3.2.4 LOC401317
Gong等[52]通过建立过表达TP53的HNE2鼻咽癌细胞系,分析lncRNA表达谱发现,有133个lncRNAs上调,而1 057个lncRNAs则下调。在这些异常表达的lncRNAs之中,LOC401317是上调最显著的一个。
进一步的研究表明,LOC401317由p53直接调控,LOC401317的异常表达通过诱导细胞周期阻滞和细胞凋亡,抑制体外和体内的HNE2细胞增殖。LOC401317通过增加p21表达和减少细胞周期蛋白D1和E1的表达来抑制细胞周期进程,并通过诱导聚合酶(ADP-ribose)和半胱天冬酶-3切割来促进细胞凋亡。这些结果表明LOC401317由p53直接调控,并在HNE2细胞中发挥抑癌作用。
4 总结与展望
鼻咽癌是头颈部最常见的恶性肿瘤之一,有高度转移和侵袭倾向,并且有明显的地域分布特征。近年来,研究人员在鼻咽癌中发现了许多异常表达的lncRNAs,且发现这些lncRNAs在鼻咽癌的发生发展过程中起着关键的作用。高通量技术的出现,使得研究人员能够筛选功能性lncRNAs。而之后一系列lncRNAs研究技术的发展,使得研究人员可以深入解析RNA结构域、序列、结构、特征和作用机制。目前的研究虽然揭示了lncRNAs在鼻咽癌中的部分功能,但是其在鼻咽癌中的功能及作用机制仍然需要大量的研究。并且目前已发现的与鼻咽癌有关的lncRNAs只是lncRNAs总数的冰山一角。在之后的研究中,随着技术的不断改进,相信对lncRNAs在分子水平的功能及作用机制的认识将会更为全面和深入,从而为鼻咽癌发病机制的研究以及临床治疗提供新的思路,并有望提供新的预后相关标记物和药物治疗的靶点。
