CAFs的活化机制及其在肿瘤发生发展中的作用
2018-08-02杨力芳
陈 曦,杨力芳,李 丹*
(1.湖南大学生物学院,中国湖南长沙 410082;2.中南大学肿瘤研究所,中国湖南长沙 410008)
肿瘤的发生发展是多阶段、多步骤、多因素等综合作用和发展的过程,受多个基因的精密调控,涉及到肿瘤细胞本身的生物学特性和肿瘤细胞与肿瘤微环境的相互作用等[1]。肿瘤微环境(tumor microenvironment)是一个动态网络,包括肿瘤细胞、间质细胞以及围绕着它的细胞外基质(extracellular matrix,ECM)[2]。间质细胞由许多不同类型的细胞构成,主要包括内皮细胞、周皮细胞、纤维细胞以及多种免疫细胞[3],其中免疫细胞主要包括巨噬细胞、中性粒细胞、肥大细胞、髓系祖细胞以及淋巴细胞[4]。肿瘤细胞和间质细胞均能分泌细胞外基质成分,如纤连蛋白、胶原蛋白、蛋白多糖、糖蛋白、生长因子和基质金属蛋白酶(matrix metalloproteinase,MMP)[5]。这些来自各种细胞的分泌物都能影响肿瘤微环境。此外,上皮和间质细胞间的交流对于肿瘤的发生发展也同样至关重要[6]。
纤维细胞是位于大多数器官结缔组织中具有低增殖能力的梭形细胞,能促进ECM的重塑,从而维持基质的稳定,并确定器官的结构完整性和机械性能[7]。纤维细胞是一种干细胞,它能分化为成纤维细胞(normal fibroblasts,NFs)。肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)位于肿瘤或肿瘤边缘[8],是一种具有多种来源的异质细胞群,其中大部分来源于成纤维细胞,极少数来源于其他细胞,包括间充质干细胞(mesenchymal stem cells,MSCs)、上皮细胞、周皮细胞、脂肪细胞和内皮细胞[9]。肿瘤基质中的CAFs可以根据其形态和特定的识别标志被区分开来。α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)是识别CAFs用的最为广泛的标志[10],成纤维细胞活化蛋白(fibroblast activation protein,FAP)是一种膜蛋白,它在各种类型人上皮癌细胞活化的CAFs中选择性表达[11]。此外,成纤维细胞特异蛋白(fibroblastspecific protein,FSP)、波形蛋白(vimentin)、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)α和β也在CAFs中表达[12]。这些蛋白质在CAFs中的表达量明显高于NFs,是CAFs的标志性分子。这些标记分子没有一个是在CAFs中唯一表达的,而且大多数并非同步表达。CAFs能通过旁分泌或者自分泌的方式分泌一些细胞因子,作用于肿瘤细胞,导致其含有更具攻击性的肿瘤表型。目前认为CAFs可释放生长因子和细胞因子进入血液循环,促进肿瘤细胞的增殖、血管的新生,也可通过改变肿瘤细胞与ECM黏附力,或增加MMPs的表达,促进ECM降解,直接或间接调控肿瘤的发生发展[13]。同样,它还能强化肿瘤特征,包括耐药性、ECM调控、慢性炎症以及侵袭能力[4]。因此,深入研究CAFs的活化途径、机制其在肿瘤发生发展中的作用具有重要意义。
1 CAFs的活化机制
研究认为CAFs主要来源于肿瘤周围间质组织中的NFs,此外也可来源于肿瘤干细胞和肿瘤间质的其他细胞。NFs可经肿瘤微环境中一些可溶性的信号分子诱导活化;癌蛋白也是除细胞因子外的重要活化因素;另外,miRNA也可使NFs向CAFs转化或激活,从而调控肿瘤的发生发展。
1.1 细胞因子
在肿瘤的发生发展过程中,位于肿瘤细胞附近的纤维细胞或其他细胞能通过自我调节使其遗传或表观遗传发生改变,或者通过肿瘤细胞对其的调控来进行活化[14]。纤维细胞通常能被肿瘤细胞和其他的基质细胞所分泌的细胞因子活化,主要包括转化生长因子β(transformation growth factor-β,TGF-β)、血小板衍生生长因子(platelet-derived growth factor,PDGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、上皮生长因子(epithelial growth factor,EGF)、趋化因子CXCL12[15]、血管内皮生长因子(vascular endothelial growth factor,VEGF)、骨形态发生蛋白质(bone morphogenetic protein,BMP)等等。细胞与细胞之间的通讯主要是通过黏附分子进行,包括细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)和血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1),它们也能使纤维细胞活化[16]。
TGF-β是一个多功能的细胞因子,能调控各种类型细胞的生长、分化和迁移[17],被认为是最能有效诱导NFs向CAFs转化的细胞因子[18]。在卵巢纤维细胞中,TGF-β能够直接靶向多能蛋白聚糖(versican,VCAN),并上调其表达量,使NFs活化为CAFs。研究表明,VCAN在CAFs中的表达是通过TGF-β受体Ⅱ和SMAD信号调控的。TGF-β能上调CAFs中VCAN的表达量,上调的VCAN又能激活核因子 κB(nuclear factor-κB,NF-κB)信号通路,进而上调CD44、MMP6和透明质酸介导的运动感受器(hyaluronic acid-mediated motion receptor,HMMR)的表达,从而促进卵巢癌细胞的侵袭转移能力[19]。也有研究表明,TGF-β可以诱导内皮细胞的增殖,并将其表型转化为NFs,随后进一步将其活化为CAFs[20]。这种内皮间质转化(endothelial-mesenchyal transformation,EndMT)与间质标记FSP1的出现和CD31/PECAM的下调有关。TGF-β2能够诱导间质转化,使人微血管内皮细胞(human microvascular endothelial cells,HMEC-1 cells)分化为具有CAFs特性的细胞,比如具有细长的细胞形态、应力纤维组织调控能力提高、α-SMA高表达以及RhoA和Rac-1信号通路的激活[21]。PDGF是一种生长因子,与纤维化、血管生成以及肿瘤发生有关[22,23]。在肝星形细胞中,PDGF能将其活化为CAFs,而视黄素则能通过抑制PDGFRα/β的表达,从而抑制肝星形细胞向CAFs的转化[24]。在肿瘤早期阶段,NFs中的免疫细胞所分泌的白介素-1β (interleukin-1β,IL-1β)能诱导激活 NF-κB信号通路,促进早期炎症以及肿瘤的发生[25]。癌细胞分泌的VEGF也能活化NFs[26],它在血管渗漏形成中起着关键性的作用,能通过提高血管渗透性,导致反应性血管周围区域含有纤维蛋白和血小板,从而促进免疫细胞的积累、内皮细胞的增殖以及 NFs的活化[27]。总的来讲,TGF-β、PDGF、VEGF等细胞因子主要通过NFs内的NF-κB、ERK和AKT等信号通路来调节纤维化相关基因的表达(图1)[28],从而介导NFs活化为CAFs[29]。
1.2 癌蛋白

图1 细胞因子活化CAFs(根据文献[28]修改)Fig.1 The activation of CAFs by cytokines(modified according to the reference[28])
c-Ski是一个转录调节因子,通过与辅阻遏物或转录因子的直接结合来抑制其靶基因转录[30,31],已被证明可以促进肿瘤的发生发展,在一些实体瘤包括白血病、黑色素瘤、大肠癌组织、胃癌和胰腺癌中高表达[32~36]。癌蛋白c-Ski可以通过抑制p53的表达来促进基质细胞衍生因子1(stromal cellderived factor 1,SDF-1)的分泌,从而使NFs向CAFs转化[37]。Snail、ZEB和Twist蛋白被认为是EndMT的转录调控因子,均能在胚胎发育过程中表达并调控其发育[38],也能影响细胞多能性[39,40]。在成人肿瘤上皮细胞中异常活化的EndMT转录因子可促进肿瘤细胞的可塑性,并引发肿瘤的起始和转移[41]。TGF-β和PDGF-BB能通过磷脂酰肌醇-3激酶信号通路来上调Snail1的表达,从而活化NFs[42];炎症细胞因子IL-6通常能在肿瘤细胞中表达,诱导纤维细胞中Twist1的表达,再通过STAT3磷酸化来活化NFs为CAFs[43]。有研究报道,Twist1能上调胶原蛋白α1达到相同的目的[44]。此外,ZEB1可能参与口腔黏膜下表皮纤维化的发病过程,其主要通过激活α-SMA编码基因的启动子来诱导口腔黏膜细胞向CAFs转化[45]。
1.3 miRNA
miRNA是小非编码RNA分子,能在转录后水平负调控基因的表达,它们的靶基因通常都能影响细胞分化、黏附、迁移、增殖、分泌和细胞间相互作用。有报道指出miRNA能使多种体细胞变为多能干细胞[46]。其实,miRNA也可发挥使NFs向CAFs转化或激活的作用(表1)[47],从而调控肿瘤的发生发展。
除表1所呈现信息外,在卵巢CAFs细胞中,miR-155上调,而miR-31和miR-214下调。C-C类趋化因子配体5(CCL5)被鉴定是miR-214的靶标分子,研究证明,当NFs和肿瘤细胞共培养时,卵巢癌细胞能通过调控miR-214靶向CCL5,使NFs向CAFs转化[46]。胰腺癌细胞能诱导NFs转化为CAFs,同样,CAFs也能促进肿瘤的侵袭和增殖。微泡(microvesicles,MVs)已被证明是细胞间通讯的重要介质,可以从供体细胞选择性地运输并释放miRNA,从而使其被受体细胞吸收。当用胰腺癌细胞分泌的含miR-155的MV处理NFs时,能将miR-155转移到NFs中,TP53INP1是miR-155的靶基因,miR-155能通过下调TP53INP1蛋白的表达,使NFs活化为CAFs[48]。在肺癌中,相较于NFs,CAFs中miR-1和miR-206明显下调,而miR-31上调,VEGF/CCL2和 FOXO3a分别是miR-1、miR-206和miR-31的靶标分子,在NFs中可通过miRNA介导激活FOXO3a/VEGF/CCL2信号通路,从而促进NFs向CAFs的转化[49]。黑色素瘤起源于表皮,侵入真皮后发生转移,在入侵前通过miRNA直接影响真皮肿瘤的形成。黑色素小体携带miRNA进入NFs后能引发其发生改变,包括提高增殖、转移能力以及促进炎症基因的表达,这也就是我们所知的CAFs特性。有研究报道,黑色素瘤中黑色素小体能携带miR-211至NFs,作用于IGF2R,从而激活MAPK信号通路,使之向CAFs转化,进而促进肿瘤的增殖和转移[50]。
2 CAFs在肿瘤发生发展中的作用
肿瘤生长依赖于癌细胞的异常和不可控增殖,微环境的变化对其也有影响。越来越多的研究报道,在肿瘤微环境的基质细胞中,CAFs可以促进肿瘤细胞的生长、侵袭转移、血管生成以及放化疗抵抗[51,52]。
2.1 CAFs与肿瘤生长
CAFs能通过自分泌或旁分泌产生一些细胞因子,促进肿瘤的生物学特性。另外,一些经典的生长因子,包括EGF、肝细胞生长因子(hepatocyte growth factor,HGF)以及CAFs分泌的特异性蛋白质(例如:分泌型卷曲相关蛋白1、胰岛素样生长因子家族1和2)和膜分子(例如:整合素α11和多配体聚糖-1)也被确定能支持肿瘤细胞的发生发展[53]。这些因素直接或间接地影响肿瘤细胞的生长和存活,或者增强它们的侵袭转移能力。还有研究报道,CAFs分泌的趋化因子进入肿瘤微环境能够招募骨髓来源的细胞(bone marrow-derived cells,BMCs)以及免疫细胞[54]。这些趋化因子和细胞因子分泌到肿瘤微环境中也能够促进肿瘤的增殖和转移能力。CAFs影响肿瘤的生长,部分是依赖于诱导血管生成的能力,主要是通过CAFs介导的SDF-1和招募骨髓来源的内皮细胞[55]。
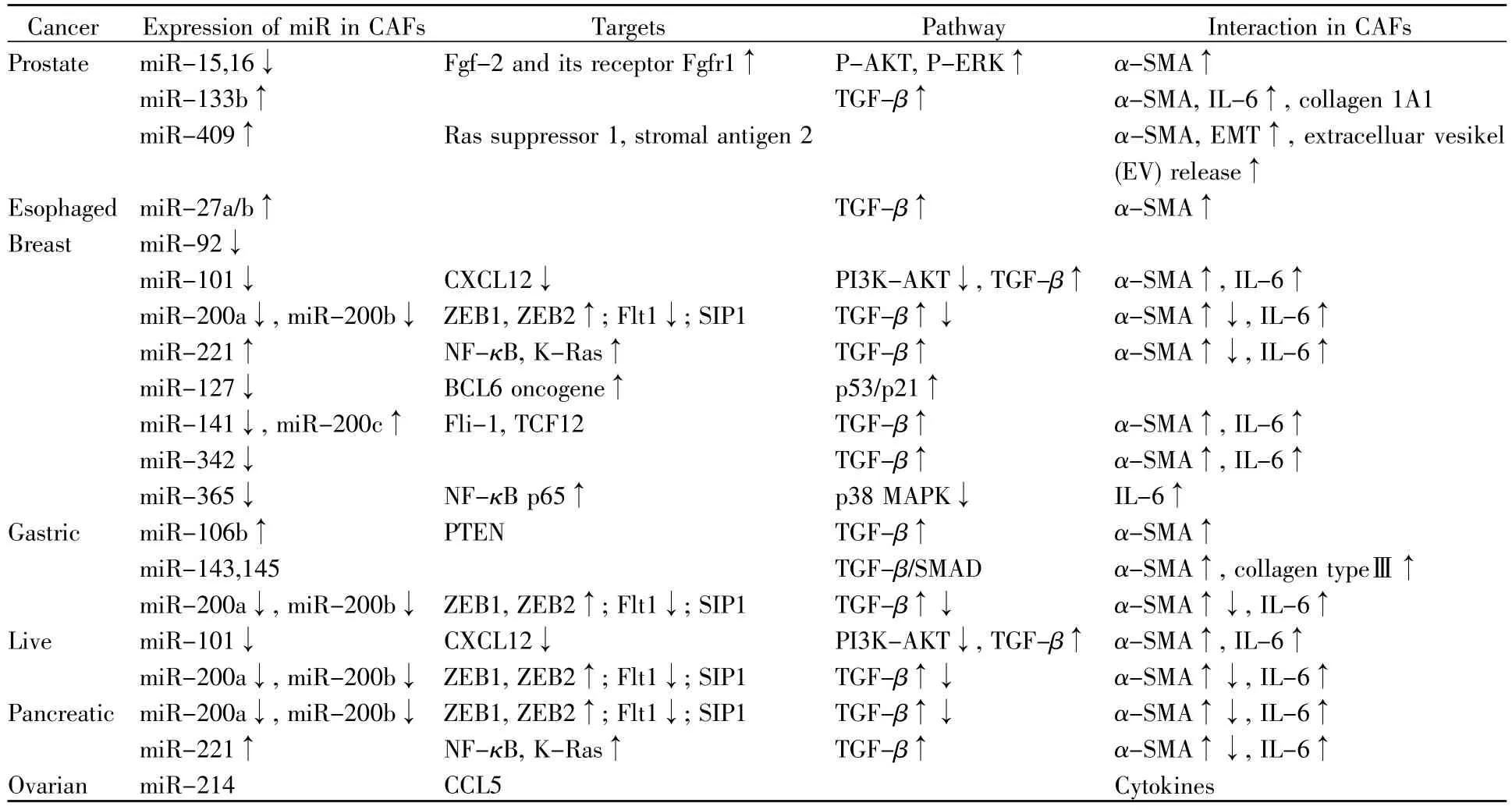
表1 miRNA调控CAFs的活化机制(根据文献[47]修改)Table 1 miRNAs regulate the activation of CAFs(modified according to the reference[47])
2.2 CAFs参与肿瘤细胞的血管生成
VEGF是最早被确定为血管和淋巴管生成的一种多功能细胞因子[56]。肿瘤和间质细胞相互作用可以导致VEGF的表达增加,CAFs是VEGF的主要来源[57]。PDGF/PDGFR信号通路是参与血管生成的重要调控途径。PDGFs能招募间质纤维细胞分泌的VEGF,从而间接促进血管生成[58]。此外,PDGF能招募并诱导骨髓细胞形成内皮或平滑肌细胞,随后PDGF再促进内皮细胞和平滑肌细胞的增殖和转移。PDGF-B由内皮细胞产生,可诱导周皮细胞迁移到血管壁,维持内皮细胞的稳定性,从而导致肿瘤血管生成[59]。肿瘤细胞还可以刺激纤维细胞分泌IL-6,进一步诱导血管生成[60]。
2.3 CAFs调控肿瘤细胞的侵袭转移
活化的纤维细胞对于转移瘤的再次发育有着重要的作用,在原发位点CAFs通过释放生长因子和细胞因子进入血液循环提高其转移能力,从而直接或者间接地远距离促进肿瘤的生长和侵袭转移能力[61~63]。CAFs也可以在原发瘤处影响ECM的强度,增强肿瘤细胞的迁移能力[64],还可产生ECM轨道引导肿瘤细胞迁移[65]。YAP是一个转录因子,它可以被CAFs激活,增强ECM刚性和提高肿瘤细胞的侵袭能力[66]。此外,有研究报道在CAFs中下调miR-148a的表达,能上调其靶基因WNT10B的表达,提高Wnt的活性,进而促进子宫内膜癌细胞的侵袭能力[67]。同样,在前列腺癌中,通过激活AKT和细胞外信号调控激酶信号通路来下调CAFs中的miR-15和miR-16,可增强前列腺癌的迁移能力并促进血管生成[68]。在肺癌中,CAFs可以通过分泌IL-6增强肺癌细胞的转移潜能,进而激活JAK2/STAT3信号通路。当用IL-6中和抗体或JAK2/STAT3特异性抑制剂抑制IL-6/STAT3信号通路时,便能逆转CAFs对肺癌细胞迁移的促进作用[69]。
2.4 CAFs和化疗、放疗抵抗
如今,在肿瘤的放射治疗中普遍存在放疗抵抗现象,它可能与肿瘤微环境中的CAFs有关。比如,结肠癌患者放射治疗中存在放疗抵抗,CAFs通过分泌外泌体(exosome)促进结肠癌细胞的干性,从而增强其放射抵抗的能力[70];在食管癌中,CAFs能通过分泌趋化因子CXCL1来调控食管癌细胞的DNA损伤修复,从而介导食管癌细胞产生显著的放疗抵抗性[71]。
早期的研究指出:器官特异性微环境有耐药性作用[72]。而肿瘤微环境中的CAFs则成为促进癌细胞逃避抗癌治疗的关键因素。目前,与基质有关的一些抵抗机制主要包括如下调控通路:肿瘤细胞-ECM相互作用、CAF-ECM黏附作用以及细胞因子或趋化因子介导的信号通路[73,74]。CAFs也可参与肿瘤间质液压力的提高,从而间接抑制抗癌药物的摄取[75]。还有研究表明,CAFs调控的免疫调节、促血管生成以及对肿瘤微环境的代谢调控也可能有助于癌细胞的存活[76,77]。与癌细胞相比,CAFs在基因上相对稳定,降低了发生耐药性的可能,从而作为潜在的治疗靶点,减少了化疗抗性发展的机会[76,78]。
为了克服CAFs介导的耐药性,临床上正在对几种药物的联合治疗进行测试,通过分析基质反应和患者对治疗的适应情况,并对了解到的CAFs-肿瘤细胞信号在治疗过程中的具体情况进行整合归纳,可得出较为完善的治疗方法。如,透明质酸[79,80]或抗血管生成的降解疗法[81,82]可能是一种改革的新方法,它能使肿瘤血管正常化,从而能对实体瘤中的癌细胞更有效地进行化疗,或促进免疫介导的抗癌疗效。此外,通过酶分解CAFs沉积的ECM等方法也在进一步研究中。
3 结语
根据世界卫生组织(world health organization,WHO)的统计,癌症正在成为世界上导致死亡的最大原因,仅次于心血管疾病[16]。肿瘤的发生发展与肿瘤微环境的关系密不可分。肿瘤微环境主要包括肿瘤细胞和间质细胞,CAFs是肿瘤微环境中的重要组成部分,它主要通过纤维细胞活化而来。纤维细胞可以被各种可溶性的信号因子、癌蛋白以及miRNA活化,活化的CAFs又可以通过自分泌和旁分泌作用于肿瘤细胞,从而促进肿瘤细胞的发生发展、侵袭转移以及血管生成(图2)。
由于全球侵袭性癌症的发病率因预期寿命的延长、生活方式、营养的改变以及环境因素的变化而不断增加,癌症治疗变得至关重要。肿瘤间质不再仅仅被看作是对突变的上皮细胞的物理支持,更是作为一个重要的调制器,甚至是致瘤性的驱动因素。CAFs是致瘤过程中最关键参与者,它能导致恶性肿瘤的启动和进展。近年来,越来越多的研究将CAFs作为癌症治疗的靶点。此外,还有研究表明CAFs能作为预后标志,在各种癌症疾病中预示较好或者较差的转归。在未来,我们也许能通过使用小分子抑制剂、单克隆抗体和基因治疗的方法来靶向肿瘤微环境的各种细胞,从而实现个性化的靶向治疗。

图2 肿瘤微环境中NFs、CAFs和肿瘤细胞间的相互作用Fig.2 The interaction between NFs,CAFs and tumor cells in tumor microenvironment
