人乳头瘤病毒E6/E7 mRNA检测的临床应用
2018-07-31轩乾坤吴文娟李广波
轩乾坤,郭 建,吴文娟,李广波
(同济大学附属东方医院检验科,上海 200123)
宫颈癌是严重威胁女性生命健康的恶性肿瘤之一,发病率及死亡率在肿瘤中居第4位[1]。有研究结果表明,99.7%的宫颈癌发生与高危型人乳头瘤病毒(human papillomavirus,HPV)感染直接相关,高危型HPV持续性感染是引起宫颈癌发生的必要因素[2-3]。HPV感染后其基因整合到宿主细胞基因组,并启动癌基因E6、E7的表达。HPV E6、E7是导致宫颈癌变发生和发展的重要因素[4],检测HPV E6、E7 mRNA的表达对于宫颈癌的筛查具有重要意义。为此,本研究评价了HPV E6/E7 mRNA在临床HPV感染筛查中的应用价值。
1 材料和方法
1.1 研究对象
选取2015年7月—2017年4月同济大学附属东方医院妇科门诊就诊的患者5 308例,年龄22~65岁。所有患者均进行宫颈细胞学检测,同时进行HPV DNA检测或HPV E6/E7 mRNA检测。就诊原因:白带增多、性生活后出血、异常阴道出血及体检异常等。
1.2 方法
1.2.1 液基薄层细胞学(thinprep cytologic test,TCT)检测 所有对象均选择非月经期,将采集的宫颈脱落细胞装入装有细胞保存液的小瓶中,送至病理科,由病理科出具检验报告,诊断标准参照国际癌症协会推荐的TBS(2001)分类标准,分为正常或炎症、低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)、高度鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)、鳞状细胞癌和腺癌(adenocarcinoma,CA)、意义不明的不典型鳞状细胞(atypical squamous cell of undetermined significance,ASCUS)。
1.2.2 HPV DNA检测 采用cobas 4800全自动HPV样本制备和检测平台(瑞士罗氏公司)检测HPV DNA。该仪器检测原理是基于实时荧光定量聚合酶链反应的多通道核酸检测,以β球蛋白的管家基因为内对照,1次检测可报告HPV16型、18型和其他12种高危HPV亚型(31、33、35、39、45、51、52、56、58、59、66和68b)不分型的阴、阳性结果。
1.2.3 HPV E6/E7 mRNA检测 采用新柏氏液体细胞学采样瓶留取标本,采用PANTHER系统(美国HOLOGIC Gen-Probe公司)及APTIMA HPV E6/E7 mRNA高危和分型试剂检测HPV E6/E7 mRNA。该系统的检测原理是基于转录介导的扩增技术(transcription-mediated amplification,TMA)和双动力化学发光技术。第1步检测14个高危型,报告阴、阳性,阳性标本进行第2步的分型检测,报告HPV16型、HPV18/45型;如第1步检测阳性,第2步检测阴性则报告其他11个高危HPV亚型(31、33、35、39、51、52、56、58、59、66和68)不分型的阳性结果。
1.3 统计学方法
采用SPSS 17.0软件进行统计分析。计数资料以率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 HPV DNA和HPV E6/E7 mRNA初筛阳性率的比较
5 308 例患者中有4 062例检测了HPV DNA,有1 246例检测了HPV E6/E7 mRNA。HPV DNA初筛阳性率[17.67%(718/4 062)]明显高于HPV E6/E7 mRNA[12.12%(151/1 246)](P<0.05)。
2.2 各组HPV DNA和HPV E6/E7mRNA阳性率的比较
根据TCT检测结果将5 308例患者分为4个组:正常组(4 976例)、ASCUS组(231例)、LSIL组(69例)、HSIL组(32例)。HSIL组、LSIL组及ASCUS组HPV DNA阳性率与HPV E6/E7 mRNA阳性率比较,差异均无统计学意义(P>0.05);正常组HPV DNA阳性率(15.07%)明显高于HPV E6/E7 mRNA阳性率(8.90%)(P<0.05)。见表1。
2.3 HPV DNA、HPV E6/E7mRNA阳性者中各组所占比例的比较
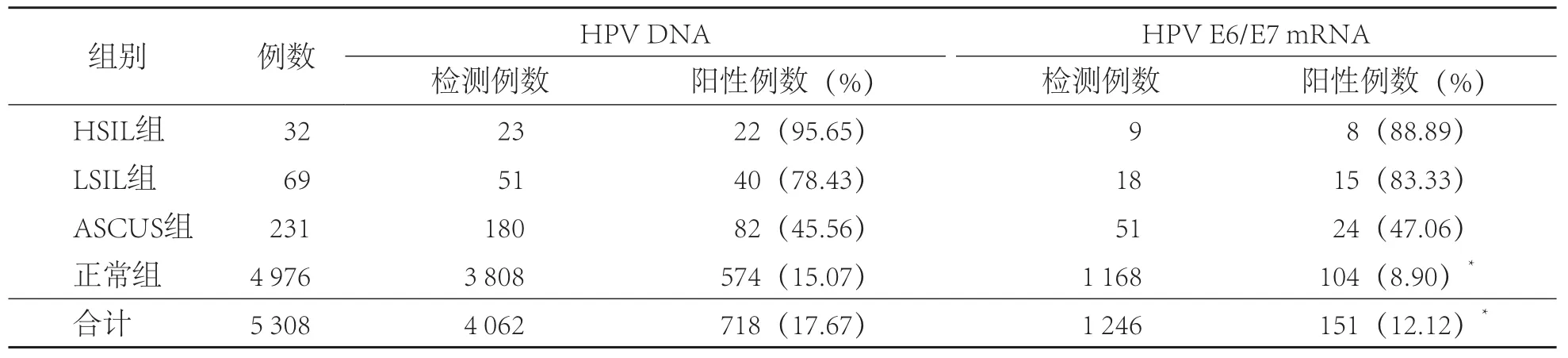
表1 正常组、ASCUS组、LSIL组、HSIL组HPV DNA、HPV mRNA阳性率比较
718例HPV DNA阳性者中正常组574例(79.95%)、ASCUS组82例(11.42%)、LSIL组40例(5.57%)、HSIL组22例(3.06%)。151例HPV E6/E7 mRNA阳性者中,正常组104例(68.88%)、ASCUS组24例(15.89%)、LSIL组15例(9.93%)、HSIL组8例(5.30%)。HPV DNA阳性者各组比例与HPV E6/E7 mRNA阳性者各组比例比较,差异有统计学意义(P<0.05)。
以LSIL和HSIL为细胞病理学阳性,以正常和ASCUS为细胞病理学阴性。HPV E6/E7 mRNA阳性者中细胞病理学阳性患者的比例[15.23%(23/151)]明显高于HPV DNA阳性者中细胞病理学阳性患者的比例[8.64%(62/718)](P<0.05)。
2.4 HPV DNA、HPV E6/E7 mRNA筛查LSIL和HSIL的敏感性和特异性
以LSIL和HSIL为细胞病理学阳性,以正常和ASCUS为细胞病理学阴性,计算HPV DNA、HPV E6/E7 mRNA筛查LSIL+HSIL的敏感性和特异性。HPV DNA和HPV E6/E7 mRNA 筛查LSIL+HSIL的敏感性分别为83.78%和85.19%,二者差异无统计学意义(P>0.05);特异性分别为83.55%和89.49%,二者差异有统计学意义(P<0.05)。
3 讨论
目前,随着HPV高危型与宫颈癌发病相关性研究的深入,HPV分型检测越来越受到关注。HPV持续感染是宫颈癌及其癌前病变发生、发展的必要条件。检测高危型HPV的持续感染可以辅助宫颈癌及其癌前病变的早期诊断和治疗。美国阴道镜及宫颈病理协会在其宫颈癌筛查指南中建议30~65岁的女性应把HPV分型检测和宫颈细胞病理学检测作为筛查策略[5]。
有研究结果表明,HPV DNA阳性者中有绝大多数是HPV一过性感染,约70%~80%的女性在一生中有可能感染HPV,其中有90%的感染者可在8~24 个月内自然清除,只有高危型HPV的持续性感染才有可能导致宫颈病变或宫颈癌[6-8]。HPV感染后,HPV DNA基因整合到宿主细胞染色体中,E6/E7表达的癌基因蛋白有抑制抑癌蛋白p53和Rb的功能,影响感染细胞的生长周期,导致细胞向癌变方向发展[9-10]。HPV E6/E7 mRNA是与宫颈癌进展相关的mRNA,如未检出mRNA转录物说明病毒仍处于游离或休眠状态;而高频率的E6/E7 mRNA转录活动说明高危型HPV已整合入宿主基因并干扰细胞周期控制,导致LISL和HSIL的发生。本研究结果显示,HPV DNA筛查阳性率明显高于HPV E6/E7 mRNA筛查阳性率。正常组HPV DNA阳性率明显高于HPV E6/E7 mRNA阳性率,表明部分HPV感染者尚未引起宿主细胞的病理改变。ASCUS组、LSIL组、HSIL组HPV DNA阳性率与HPV E6/E7 mRNA阳性率差异无统计学意义(P>0.05),与文献报道[11]一致。
TCT阳性是患者进行阴道镜检测和宫颈病理活检的重要依据。本研究以TCT结果(LSIL+HSIL为细胞病理学阳性,正常+ASCUS为细胞病理学阴性)为评价标准,计算HPV DNA、HPV E6/E7 mRNA筛查LSIL+HSIL的敏感性和特异性。结果显示,HPV DNA和HPV E6/E7 mRNA 筛查LSIL+HSIL的敏感性一致(P>0.05),但HPV E6/E7 mRNA的特异性优于HPV DNA(P<0.05)。HPV E6/E7 mRNA阳性者中细胞病理学阳性患者的比例[15.23%(23/151)]明显高于HPV DNA阳性者中细胞病理学阳性患者的比例[8.64%(62/718)](P<0.05)。由此可见,HPV E6/E7 mRNA阳性提示细胞病变的特异性更高。NOLTE等[12]的研究结果显示,与TCT相比,HPV E6/E7 mRNA和HPV DNA的敏感性和特异性均较高,更适合于宫颈癌的初筛。还有研究结果显示,对于宫颈上皮内瘤变患者治疗后的随访,采用HPV E6/E7 mRNA检测可有效评估复发风险[13-14]。
临床上HPV筛查的目的并不仅仅是为了检测HPV感染,还要发现宫颈癌高风险人群,进而决定哪些人不需要进行进一步的治疗并回归常规人群管理。HPV E6/E7 mRNA是有致癌作用的mRNA,故与HPV DNA检测相比,可有效减少HPV一过性感染的检出并有较好的预测价值,从而减少不必要的阴道镜组织学检查,并减轻患者不必要的心理压力,降低医疗费用。
