日本血吸虫七跨膜基因SjSTMP的鉴定及生物学特性分析
2018-07-26贾英英叶忠雪冯新港林矫矫苑纯秀
贾英英,叶忠雪,冯新港,陆 珂,李 浩,林矫矫,赵 权,苑纯秀
(1. 吉林农业大学动物科学技术学院,长春130118;2. 中国农业科学院上海兽医研究所,上海200241)
血吸虫病主要流行于热带和亚热带地区,对人类健康造成巨大威胁[1]。目前血吸虫病防治依赖唯一的化疗药物吡喹酮,而吡喹酮的外消旋体结构,以及其代谢速度快,对童虫的杀伤力弱或者无效等方面的局限性[2],急需增加新药储备来弥补吡喹酮作用的不足。
用特定的药靶进行筛选,是新药发现的有效途径,生物药靶常选择与生长发育密切相关的信号通路分子。Wnt信号通路对真核生物的发育起重要的调节作用[3],Frizzled蛋白是Wnt信号通路必需的受体分子[4],属于G蛋白偶联受体(G protein coupled receptor)家族成员,该家族成员是常用的生物药靶。本实验室在扩增日本血吸虫Frizzled家族新基因时,获得了与其结构类似的一个新七跨膜蛋白(seven transmembrane protein,STMP)编码基因,本文对该基因编码蛋白的序列特征及生物学特性进行了分析,为进一步分析其作为何种信号受体以及如何参与血吸虫发育调节等工作的开展提供实验基础。
1 材料和方法
1.1 主要试剂 Trizol试剂购自Ambion公司;SYBR Premix Ex TaqTM(TliRNaseH Plus)、Prime script RT MASter MIX、MARTerTM RACE cDNA Amplification Kit、Ex Taq HS均购自TaKaRa公司;Tubulin抗体、山羊抗小鼠IgG-HRP抗体购自上海优宁维生物科技有限公司;弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司;Dako免疫组化显色液、二抗购自上海启中信息技术有限公司;Millipore化学发光液购自上海麦约尔生物科技有限公司。
1.2 实验动物和日本血吸虫尾蚴 2.5~3 kg的雄性新西兰白兔由上海罗泾飞达实验动物养殖场提供;日本血吸虫尾蚴(安徽株)由上海兽医研究所血吸虫病研究室钉螺室提供。
1.3 不同发育阶段及不同宿主来源的日本血吸虫 新西兰白兔经腹部贴片感染 2000~10 000条尾蚴,分别在感染后d7、14、18、23、35、42剖杀,肝门静脉灌注法将虫体冲出,23 d后的虫体进行人工雌雄分开,PBS洗净。收集感染日本血吸虫42 d的兔子肝脏,匀浆后加终浓度为0.25%的胰酶消化4 h,分级过筛收集虫卵。将虫体、虫卵转入冻存管中,置液氮中保存备用。
分别对大鼠、BALB/c小鼠进行混合性别尾蚴感染,目的在于获得非适宜宿主及适宜宿主中生长的虫体。另外对BALB/c小鼠进行单钉螺释放尾蚴感染,目的在于获得单性虫体。大鼠感染1000条尾蚴,小鼠感染尾蚴150条,感染后d25收集虫体,将混合尾蚴感染获得的虫体雌雄分开,所有虫体存于液氮中备用。
1.4 新七跨膜蛋白编码基因3'RACE和5'RACE 在国家人类基因组南方中心的血吸虫数据库搜索到1条与其他物种fz4基因有部分同源性的日本血吸虫EST序列(gnl|lsbi|CNUS0000102489.1|)。首先根据该序列设计引物进行PCR扩增,验证其序列的准确性。再根据经验证的EST序列设计RACE引物,进行完整cDNA序列的扩增。引物序列见表1,由上海英俊生物有限公司合成。
利用Trizol提取7 d日本血吸虫虫体的总RNA,根据SMART RACE cDNA Amplification试剂盒说明书进行反转录,并进行3'RACE和 5'RACE扩增。分别进行两次延伸,将PCR产物切胶回收,常规方法克隆测序,测序结果用Gene Tool软件进行拼接,获得日本血吸虫七跨膜蛋白(Schistosoma japonicum seven transmembrane protein,SjSTMP)编码基因全长cDNA。根据拼接的cDNA全长序列设计特异性引物,对SjSTMP基因进行特异性(含开放阅读框)PCR扩增。上游引物S:5'-AAGAAGTTAATCATTGATCAGCTG-3';下游引物A:5'-G A G A A G A T A G T G G A T G C G G A A GAAG-3',特异扩增区域为全长cDNA的43~3913 bp。
1.4 SjSTMP及其编码蛋白的生物信息学分析 采用ORF Finder (https://www.ncbi.nlm.nih.gov/orffinder/)分析编码框;利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)在线进行信号肽的预测;利用TMHMM Server v 2.0软件(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构;利用NetNGlyc 1.0 Server软件(http://www.cbs.dtu.dk/services/NetNGlyc/)进行糖基化位点预测;利用Clustal Omega(http://www.ebi.ac.uk/Tools/msa/clustalo/)分析SjSTMP与其他物种的同源性。

表1 日本血吸虫新七跨膜蛋白编码基因PCR引物Table 1 Primers of the amplif i cation for new SjSTMP in S.japonicum
1.5 日本血吸虫SjSTMP在不同期别及不同性别虫体中的表达分析 通过Primer Premier5.0软件设计日本血吸虫七跨膜基因定量引物,上游引物qPCRS:5'-TCCAAGGCATACGGTATTCACAAC-3';下游引物qPCRA:5'-TTGACGACCAACACCACATA CTG-3'。选取14 d童虫总RNA,按Prime script RT MASter MIX反转录试剂盒说明书进行反转录。对反转录获得的cDNA模板进行10倍系列稀释,共设5个梯度,作为构建SjSTMP和日本血吸虫18S rRNA基因标准曲线的模板。每个梯度样本做3个重复,R2≥0.99。按照SYBR Green Ex Taq 试剂盒的要求添加相应试剂,qPCR反应条件为:50℃,2 min,95℃,5 min;95℃,15 s,60℃,1 min,40个循环;95℃,15 s,60℃,15 s(熔解曲线)。
选取来源于新西兰兔的日本血吸虫虫卵以及7、14、18、23、35、42 d虫体材料,分析同一宿主体内不同发育阶段虫体的SjSTMP转录水平差异;选取BALB/c小鼠来源的单、复性感染的25 d虫体以及大鼠来源的混合感染的25 d虫体作为实验材料,分析不同宿主来源的虫体及单复性感染的虫体间SjSTMP mRNA表达水平差异。定量PCR反应在ABI7900荧光定量PCR仪中进行,采用双标准曲线法分别计算出SjSTMP和内参18S rRNA基因在不同样品中的拷贝数,再选择相对定量的方法获得SjSTMP与内参基因含量的比值,在结果中选择表达水平最低的样品作为基准,其他各组数据与该基准值相比,获得SjSTMPmRNA的相对表达趋势,结果以柱状图形式呈现。
1.6 SjSTMP部分片段的原核表达 利用antibody epitope prediction 软件在线分析预测SjSTMP的抗原表位,选取氨基酸序列中42~172位表位丰富的氨基酸区段的相应编码核苷酸序列,作为原核表达的目标基因片段序列。采用Primer Premier5.0软件设计引物,上游引物:5'-GTGGATCCACCTCAATA ATCTATGGTCAACAAC-3'(下划线为BamH I酶切位点);下游引物:5'-GTCTCGAGCATTATTT GTTGTAACCCCTCTTGT-3'(下划线为Xho I酶切位点),理论扩增片段大小为627 bp。使用Ex Taq HS进行PCR扩增,常规方法进行克隆测序。将测序结果正确的克隆抽提质粒,转入BL21感受态细胞中,涂布至含有1 mmol/L卡那抗性(K+)的LB培养板,挑取单克隆接种到LB培养基(K+)中,37℃、200 r/min的条件下进行培养,加入IPTG后诱导6 h,进行SDS-PAGE电泳,检测是否有重组蛋白表达。
对诱导表达成功的菌体进行反复冻融、超声、离心,分别收集上清和沉淀,进行SDS-PAGE电泳,判断表达产物是可溶性表达还是包涵体表达。利用常规方法制备包涵体后,16 000×g离心30 min,去除不溶成分,包涵体制备液上清通过镍柱进行蛋白纯化,SDS-PAGE分析纯化蛋白的纯度和浓度。
1.7 SjSTMP重组蛋白多抗的制备 选择5~6 周龄的雄性BALB/c小鼠进行免疫,佐剂与蛋白的混合比例是1∶1。首次免疫使用弗氏完全佐剂,蛋白的用量为100 µg/只。间隔14 d使用弗氏不完全佐剂进行加强免疫,蛋白的用量为50 µg/只,加强免疫3次,四免后d6采血,收集血清。血吸虫不同发育阶段虫体混合制备的虫体总蛋白进行SDS-PAGE后转至NC膜,以SjSTMP的原核表达蛋白免疫多抗为一抗(1∶100),羊抗小鼠IgG(1∶5000)作为二抗,利用Western blot技术检验抗体的特异性,利用凝胶成像系统(ImageQuant300)显示Western blot结果。1.8 SjSTMP的组织定位 将日本血吸虫尾蚴感染2.5~3 kg的雄性新西兰大白兔,29 d后进行剖杀,收集虫体,PBS溶液洗净,4%多聚甲醛室温固定过夜后,采用不同浓度的酒精脱水(100%-90%-80%-70%-50%-25%),再进行二甲苯透明、浸蜡及石蜡包埋、切片,然后进行SjSMTP的组织定位。以未免疫的小鼠血清作为阴性对照,原核表达的SjSTMP免疫的血清(1∶1000)和阴性血清(1∶1000)为一抗,与 Dako免疫组化试剂盒提供的二抗反应,用Dako免疫组化液态DAB+显色液进行显色,苏木素进行复染,采用中性明胶封片,使用尼康E80i显微镜观察并拍照。
2 结果
2.1 SjSMTP扩增 分别经过两次3'RACE和两次5'RACE,最后与初始EST序列进行电子拼接后获得1个含有完整编码框的cDNA序列(图1)。用与这个拼接序列两端互补的特异引物进行PCR扩增,获得了1个接近5000 bp的单一条带,包含1个完整的编码框,其测序结果与电子拼接序列完全一致。
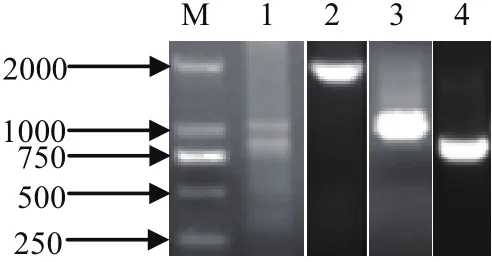
图1 SjSMTP的PCR扩增电泳分析Fig.1 Analysis of PCR products of SjSMTP amplif i cationM: DNA分子量标准(DL2000); 1: 第一次3'RACE; 2: 第二次3'RACE; 3: 第一次5'RACE; 4: 第二次5'RACE; 5: 全长扩增M: DNA Marker(DL2000); 1: First 3' RACE; 2: Second 3'RACE;3: First 5' RACE; 4: Second 5'RACE; 5: Full length amplification
2.2 SjSMTP氨基酸序列的生物信息学分析 ORF Finder分析显示扩增到的cDNA包含1个3423 bp的编码框,编码1个包含1141 aa的蛋白质,理论分子量为127.9 kDa,等电点为8.4。氨基酸序列分析显示SjSMTP有7个跨膜结构。BLASTP在线分析结果显示,SjSMTP蛋白与同样具有七跨膜结构的Frizzled4家族蛋白有30%左右的相似性。SjSMTP蛋白的N端也具有一个半胱氨酸富集区(cysteine rich domain,CRD),CRD被认为是Wnt信号通路中Wnt配体蛋白与Frizzled(Fz)受体蛋白相互识别和结合进而引发信号传递的保守结构功能域。但是SjSMTP蛋白不具有Fz家族的 ”K-T/S-X-X-X-W” 基序,因而不能确定该蛋白是否属于Fz家族成员。SjSTMP蛋白中总共包含16个N糖基化位点,远远超过Fz家族成员的糖基化位点的数目。

图2 日本血吸虫七跨膜蛋白氨基酸序列Fig.2 Amino acid sequence of SjSTMP of Schsitosoma japonicum注:黑色方框指示信号肽区;阴影部分指示半胱氨酸富集区;七个跨膜区分别用下划线标记; 所有的糖基化位点用红色和蓝色字体表示Note: Signal peptide district was indicated with black square frame; CRD was located in shadow; Seven transmembrane were underlined; Glycosylation sites were represented in red and blue
2.3 SjSTMP原核蛋白的表达、纯化及免疫多抗的特异性评价 编码SjSTMP蛋白42~172位氨基酸的核苷酸序列被成功插入到原核表达载体pET28a(+)中,并诱导表达出与理论分子量相符的His融合重组蛋白(图3A)。重组蛋白以包涵体形式表达,经过柱纯化获得高纯度的rSjSTMP(图3B)。采用该重组蛋白免疫BALB/c小鼠,获得的多抗能识别血吸虫天然蛋白中分子量略大于130 kDa的蛋白带,与SjSTMP天然蛋白的理论分子量相符。另外还有3条弱带出现在目的蛋白下方,因反应性远低于目的蛋白,在后续的实验中可通过增加抗体稀释倍数来消除这些非特异性的干扰。阴性血清对照结果中无条带(图略)
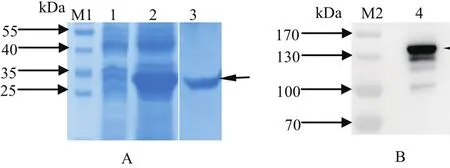
图3 SjSTMP原核蛋白的表达、纯化及多抗的特异性分析Fig. 3 Expression and purif i cation of recombinant SjSTMP and specif i city evaluation of polyclonal antibody against rSjSTMP1: 空载体诱导; 2: pET28a-SjSTMP诱导; 3: rSjSTMP纯化产物;4: SjSTMP重组蛋白免疫多抗Western blot结果; M1、M2: 蛋白质分子量标准; 箭头所示为目标蛋白1: Product induced from empty vector; 2: Product induced from pET28a-SjSTMP; 3: Purified product of rSjSTMP; 4: Western blot of polycolonal antibody against rSjSTMP; M1,M2: Protein Marker; The arrow denoted the target protein
2.4 SjSTMP mRNA在日本血吸虫不同发育阶段的表达趋势 结果显示7 d童虫样品中SjSTMP基因的转录水平最高,虫卵中SjSTMP mRNA量约是7d童虫的1/3(图4)。14 d和18 d童虫中SjSTMP mRNA量与7 d童虫相比略有下降,约是7 d童虫的2/3。23 d雌虫样品中SjSTMP mRNA量与18 d相比显著下降,且呈递减趋势,42 d雌虫中SjSTMP mRNA水平最低。23 d雄虫样品中SjSTMP mRNA量与18 d童虫相比略有下降,也呈递减趋势,但降幅较小。23~42 d雄虫样品中SjSTMP mRNA水平均显著高于同一发育阶段的雌虫。
2.5 SjSTMP mRNA在正常发育虫体与发育不良虫体中的水平差异 SjSTMP在不同宿主来源及不同感染方式来源的虫体中转录水平存在差异。来源于适宜宿主BALB/c小鼠的双性感染的25 d虫体发育正常,其雄虫SjSTMP 转录水平显著高于雌虫。来源于BALB/c小鼠的单性感染的25 d雄虫发育接近正常,体长比正常发育雄虫稍短,其SjSTMP 转录水平稍高于双性感染的正常发育雄虫。单性感染的雌虫生殖器官未发育,虫体比双性感染的正常虫体明显短小,其SjSTMP 转录水平约是正常虫体的8倍。来源于大鼠的雌虫生殖器官发育不良,个体明显小于正常发育雌虫,与单性感染的雌虫接近,其SjSTMP转录水平显著高于正常发育雌虫,约是正常发育雌虫的23倍,是所有样品中最高的。来源于大鼠的雄虫生殖器官发育接近正常,但个体明显小于正常发育雄虫,其SjSTMP 转录水平略低于正常发育雄虫(图5)。
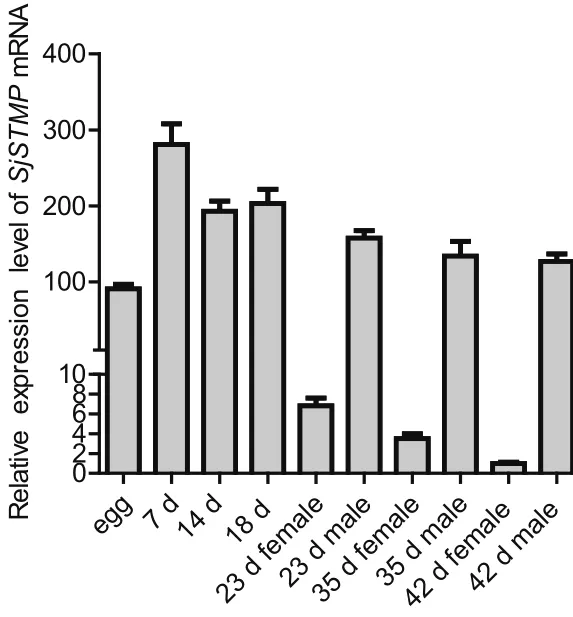
图4 SjSTMP mRNA在血吸虫不同发育阶段的相对定量Fig.4 Relative quantif i cation of SjSTMP mRNA among the different developmental stage of Schistosoma japonicum
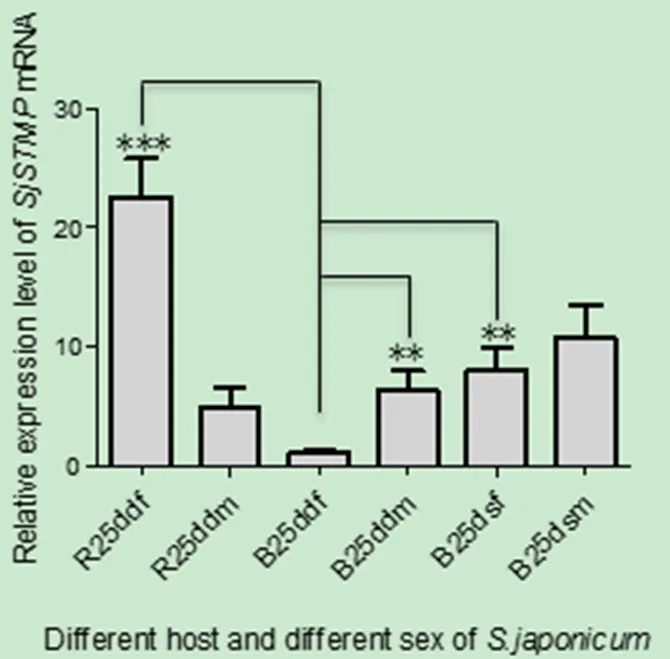
图5 发育正常与发育不良雌雄虫SjSTMP mRNA相对定量Fig 5 Relative quantif i cation of SjSTMP mRNA between normal worms and dysplastic worms.B: BALB/c小鼠; R:大鼠; 25 d: 25天; df: 来源于混合尾蚴感染的雌虫; dm: 来源于混合尾蚴感染的雄虫; sf: 来源于单性尾蚴感染的雌虫; sm: 来源于单性尾蚴感染的雄虫B: BALB/c mouse; R: Rat; 25 d: 25 day; df: Female worms collected from mixed sex cercaria infection; dm: Male worms collected from mixed sex cercaria infection; sf: Female worms collected from single sex cercaria infection; sm: Male worms collected from single sex cercaria infection
2.6 SjSTMP蛋白的组织分布 SjSTMP蛋白在虫体组织内广泛分布,无明显组织特异性。雌虫的卵巢、卵黄腺以及雄虫的睾丸内都有明显的阳性信号(图6 D、E、F)。雌雄虫体的横纵切面上均可见实体组织内SjSTMP蛋白的阳性反应颗粒(图6 G、H、I)。阴性血清对照样品中未见阳性反应(图6 A、B、C)。油镜下细胞表面分布的是成熟的SjSTMP蛋白,细胞质中的阳性信号显示的是未成熟的SjSTMP(图7)。
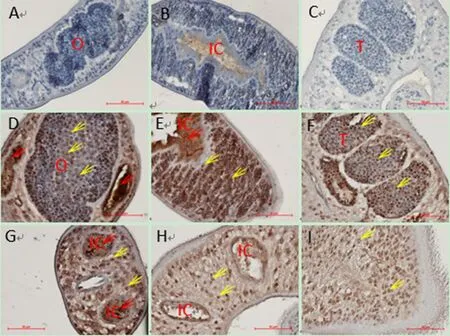
图6 SjSTMP的组织定位(400×)Fig.6 Distribution of SjSTMP (400×)A、B、C: 阴性血清对照; D、E、F、G、H、I: SjSTMP阳性血清; IC: 肠管; O: 卵巢; V: 卵黄腺; T: 睾丸; 黄色箭头指示阳性信号; 红色箭头指示血色素A, B, C: Negative serum control; D, E, F, G, H, I: Polyclonal antibody against SjSTMP; IC: Intestinal canal; O: Ovary; V:Vitellarium; T: Testis; Yellow arrows denoted the positive signal;Red arrows denoted the hematin

图7 SjSTMP蛋白的细胞定位(1000×)Fig. 7 Cellular localization of SjSTMP (1000×)注: 黄色箭头指示SjSTMP蛋白,红色箭头指示细胞核Note: Yellow arrows denote SjSTMP; Red arrows denoted nucleus
3 讨论
SjSTMP氨基酸序列与已知的Frizzled4蛋白有相似性,也具有CRD及七跨膜结构,但SjSTMP蛋白不具有Fz家族蛋白的“K-S/T-X-X-X-W”的结构。Fz家族成员除具有CRD区及六或七个跨膜区外,另一个重要的结构特征是在第七个跨膜区后存在“K-T/S-X-X-X-W”序列。该结构被认为是Wnt/β-catenin通路激活以及Dishevelled蛋白的再次膜定位及磷酸化所必需的,其中三个固定氨基酸的任何一个突变都会导致Wnt/β-catenin信号传递失败,据此暂不能判定SjSTMP属于Fz家族成员。SjSTMP 氨基酸序列的N端具有CRD结构,CRD结构是参与细胞信号转导通路的一些细胞表面受体的重要组成部分,如Fz家族的CRD是与Wnt信号通路信号分子识别结合的结构域。SjSTMP也具有CRD结构,显示其具有作为跨膜受体的结构基础。采用免疫共沉淀等技术可获得与其相互作用的蛋白,从而进一步分析其作用的途径及功能等。
SjSTMP在同一宿主来源的不同发育阶段虫体中所显示出来的mRNA水平差异,提示该基因的转录是随发育调节的。在处于细胞分化期的7 d童虫中转录水平最高,提示SjSTMP在该阶段的功能可能最为活跃。在成熟雌虫中的转录水平随发育的进程而呈现下降趋势,推测该蛋白在成熟雌虫的进一步生长发育中不起关键作用。SjSTMP 基因在成熟雄虫中的转录水平仅比童虫阶段略有下降,仍保持在一个相对高的转录水平,推测SjSTMP对雄虫的进一步生长或发育可能有重要作用。SjSTMP mRNA在虫卵中的量也较高,推测SjSTMP对虫卵的发育也可能具有某种调节作用。SjSTMP mRNA水平在同一发育阶段的发育正常和发育不良虫体中的差异,进一步提示该基因的转录是随发育调节的。分析的样品中来源于大鼠和单性感染的雌虫跟正常发育虫体相比差异较大,相应的SjSTMP mRNA的水平差异也大。相比之下,雄虫间的不良发育程度低,SjSTMP mRNA的转录水平跟正常虫体的差异也相对小一些。SjSTMP蛋白在虫体组织内广泛分布,几乎在所有的组织内都能检测到,这种分布方式跟血吸虫中的Fz家族蛋白成员相类似[6]。进一步明确该蛋白的种类及功能,有助于在分子水平增加对血吸虫发育调节的了解。
