血清2型鸭疫里默氏杆菌铁载体受体蛋白突变体的构建及生物学特性研究
2018-07-26董嘉文孙敏华李林林马海彬龚凤平罗梦萍王贵平袁建丰
董嘉文,孙敏华,李林林,马海彬,龚凤平,罗梦萍,王贵平,袁建丰
(1.广东省农业科学院动物卫生研究所,广州510640;2.广东海大畜牧兽医研究院有限公司,广州 511400;3.广东省兽医公共卫生公共实验室,广州510640;4.广东省畜禽疫病防治研究重点实验室,广州 510640;5.农业部兽用药物与诊断技术广东科学观测实验站,广州510640)
鸭疫里默氏杆菌病是一种高致病性、接触性传染病,其病原体为鸭疫里默氏杆菌(Riemerella anatipestifer,RA)[1,2],主要侵害1~8 周龄(尤其2~3周龄)雏鸭、雏鹅及雏火鸡等。鸭疫里默氏杆菌病病程多呈急性或慢性败血症,主要以神经症状和纤维素性心包炎、肝周炎和气囊炎为特征,发病率90%以上,死亡率高达75%,耐过的病鸭常长成残次鸭或僵鸭,饲料转化率降低,生长发育迟缓,由RA引起的输卵管炎严重影响鸭成年后产蛋率[3-5]。因此鸭疫里默氏杆菌病的广泛流行给养鸭业带来了严重的经济损失。
铁是生命系统所必需的分子。在脊椎动物体液中,铁绝大部分与转铁蛋白和乳铁蛋白结合在一起。致病菌要想在宿主体内建立感染,很大程度上依赖于其利用宿主铁复合物的能力,因此微生物的铁载体运输系统,是致病菌战胜宿主非特异性防御机制,进而在宿主体内繁殖的关键。在铁限制的环境中,绝大多数致病菌已经进化出一套非常精密的方法来获取铁离子,即产生特殊的铁螯合剂——铁载体。遗传检测显示铁获取机制在细菌基因组中占据很重要的地位,进一步说明铁获取机制的重要性。致病菌中铁摄取系统由功能上高度相关的不同种分子构成。铁载体即是一种铁结合分子,包括分枝杆菌中的mycobactin和exochelin、李斯特单核杆菌中的TF样分子以及革兰氏阴性菌中的enterobactin[6]。摄取系统还包括铁载体受体和细菌外膜上ATP依赖的铁载体受体蛋白(siderophore receptor protein,SRP)。SRP在细菌铁离子摄取机制中起着至关重要的作用,是细菌重要的毒力因子和潜在的疫苗靶分子。目前国内外关于鸭疫里默氏杆菌SRP的研究尚未见报道,因此鸭疫里默氏杆菌SRP基因工程突变菌株的构建将有助于为鸭疫里默氏杆菌的毒力研究和防控开辟新的思路。
1 材料和方法
1.1 菌株和载体 血清2型RA GDGZ菌株、大肠杆菌SM10pir、大肠杆菌β2155、pDS132载体均由本实验室保存。
1.2 突变株构建引物的设计 根据SRP左臂基因片段、SRP右臂基因片段以及氨苄抗性基因设计PCR扩增引物,引物序列如表1所示。
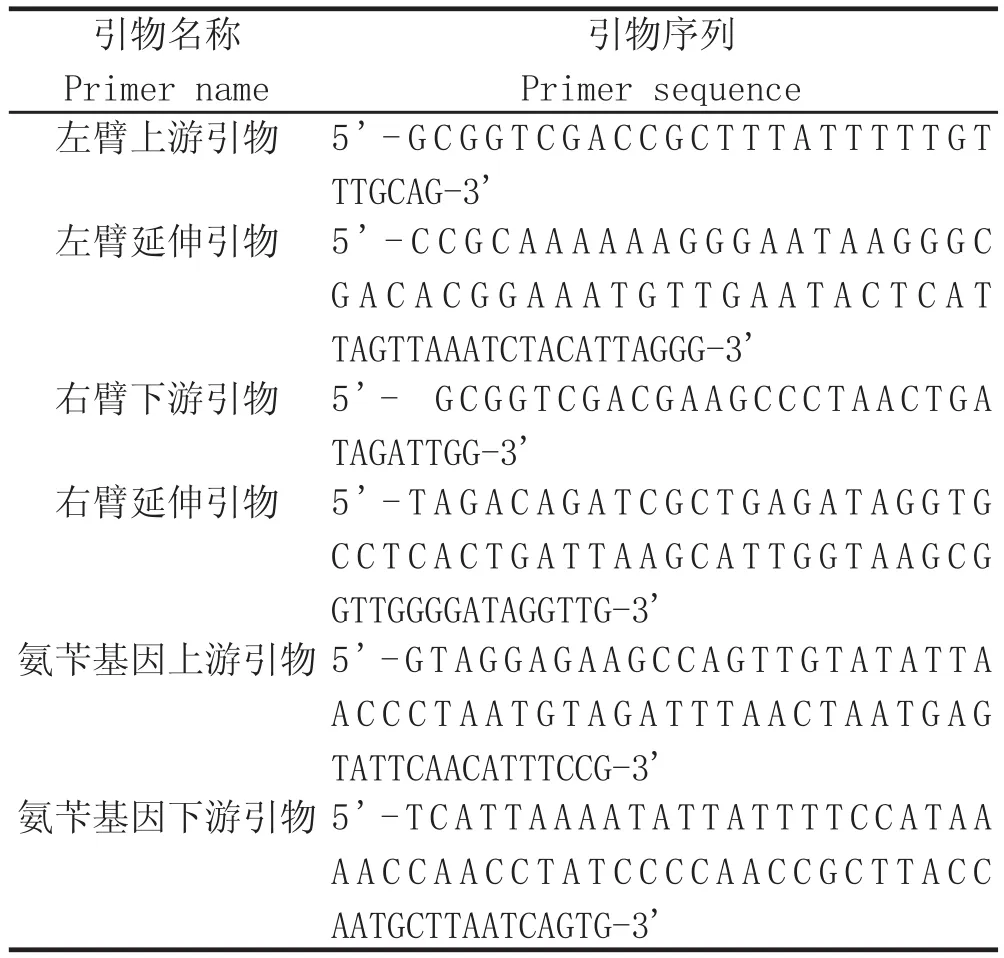
表1 突变株构建的引物设计Table1 Primer design of the mutant construction
1.3 RA基因组的提取 基因组提取方法参考文献[7]进行。
1.4 RA△SRP突变株的构建
14.1 SRP左、右臂基因片段及氨苄抗性基因的扩增 用SRP左臂基因片段的上、下游引物扩增SRP左臂基因片段,SRP右臂基因片段的上、下游引物扩增SRP右臂基因片段,氨苄基因的上、下游引物扩增氨苄抗性基因。PCR扩增体系:PreMixTaq 10 μL、GDGZ菌株基因组DNA 1 μL、上下游引物各1 μL,加灭菌水至50 μL。PCR反应程序: 94℃预变性5 min; 94℃变性30 s,55℃退火1 min,72℃延伸2 min,进行35个循环;循环结束后,72℃延伸10 min;4℃+∞。1%琼脂糖凝胶电泳检测PCR扩增结果产物,并送上海生工测序。
1.4.2 △SRP基因片段的扩增 SRP左臂序列、SRP右臂序列和氨苄基因序列经测序正确后,以SRP左臂上游引物、SRP右臂下游引物和氨苄基因的引物用重叠延伸PCR(SOE-PCR)将左臂基因、右臂基因和氨苄抗性基因序列按左臂-AMP-右臂串联,构建ΔSRP基因片段,即为缺失SRP基因的基因片段。SOE-PCR扩增体系:PreMixTaq 10 μL、左臂上游引物1 μL、右臂下游引物1 μL、氨苄基因上下游引物各1 μL、左臂基因片段1 μL、右臂基因片段1 μL、氨苄基因片段1 μL,加灭菌水至50 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸40 s,进行35个循环;循环结束后72℃延伸10 min;4℃+∞。1% 琼脂糖凝胶电泳检测PCR扩增结果。
1.4.3 pDS132::ΔSRP自杀性质粒的构建 将自杀性质粒pDS132和ΔSRP基因片段分别用Sal Ⅰ酶切,并将酶切的自杀性质粒pDS132用CIAP去磷酸化后,pDS132 2 μL、ΔSRP基因片段4 μL、T4 DNA连接酶1 μL、T4连接酶缓冲液1 μL,4℃连接16 h,得到pDS132::ΔSRP自杀性质粒,转化大肠杆菌SM10pir,菌落经PCR鉴定正确后,提取阳性克隆质粒酶切鉴定,用SalⅠ酶切,1%琼脂糖凝胶电泳鉴定。
1.4.4 血清2型RAΔSRP基因工程菌株的构建 将阳性质粒pDS132-ΔSRP转化大肠杆菌β2155感受态细胞,得到供体菌大肠杆菌β2155(pDS132-ΔSRP)。以转化了质粒pDS132-ΔSRP的大肠杆菌β2155为供体菌,血清2型RA为受体菌进行接合转移。供体菌和受体菌分别在适合的琼脂平板上培养过夜,然后用TSB洗2遍,调整菌浓度至OD600为0.4,各取100 μL菌液混合。将无菌硝酸纤维滤膜贴于含DAP的TSA平板上,再将混合菌液滴于滤膜上,37℃接合8 h。接合结束后用无菌接种环将滤膜上的菌落刮下来,以TSB重悬,再用TSB洗2遍,涂布于TSA平板(含氯霉素50 μg/mL,不含DAP),37℃培养24 h。Cm抗性菌落分别影印到Cm抗性平板。将接合子接种于无NaCl的TSB中,37℃培养过夜,适当稀释涂布于含有氨苄的TSA平板上,过夜培养。挑取单菌落分别影印到Cm抗性平板上,筛选Cm敏感菌落,确定发生了交换。
1.5 血清2型RA△SRP基因工程突变菌株生物学特性研究 将血清2型RA△SRP基因工程突变菌株在铁丰富及限铁环境下培养:以含5%血清的TSB培养基作为铁丰富培养基,以加入2,2-吡啶作为螯合剂的TSB培养基作为限铁培养基,模拟体内感染环境。取血清2型RA△SRP基因工程突变菌株,划TSA琼脂平板,置于37℃培养,24 h活化后挑取单菌落于5 mL液体培养基中,200 r/min、37℃过夜培养12 h,得到的菌液作为菌种。分别取1 mL菌种加入到100 mL铁丰富液体培养基和100 mL限铁液体培养基中,混合均匀,200 r/min 、37℃培养,间隔时间测定OD600吸光值,绘制生长曲线。
1.6 血清2型RA△SRP基因工程突变菌株的动物攻毒试验 将7日龄雏鸭分为4组,10只/组,每组分笼饲养。将血清2型RA△SRP基因工程突变菌株和野生型菌株分别用1.5×108、3×107、6×106、1.2×106CFU/mL的攻毒剂量进行腿部肌肉注射,观察7 d,记录每组雏鸭的死亡情况。
2 结果
2.1 血清2型RA△SRP基因工程突变菌株的构建 SRP左臂基因片段、SRP右臂基因片段和氨苄抗性基因的扩增结果见图1,扩增大小与预期大小一致,测序结果表明成功获得了SRP左臂、右臂和氨苄抗性基因片段。SRP左臂序列、SRP右臂序列和氨苄基因序列经测序正确后,采用重叠延伸PCR(SOEPCR)将左臂基因、右臂基因和氨苄抗性基因序列按左臂-AMP-右臂串联,构建缺失SRP基因的基因片段,结果显示扩增大小与预期一致,表明成功获得了缺失SRP基因的基因片段(图2)。将自杀性质粒pDS132和ΔSRP基因片段分经Sal Ⅰ酶切、连接、PCR鉴定及酶切鉴定,成功获得了pDS132- ΔSRP突变重组质粒。将阳性质粒pDS132- ΔSRP转化大肠杆菌β2155感受态细胞,通过结合实验再转化RA血清2型,双抗性负筛选结果表明成功获得了△SRP基因工程突变菌株。
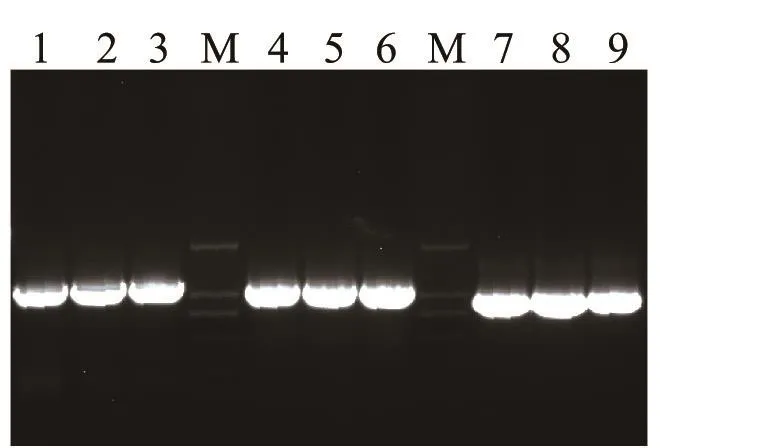
图1 SRP左臂基因、右臂基因和氨苄抗性基因的扩增结果Fig.1 Amplif i cation of SRP left arm, right arm and Ampicin resistance gene1~3: 左臂基因; 4~6: 右臂基因; 7~9: 氨苄抗性基因; M: DNA分子量标准(DL2000)1-3: Left arm gene; 4-6:Right arm gene; 7-9: Ampicin resistance gene; M: DNA Marker(DL2000)
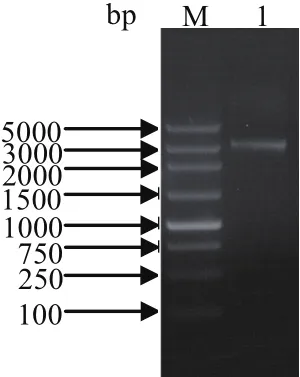
图2 缺失SRP基因的基因片段的构建Fig.2 Construction of the fragment defected SRP geneM: DNA分子量标准; 1: 缺失SRP基因的基因片段M: DNA Marker; 1: Fragment defected SRP gene
2.2 血清2型RA△SRP基因工程突变菌株生物学特性研究 野生型菌株和△SRP基因工程突变菌株在铁丰富和限铁环境中的生长曲线见图3。在铁丰富环境中,△SRP基因工程突变菌株与野生型菌株生长曲线无明显差异;而在限铁环境中,△SRP基因工程突变菌株生长速度显著慢于野生型菌株,对数生长期起始时间较野生型晚约10 h,表明SRP基因与鸭疫里默氏杆菌在限铁环境中的铁离子摄取密切相关。
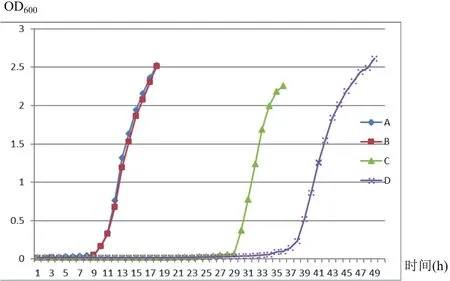
图3 野生型和突变株在TSB和限铁培养基中的生长曲线Fig.3 Growth curves of the wild type and mutant strain in TSB and iron limited mediumA: 野生型(TSB培养基); B: 突变株(TSB培养基); C: 野生型(限铁培养基); D: 突变株(限铁培养基)A: Wild type(TSB medium); B: Mutant(TSB medium); C:Wild type(iron limited medium); D: Mutant(iron limited medium)
2.3 RA血清2型△SRP基因工程突变菌株的动物攻毒试验 动物攻毒试验表明,在6×106CFU/mL和1.2×106CFU/mL的攻毒剂量下,△SRP基因工程突变菌株的致死率低于野生菌株。野生型菌株攻毒雏鸭24 h后开始死亡,突变菌株是在攻毒48 h后开始死亡,说明突变菌株在体内增殖并达到致死数量的速度明显要晚于野生型。构建的RA血清2型△SRP基因工程突变菌株毒力有所下降,表明SRP基因与菌株的毒力相关。
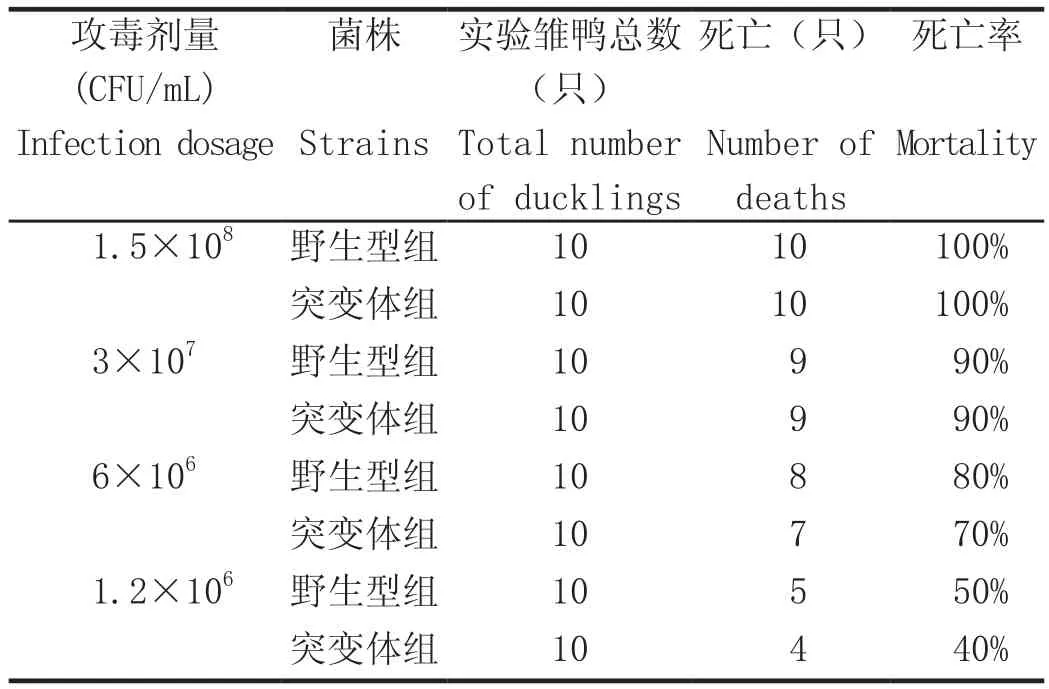
表2 突变菌株动物攻毒试验结果Table 2 Statistical table for the animal challenge experiment
3 讨论
Schade等[8]1944年证明蛋清中的某种成分能够抑制一些细菌的生长,但加入铁离子后这种抑制即可被消除。1946年Schade等[9]在Science上首次报道了“人血清的铁结合成分”,随后他们的研究表明在介导细菌生长方面,铁和铁结合蛋白存在相互作用。铁是致病菌重要的生长因子,但莱姆病的病原体博氏疏螺旋体除外。博氏疏螺旋体选择性地丢失了编码铁依赖蛋白的基因,因此它可以在低铁环境中持续生长[10]。大多数病原菌要求铁的浓度在10-6~10-7mol/L之间,以维持对其复制至关重要的代谢过程,如电子传递、糖酵解、DNA合成以及对毒性ROI的抵抗作用[11]。在目前研究的绝大多数细菌中都存在特殊的铁摄取系统,这些铁摄取系统可能是的古老的致病菌为了适应宿主哺乳动物细胞进化而成。
随着RA全基因组测序和致病机制研究的不断深入,越来越多的研究证实铁离子摄取系统是RA致病机制的重要组成部分。Liu等[12]利用转录组测序方法分析了RA CH-1株在限铁环境中的基因表达状况,结果表明共有80个基因上调表达,383个基因下调表达,差异表达基因主要涉及细菌的铁稳态,如潜在的TonB依赖的受体蛋白系统、HmuY样蛋白依赖的血红素摄取系统、Feo系统、饥饿应激相关基因簇以及一系列的假设蛋白。Wang等[13]对RA CH-1菌株B739_1208基因进行了深入研究,构建了该基因的突变株,LD50试验显示突变株半数致死量为野生型的10倍,表明突变株毒力明显下降。生长曲线试验显示突变株在TSB培养基中比野生型生长速度显著降低,表明该基因参与RA的铁摄取系统,是其毒力因子之一。Liao等[14]研究RA 菌CH-1菌株的外膜蛋白血红素(hemin)结合蛋白,结果表明血红素结合蛋白参与血红素的摄取,血红素结合试验显示RA结合血红素,而限铁环境能增强这种能力,因此推测RA血红素摄取系统受铁离子的调节。Miao等[15]对RA CH3菌株的TonB1和TonB2蛋白在铁摄取和毒力中的作用进行了研究,结果发现CH3野生型能够利用构建的血红素作为铁离子来源,但TonB1的突变株中氯化高铁血红素(haemin)铁摄取能力被缺失;TonB1和TonB2突变株对Vero细胞的吸附和入侵显著减少,其半数致死量分别比相应野生型高224倍和87倍,推测TonB1蛋白参与haemin摄取系统,而TonB1、TonB2两者对于RA的最佳致病力是必需的。Liao等[16]对RA血红素(hemin)转运系统中的两个蛋白TonB(TonB1和TonB2)进行了研究,结果显示缺失TonB1的突变株对血红素的摄取没有影响,而TonB2的突变株则明显减少了血红素的摄取,TonB1和TonB2的双突变株则停止了外源血红素的运输,同时TonB2的突变株在限铁环境中生长缓慢,然而TonB1的突变株则不受影响。Tu等[17]对RA CH3菌株的铁载体互作蛋白进行了研究,结果表明铁载体互作蛋白参与铁离子的利用,其缺失株能显著减少RA生物膜的形成,缺失株的半数致死量比野生型高35倍,显示铁载体互作蛋白参与铁离子摄取,是RA完全毒力的必需毒力因子。Lu等[18]对RA TonB依赖的受体(TdbR1)进行了研究,发现TdbR1突变株显著减少了生物膜的形成以及对Vero细胞的吸附和入侵,相对野生型而言,其半数致死量增加了45倍,同时突变株在血液、肝脏和脑中的细菌载量与野生型相比明显减少,研究结果表明TdbR1参与血红素(hemin)铁离子的摄取,是RA重要致病因子。
本研究探讨了RA外膜ATP依赖的铁载体受体蛋白(siderophore receptor protein, SRP)在细菌铁离子摄取机制中的作用以及与细菌毒力之间的关系。TSB培养基和限铁培养基中的生长曲线表明SRP基因突变株在限铁环境中比在TSB培养基生长慢约10 h,对RA在体内维持铁离子代谢起至关重要的作用。动物试验结果显示野生型菌株攻毒雏鸭24 h后开始死亡,突变菌株在攻毒48 h后开始死亡,说明突变菌株在体内增殖并达到致死数量的速度明显要晚于野生型,SRP基因与RA的毒力相关。
