猪流行性腹泻病毒和猪繁殖与呼吸综合征病毒混合感染的诊治
2018-07-26赵海忠李良华李明波宋忠旭彭先文梅书棋
赵海忠,李良华,李明波,宋忠旭,孙 华,彭先文,梅书棋
(湖北省农业科学院畜牧兽医研究所 动物胚胎工程及分子育种湖北省重点实验室,武汉 430064)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)感染猪引起的一种急性、高度接触性肠道疾病,临床上以排水样稀粪、呕吐、脱水为特征。2010年以来,变异PEDV引起的PED在全国范围内暴发流行,变异主要集中在S蛋白的S1基因区域,这种疫病的流行对新生仔猪的生存产生极大威胁,给养猪产业造成巨大的经济损失[1,2]。猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的高度接触感染性传染病,以出现发热、眼结膜水肿、呼吸衰竭、关节肿胀、间质性肺炎等综合症状为主。我国PRRSV流行毒株以美洲型为主[3],以HP-PRRSV为优势毒株,而经典毒株和新变异毒株也同时存在,呈现多样化趋势,给该病的诊断和防控带来很大困难[4]。
2017年2月初,寒潮致气温骤降,湖北省某规模化猪场猪群发生严重腹泻,共造成仔猪死亡350多头。经过对疫病发生、发展规律的详细了解,结合流行病学调查、临床剖检初步诊断为PED。采样送实验室进行病原学诊断,确诊为PEDV混合感染PRRSV。采取综合防控措施后,腹泻疫情得到有效控制。本例PEDV混合感染PRRSV具有实践特异性,其诊断、治疗的有效性对养猪具有良好的参考价值。
1 材料与方法
1.1 样品 采集发病仔猪粪拭子1~10号样品10份;采集疑似发病仔猪血清11~15号样品5份,冷藏保存后送实验室检测。
1.2 主要仪器 德国Eppendorf离心机、EDC-810型PCR扩增仪、Bio-RAD凝胶成像系统、DYY-8C型电泳仪等。
1.3 主要试剂与实验动物 病毒提取使用的试剂盒Mini BEST Viral DNARNA Extraction Kit Ver.4.0、RT-PCR检测使用的试剂盒Premix Script One Step RT-PCR Kit Ver.2等购自宝生物工程(大连)有限公司;阳性对照样品由动物胚胎工程及分子育种湖北省重点实验室保存;SPF级昆明小鼠购自武汉生物制品研究所实验动物中心。
1.4 检测方法
1.4.1 流行病学调查和临床剖检 详细了解该规模猪场猪群发病过程、主要临床症状、发病死亡情况,分析前期主要疫病的抗原抗体监测结果,以及猪群免疫程序、药物保健方案等防控措施,观察发病猪的临床症状,选取具有典型临床症状发病猪3头进行解剖,记录主要脏器病变特征。
1.4.2 细菌的分离及致病性鉴定 取10份粪拭子样品分别接种营养肉汤培养基,37℃过夜培养。将增菌液用接种环在LB培养基平板划线,37℃培养18~24 h后观察培养特性。然后从每个平板挑取至少5个菌落,接种于麦康凯培养基平板,置37℃培养18~24 h,观察分离细菌生长的菌落特点,同时用该菌落涂片,革兰氏染色后镜检。挑取菌落移植马丁肉汤,培养24 h,取培养物用蛋白胨水稀释为2×109CFU/mL,皮下注射18~22 g SPF级昆明小鼠10只(0.5 mL/只),对照组注射生理盐水,同等条件下饲养。连续观察7 d,记录其发病死亡情况。
1.4.3 RT-PCR诊断 根据GenBank收录的PEDV的M基因、传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)的N基因、猪轮状病毒(Porcine rotavirus,PoRV)的VP7基因、PRRSV的ORF7基因、PRRSV的NSP2基因cDNA序列设计特异性引物,引物由宝生物工程(大连)有限公司合成。样品经过处理后用含DEPC的PBS进行稀释,涡旋混匀,4℃、2000×g离心15 min。收集上清液,按照病毒核酸提取试剂盒说明书立即提取RNA,并按反应体系要求进行RT-PCR扩增,待反应结束后取产物进行2%的琼脂糖凝胶电泳,用凝胶成像系统观察结果。
1.4.4 基因测序分析 对PEDV扩增产物阳性条带明显的1号、9号样本cDNA,使用引物(PEDV S1-F、PEDV S1-R)扩增S1片段[5],送武汉擎科生物技术有限公司测序。从GenBank数据库中搜集PEDV参考毒株的S基因,对比本研究中测序毒株与其他参考毒株同源性,分析所测得序列与其他毒株的遗传进化关系。
对PRRSV扩增产物阳性条带明显的11号、13号样本cDNA,使用引物(ORF5-F、ORF5-R)扩增ORF5基因片段[6],送武汉擎科生物技术有限公司测序。根据基因测序结果,通过氨基酸比对,分析本场PRRSV毒株与不同疫苗毒株的同源性及遗传进化关系。
2 结果与讨论
2.1 流行病学调查结果 该猪场后备猪首先发生腹泻,猪群表现采食量下降,排灰色稀便,3 d后扩散到保育猪、育肥猪,随后迅速蔓延到产房,哺乳仔猪全面爆发腹泻,发病率达到100%。其中,7日龄以内的新生仔猪尤为严重,病程1~2 d,死亡率达95.4%;保育舍刚断奶仔猪腹泻伴发喘气,发病率31.1%,病死率23.7%。场内常规免疫程序:妊娠母猪产前20 d肌注T-P二联灭活苗,母猪分娩后14 d免疫PRRS JXA1-R株活疫苗。该猪场1月份检测报告显示,哺乳仔猪猪瘟病毒、伪狂犬病毒和圆环病毒病原检测均为阴性。
2.2 临床症状及剖检变化 7日龄以内新生仔猪发生严重腹泻,其主要临床症状为:呕吐,严重腹泻,腹泻物中含凝乳小块,呈黄色或白色,有腥臭味;畏寒,食欲下降,极度消瘦,最后脱水死亡。腹泻伴发典型的呼吸道症状的猪主要为断奶转入保育阶段群体,体重10 kg左右,表现为高热(40.5℃以上)、双耳皮肤青紫色、咳嗽、腹式呼吸。解剖后主要病理变化为:腹股沟淋巴结肿大充血,肾脏表面少量点状出血,胃内有大量未消化的凝乳块,胃底部溃疡,肠系膜淋巴结坏死,小肠空虚、胀气,肠壁变薄呈透明状(图1)。
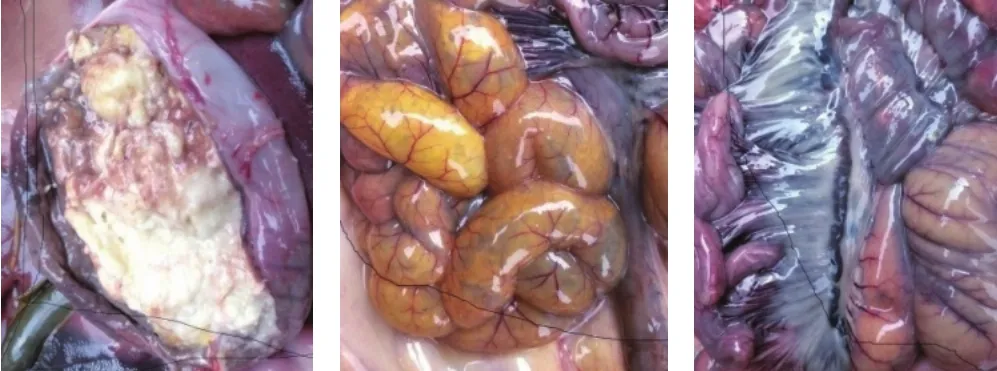
图1 胃、小肠、肠系膜淋巴结病理变化Fig.1 Pathological changes of stomach, intestinum tenue and mesenteric lymph node
2.3 细菌的分离及致病性鉴定结果 10份粪拭子样品分离纯化大肠杆菌,培养结果见图2,革兰氏染色阴性。各组SPF小鼠均无死亡且精神正常,表明分离到的细菌均为非致病性。
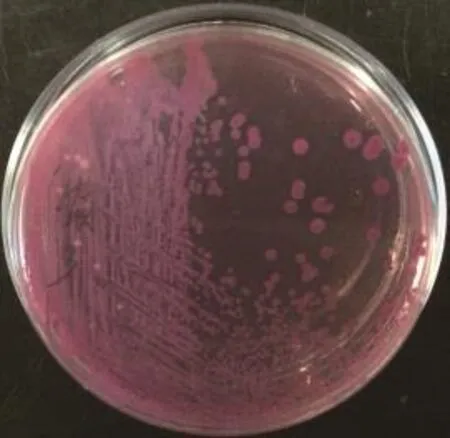
图2 大肠杆菌培养结果Fig.2 Culture results of E. coli
2.4 RT-PCR检测结果 对10份粪拭子样品进行PEDV的M基因、TGEV的N基因和PoRV的VP7基因扩增。检测结果显示,10份样品中全部扩增出M基因668 bp的片段,未扩增出N基因528 bp的片段和VP7基因333 bp的片段,表明检出PEDV阳性比例为100%,TGEV、PoRV均为阴性(图3)。
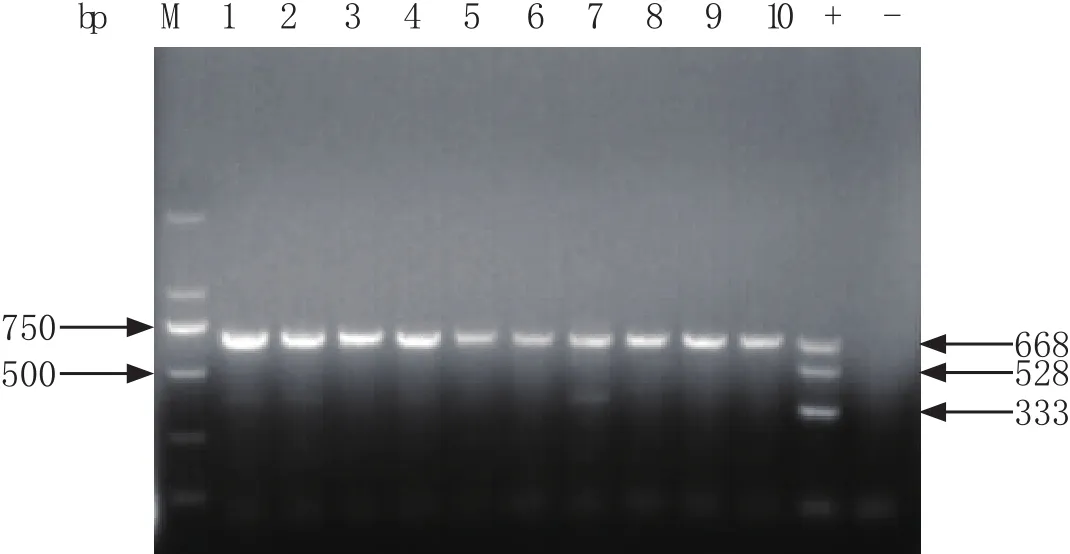
图3 PEDV、TGEV和PoRV RT-PCR扩增产物Fig.3 RT-PCR result of PEDV, TGEV and PoRVM: DNA分子量标准; 1~10: 样品检测结果; +: 阳性对照(PEDV M基因、TGEV N基因、PoRV VP7基因); -: 阴性对照M: DNA Marker; 1-10: Sample; +: Positive control(PEDV M gene, TGEV N gene, PoRV VP7 gene); -: Negative control
对5份血清样品分别进行PRRSV的ORF7基因、NSP2基因扩增。检测结果显示,5份样品均扩增出ORF7基因434 bp的片段,2份样品扩增出NSP2基因678 bp的片段,美洲型PRRSV阳性率100%,PRRSV变异毒株阳性率为40%(图4、5)。

图4 PRRSV ORF7基因RT-PCR扩增产物Fig.4 RT-PCR amplif i cation of PRRSV ORF7 geneM: DNA分子量标准; 11~15: 样品检测结果; +: 阳性对照(美洲型PRRSV); -: 阴性对照M: DNA Marker; 11-15: Sample; +: Positive control(American type PRRSV); -: Negative control
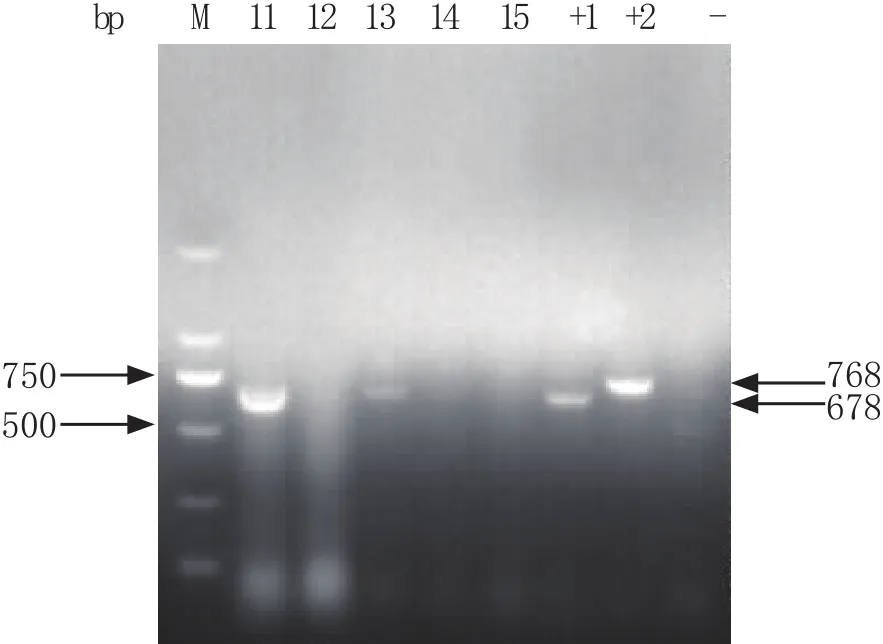
图5 PRRSV NSP2基因RT-PCR扩增产物Fig.5 RT-PCR amplif i cation of PRRSV NSP2 geneM: DNA分子量标准; 11~15: 样品检测结果; +1: 阳性对照(变异PRRSV); +2: 阳性对照(经典PRRSV); -: 阴性对照M: DNA Marker; 11-15: Sample; +1: Positive control(variation of PRRSV); +2: Positive control(classic PRRSV); -: Negative control
2.5 PEDV的S1基因测序结果 取1号、9号样品PEDV S1基因扩增产物进行测序,分别得到序列292 HBWH.17.6-1、293 HBWH.17.6-2,测序结果表明为同一PEDV变异毒株。与NCBI GenBank数据库不同参考株S1片段进行比对,结果表明,样品毒株与主要流行疫苗株CV777-vaccine、AJ1102和YN同源性分别为86.2%、97.9%和97.4%(表1,图6)。
2.6 PRRSV的ORF5基因测序结果 取11号、13号样品PRRSV ORF5基因扩增产物测序,分别得到序列144 HBWH-1/2017.6.26、145 HBWH-2/2017.6.26,测序结果表明为同一毒株,与不同疫苗株ORF5基因核苷酸差异性比较结果见表2,氨基酸比对结果见图7,遗传进化树分析结果见图8。结果表明,样品毒株与JXA1-R和HuN-F112疫苗毒株的核苷酸同源性分别为98.5%和99.2%。
2.7 病因分析
2.7.1 PEDV高度变异导致经典株疫苗免疫保护效果不佳。尽管妊娠期母猪跟胎免疫流行性腹泻—传染性胃肠炎二联灭活疫苗(疫苗毒株:CV777),初生仔猪仍不能免受PEDV感染。病例PEDV属G2亚群,其S基因呈现特征性的变异,与经典疫苗株CV777(属G1亚群)同源性仅86.2%,这可能是疫苗不能提供有效免疫保护的主要原因。由于疫苗保护力有限,发病猪场母乳也会带毒,新生仔猪会通过哺乳而感染,必须强化免疫提升母猪免疫力,消除母猪带毒和奶水排毒,为新生仔猪提供被动免疫保护[7]。
2.7.2 PEDV和PRRSV相互作用、相互影响,使发病猪临床症状更为复杂,进一步加深了临床防控难度。PRRSV高度变异,毒株之间交叉保护力低,猪场间PRRSV毒株存在差异。病例样品毒株与疫苗株JXA1-R核苷酸同源性仅为98.5%,表明检测到的PRRSV为变异野毒感染。临床上,猪感染PRRSV后,导致机体免疫机能低下,易增加其他疫病感染几率和治疗难度。猪感染PEDV后,耐过猪胃肠道受损严重,生长猪肠道形态和完整性发生改变。混合感染PRRSV后,尽管PRRSV对猪肠道形态和完整性几乎没有破坏,但与PEDV协同加重肠道损伤程度,猪生长性能将显著下降[8]。根据基因测序结果,可以从分子水平为疫苗的选择和防控方案的制定提供科学依据。
2.7.3 PEDV变异导致针对性免疫效果不佳,同时感染PRRSV使病症加重。外在低温冷应激,不合理断奶转群则是引起仔猪抵抗力下降,易感PEDV的直接原因。一方面必须搞好生物安全措施,阻断区域内患病猪场腹泻疫情的传入,这是猪场发生腹泻疫情的最重要原因,同时避免感染PRRSV,减轻感染PEDV的症状;另一方面必须注意做好保暖,不给腹泻发生创造条件,也不给PEDV感染发生的机会。

表1 PEDV S1基因核苷酸差异性比较Table 1 Nucleotide comparison of PEDV S1 gene
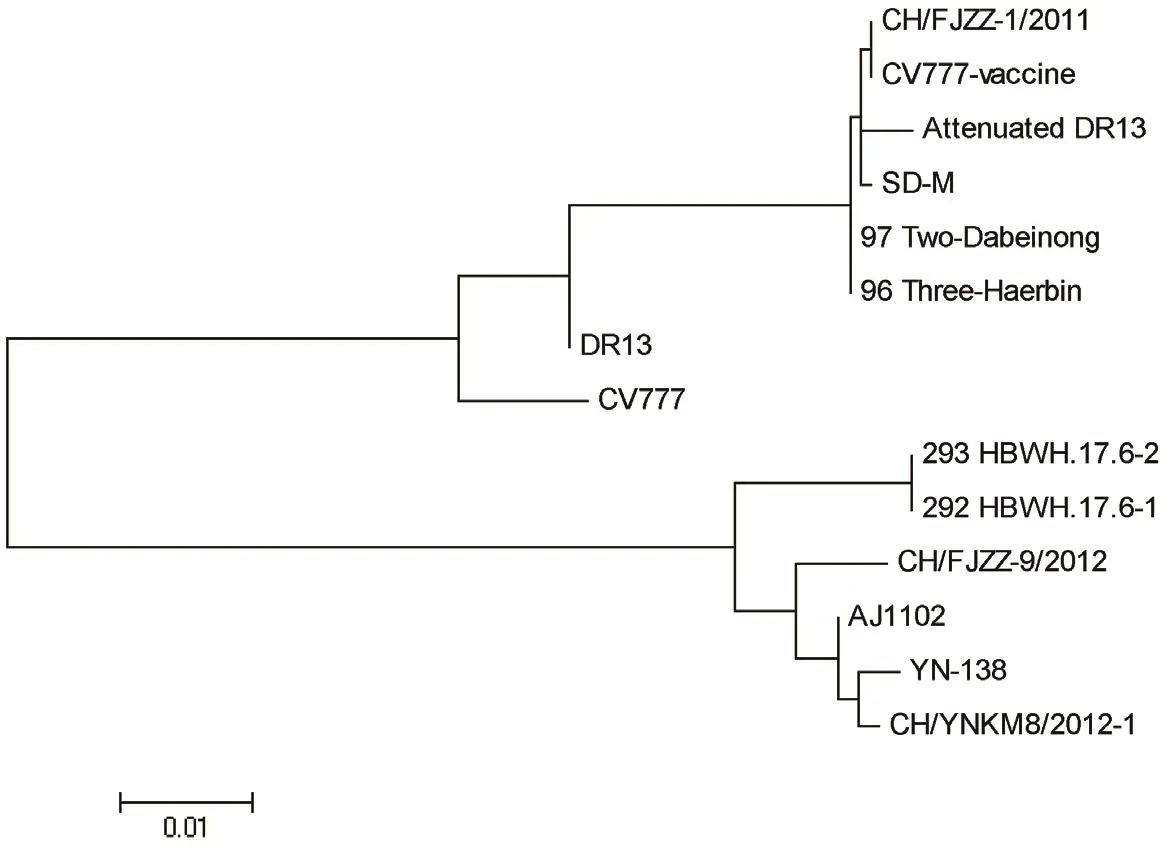
图6 PEDV S1基因遗传进化树分析Fig.6 Phylogenetic tree of PEDV S1 gene

表2 PRRSV ORF5基因核苷酸差异性比较Table 2 Nucleotide comparison of PRRSV ORF5 gene
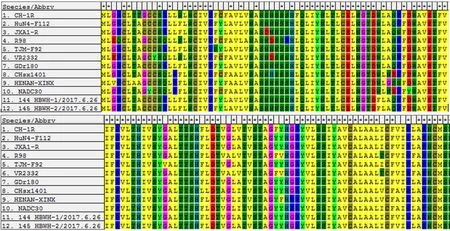
图7 PRRSV ORF5基因氨基酸比对结果Fig.7 Results of amino acid comparison of PRRSV ORF5 gene
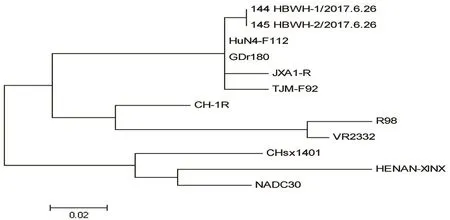
图8 PRRSV ORF5基因遗传进化树分析Fig.8 Phylogenetic tree of PRRSV ORF5 gene
2.8 综合防控方案
2.8.1 免疫接种 猪场所有公母猪紧急免疫,口服PED活疫苗1头份,7 d后加强免疫变异株T-P二联灭活苗1头份。活疫苗可以刺激肠道黏膜产生IgA,使机体产生免疫记忆,有利于提高灭活苗的免疫效果,从而使母猪产生更高效的母源抗体[9]。在腹泻高发季节定期监测母猪血清IgA,根据监测情况评估后制订腹泻常规免疫程序,建议在冬春季节强化基础免疫(普免),妊娠母猪常年实行跟胎免疫;14日龄仔猪免疫PRRS活疫苗1头份。
2.8.2 对症治疗 制定针对性治疗方案,可适当使用药物控制细菌性疾病的继发感染;对7日龄内没有治疗价值腹泻小猪进行无害化处理,减少传染源;对腹泻症状轻微患病仔猪口服自制补液剂;临床症状严重者及时进行补液、抗感染等治疗;处于恢复期猪群在饲料中添加抗生素、黄芪多糖控制混合感染,同时在饮水中添加葡萄糖、电解多维增强猪体质,或添加益生菌,提高肠道的修复能力。
2.8.3 生物安全措施 严格控制外来车辆、人员进场,工作人员隔离串岗;搞好猪舍清洁卫生和消毒工作,粪便及时清理后无害化处理,切断病毒在猪场内的传播,降低猪场病毒载量;产房工具尽量专用或彻底消毒,避免交叉传播;实施全进全出的饲养方式,小批量多批次,严禁从疫区和发病猪场引种;制定应急处理方案。
2.8.4 饲养管理 母猪精细化饲养,保证母乳充足,定时哺乳;稳定保持产房温度26℃~28℃,在28℃条件下PEDV感染活性降低,避免温度骤降诱发哺乳仔猪、保育仔猪感染发病;适时通风换气,湿度控制在65%以下,保持猪舍相对干燥;仔猪尽早上料,减少断奶应激;仔猪转群前注射抗应激药物,如肌注长效土霉素1 mL。经实施综合防控,仔猪群健康水平好转,腹泻停止。
临床上腹泻大多是由多重因素共同作用,多种病原并存,各养殖场及时找出病因,查出病原,因地制宜地采取针对性的防控措施才能取得较好的效果[10]。
