扶桑绵粉蚧交配行为及能力的研究
2020-11-11潘志萍陆永跃
孙 峰,潘志萍,陆永跃*
(1. 华南农业大学植物保护学院,广州 510642;2. 广东省科学院动物研究所,广东省动物保护与资源利用重点实验室, 广东省野生动物保护与利用公共实验室,广州 520620)
昆虫多以两性生殖方式进行后代繁殖,其特点是雌雄个体必须通过两性交配使雄成虫的精细胞与雌成虫体内的卵细胞结合形成受精卵以开始新个体的发育。因此,交配是两性生殖的昆虫选择配偶及繁衍后代最重要、最基本的环节 (Miyatake,1997)。交配行为的本质就是刺激雌虫产卵 (Opp,1986),雄性个体通过交配增加其基因的传播机会,提高雄性的遗传适合度 (张延华,2006) ,雌性个体在交配过程中可以得到雄虫的精液或者精囊中的营养物质,提高雌虫的生殖能力(Tregenza,1998) 。因此,在复杂多变的外界环境下,雌虫、雄虫通过多次交配,对后代种群增长和进化具有重要作用(王超等,2014)。
扶桑绵粉蚧PhenacoccussolenopsisTinsley 是 2008年发现入侵中国大陆的重要害虫 (陆永跃等,2008; 武三安和张润志,2009),并随着入侵发生范围扩大,其寄主范围呈逐步增大的趋势(Arifetal.,2009; 张润志等,2010)。研究表明,由于该虫在我国潜在分布地区广泛,我国大部分地区都适合扶桑绵粉蚧生存,若全面暴发将造成近100 亿的重大损失,对农业、林业生产构成较大的威胁(王艳平等,2009)。
目前,扶桑绵粉蚧的生殖方式仍存在争议。有报道认为扶桑绵粉蚧可营两性生殖和孤雌生殖 (Vennilaetal.,2010; Sahitoetal.,2010) ,但也有一些研究认为该虫只营两性生殖(Arifetal.,2012; Prasadetal.,2012 ) 。王超等(2014)对我国广东、广西、海南、福建、上海、浙江、安徽、湖北等地11个入侵种群生殖方式调查中仅发现了该虫的两性生殖行为。笔者在试验过程中发现类似情况,扶桑绵粉蚧种群在无雄虫情况下雌虫不能产卵。因此,在扶桑绵粉蚧两性生殖种群中,雌雄成虫的交配行为、交配能力对种群的繁殖显得非常重要。本文仅从扶桑绵粉蚧的交配行为及交配能力进行观察,以期明确其交配行为和交配能力,以期为进一步了解扶桑绵粉蚧的交配行为和性信息素研究提供科学依据。
1 材料与方法
1.1 供试虫源及饲养方法
供试扶桑绵粉蚧采自广州地区的扶桑,采回的扶桑绵粉蚧在室温下接入扶桑植株饲养3代后备用。试验中扶桑绵粉蚧采用培养皿饲养进行观察,用细毛笔小心挑选2龄若虫,将若虫置于备用的培养皿(直径9 mm)里的扶桑叶片上。每培养皿中的叶片采自实验室种植的健康扶桑植株,叶片下加上一层培养基,以保持叶片新鲜。培养皿口用保鲜膜紧密覆盖,保鲜膜上用昆虫针扎80~100个小孔,保持气流通畅,保证试虫不能爬离培养皿。定期更换培养基和叶片。待观察到雄虫进入预蛹状态,则把雄虫与雌虫隔离饲养,从而获得未交配的扶桑绵粉蚧雄虫和雌虫。
1.2 扶桑绵粉蚧交配节律和行为的观察
观察培养皿中扶桑绵粉蚧雄虫的羽化时间,把羽化后的扶桑绵粉蚧雄成虫与雌成虫放置于同一个培养皿中,观察其交配行为。同时,把刚进入成虫期的扶桑绵粉蚧雌虫与雄成虫放置于同一个培养皿中,观察和记录其交配时间和交配行为。
1.3 扶桑绵粉蚧雄虫交配能力的观察
在每个培养皿中放置10头扶桑绵粉蚧2日龄以上未交配的雌成虫,然后用毛笔小心挑选扶桑绵粉蚧未交配的雄成虫置于各培养皿中,每皿引入1头雄虫,设30组重复。培养皿口用保鲜膜紧密覆盖,保鲜膜上用昆虫针扎80~100个小孔,观察扶桑绵粉蚧雄成虫的交配能力,至雄虫死亡,记录交配时间和交配次数。
1.4 扶桑绵粉蚧雌虫交配能力的观察
在每个培养皿中放置1头扶桑绵粉蚧2日龄以上未交配的雌成虫,用毛笔小心挑选扶桑绵粉蚧未交配的雄成虫置于各培养皿中,每皿引入5头雄虫,设30组重复。培养皿口用保鲜膜紧密覆盖,保鲜膜上用昆虫针扎80~100个小孔,观察扶桑绵粉蚧雌成虫的交配能力,至雄虫死亡,记录交配时间和交配次数。
2 结果与分析
2.1 扶桑绵粉蚧的交配节律
扶桑绵粉蚧雄虫的羽化时间主要集中在凌晨3 ∶00-6 ∶00,雄虫羽化出来之后可以立刻寻找雌虫进行交配。而雌虫经第三次蜕皮进入成虫后不会立刻进行交配,当雌虫蜕皮后约24 h后,雄虫才渐渐地靠近雌虫,进行交配。
将扶桑绵粉蚧未交配的雌虫和雄虫置于同一培养皿中,雄虫很快爬向雌虫,可在任意时间进行交配。交配前,雌虫始终处于被动地位,大多数时间都固定在寄主植物上,而雄虫在交配中处于主动性,当雄虫感应到雌虫后,会爬向雌虫。当雄虫接触到雌虫后,多数雌虫会很快感应到雄虫接近,然后抬起尾部,以接受雄虫交配。雄虫找到雌虫后不能立刻交配成功,雄虫在雌虫背部来回爬动,腹部则不断向下弯曲以寻找雌虫生殖器。当雄虫生殖器与雌虫生殖器交合成功,即交配开始,此时雄虫的足紧紧抓住雌虫尾部,几乎呈静止状态。当交配结束,多数雄虫会扑打翅膀,然后爬向另一头雌虫,进行下一次交配。
2.2 扶桑绵粉蚧雄虫的交配能力
当把1头雄虫放入有10头雌虫的培养皿中,雄虫会很快寻找雌虫,并与之交配。通常情况下,雄虫与1头雌虫交配结束之后,会很快寻找下一头雌虫进行交配,1头雄虫可以连续与多头雌虫进行交配,但也有少数情况,雄虫与同一头雌虫进行1次以上交配。在所观察扶桑绵粉蚧30头雄虫分别与10头雌虫的交配中,雄虫交配次数为3~10次不等(图1),其中以交配6次所占的比率最大(26.7%),其次为交配8次(20%),平均每头雄虫交配6.9次。
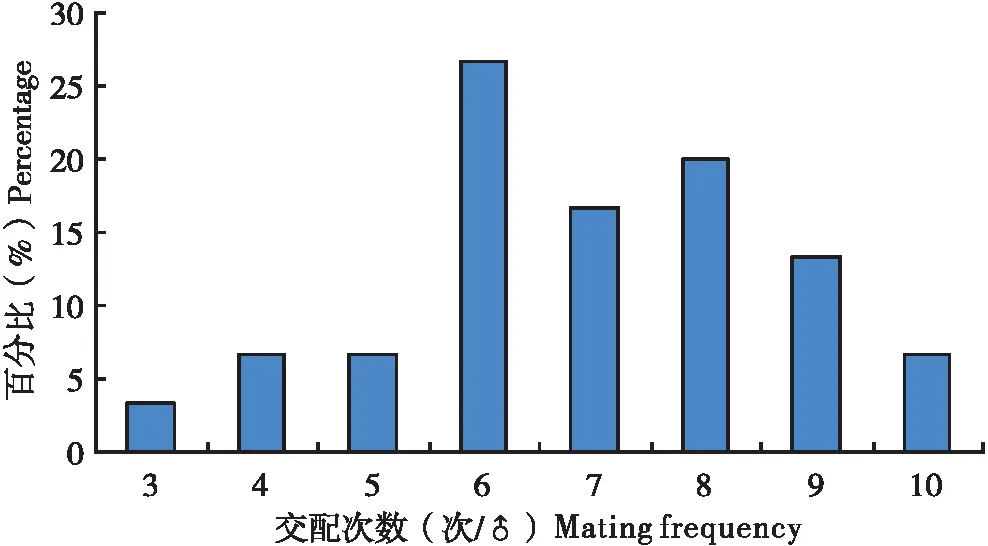
图1 扶桑绵粉蚧单头雄虫的交配次数分布Fig.1 Distribution of mating frequency of single male of Phenacoccus solenopsis
所观察扶桑绵粉蚧1雄多雌的交配中,每一头雄虫交配时间差异较大,需18.1 ~228 min,平均每头雄虫交配总时间为79.9 min,如果将单头雄虫交配时间跨度按30 min一个等级进行划分时发现(图2),单头雄虫交配时间比较分散,不同虫体之间差异较大。

图2 扶桑绵粉蚧单头雄虫交配时间分布Fig.2 Distribution of mating time of single male of Phenacoccus solenopsis
试验中30头雄虫总共交配208次,每一次交配持续时间长度差异较大,从1.8~76.5 min不等,平均每次交配时间为11.5 min,如果将交配持续时间跨度按10 min一个等级进行划分时发现(图3),持续时间在10 min以内的发生概率最大(68.8%),持续时间为10~20 min的发生概率次之(18.3%),这表明在扶桑绵粉蚧1雄多雌的交配中,大多数交配时间都在10 min以内完成。
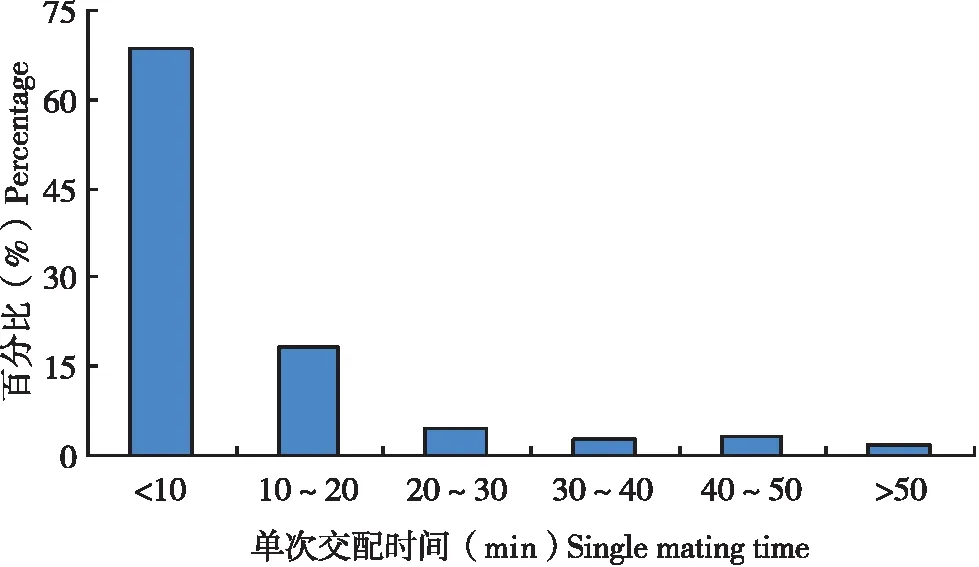
图3 扶桑绵粉蚧雄虫单次交配时间分布Fig.3 Distribution of single mating time of Phenacoccus solenopsis male
2.3 扶桑绵粉蚧雌虫的交配能力
试验中,当把5头雄虫放入只有1头雌虫的培养皿中,不多久就会有雄虫爬来与之交配,当其中1头雄虫与雌虫交配时,其它雄虫因为寻找不到雌虫,也会爬向这1头雌虫,并且在雌虫背部来回爬动,雄虫交配器不断向下弯曲,试图与之交配,在多次试图交配未果后,这些雄虫则爬离雌虫。在所观察扶桑绵粉蚧30头雌虫分别与5头雌虫的交配中,单头雌虫的交配次数为1~4次不等(图4),以交配2次所占的比率最大(40.0%),其次为交配3次(33.3%),平均每头雌虫交配2.3次。
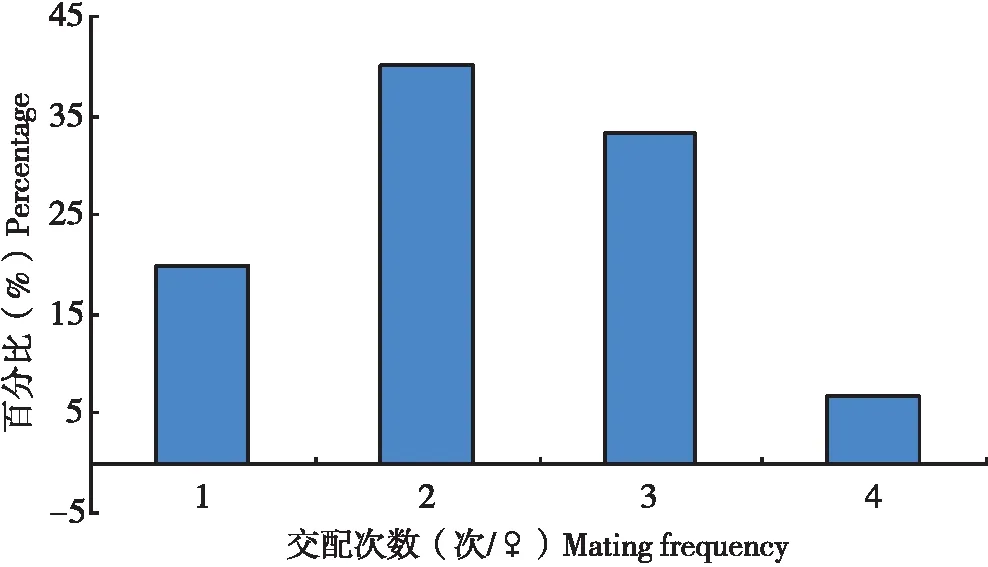
图4 扶桑绵粉蚧单头雌虫交配次数分布Fig.4 Distribution of mating times of single female of Phenacoccus solenopsis
在所观察扶桑绵粉蚧1雌多雄的交配中,每一头雌虫交配时间差异较大,从10.6 min到83.7 min不等,平均每头雌虫交配总时间为36.3 min,如果将单头雌虫交配总时间跨度按10 min一个等级进行划分时发现(图5),单头雌虫交配时间比较分散,不同虫体之间差异较大。
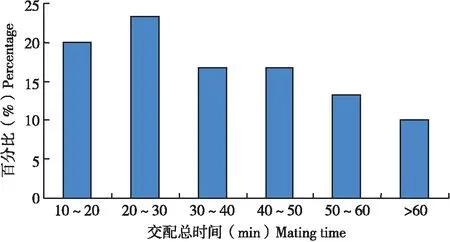
图5 扶桑绵粉蚧单头雌虫交配时间Fig.5 Mating time of single female of Phenacoccus solenopsis
30头雌虫总共交配68次,每一次交配持续时间差异明显,从4.4 min到51.5 min不等,平均每次交配时间为16 min,如果将交配持续时间跨度按10 min一个等级进行划分时发现(图6),持续时间在10 min以内的发生概率最大(41.2%),持续时间为10~20 min的发生概率次之(30.9%)。这表明在单次交配中,1雌多雄的平均交配持续时间长于1雄多雌的平均交配时间。

图6 扶桑绵粉蚧雌虫单头交配时间分布Fig.6 Distribution of single mating time of Phenacoccus solenopsis female
3 结论与讨论
本研究通过观察发现扶桑绵粉蚧雌雄虫均可以多次交配,其中雄虫的交配能力强于雌虫,雄虫羽化后即寻找雌虫进行交配,此时,雄虫不再取食,当雄虫完成交配任务后,会很快死去,而雌虫交配后对寄主的取食和危害更大,当雌虫个体生物量达到最大时,开始繁殖产出下一代。这样有利于所有雌虫得到顺利交配,同时雌虫有巨大的繁殖力,从而有利于扶桑绵粉蚧种群数量的迅速扩大,容易爆发成灾。扶桑绵粉蚧在交配中的每次交配时间差异较大,从1.8 min到76.5 min不等,但是多数时候都在10 min以内(68.8%),但雌虫交配时间与最终繁殖量是否有关联,需要作进一步研究。
研究发现,扶桑绵粉蚧雄虫对雌虫则有较强的搜索能力,即便把雌虫放置在隐蔽的地方,雄虫也可以通过嗅觉来寻找到雌虫并进行交配。完全交配后的雌虫对雄虫没有吸引作用,即使把雄虫放置在完全交配后的雌虫旁边,雄虫并不会靠近雌虫,推测雌成虫自身分泌性信息素有关。性信息素在性成熟的处女蚧中一直存在, 但其释放不是连续不断, 而是可以控制的。雌成虫只有在求偶时才释放性信息素引诱雄成虫前来交配(周林等,1999)。交配可直接影响性信息素的释放。松突圆蚧未交配雌成蚧和去壳处女蚧均对雄蚧具引诱作用,而交配1 h后的雌蚧逐渐失去引诱雄蚧的能力(杜家纬等,1991)。日本松干蚧雌蚧一旦交配,便马上停止性信息素的分泌和释放(祁云台等,1983)。同样,本研究也观察到类似的情况,扶桑绵粉蚧雌成虫一旦交配后,雄成虫就不再靠近雌成虫,推测其停止性信息素的分泌和释放,从而不再吸引雄成虫。
利用性信息素,应用诱杀技术和交配干扰技术,可以达到防治害虫目的。应用昆虫性信息素,能有效地减少化学农药所造成的环境污染、害虫产生抗性以及杀伤天敌等问题,保护生态系统平衡,在害虫的治理中具有十分重要的作用。目前,尚未见利用该诱杀技术大面积防治蚧虫的报道,但已有这方面研究报道。据以色列报道,交配干扰能成功地用作为红圆蚧的防治措施(韩桂彪,1999)。祁云台等(1989)采用屋脊式纸板诱捕器在江苏无锡大浮松林中对日本松干蚧进行小规模的诱杀试验, 获得了明显的诱虫效果。本研究观察到采自广州的扶桑绵粉蚧种群的生殖方式仅为有性生殖,即无雄虫存在的情况下雌虫不能产卵,因此可以利用性信息素阻碍雌雄虫交配来进行防治。有性生殖的生殖方式能使产卵期提前,但并没有提高产卵量。雄性个体存在的意义可能只是为了适应不良环境,有利于种群繁殖(魏婷等,2010)。但是扶桑绵粉蚧雌雄虫均能够进行多次交配,交配能力强,对于利用性信息素大量诱捕进行防治是一个不利的因素,仍需要进一步加强多种蚧虫性信息素生物合成、生态遗传学及进化、在近缘种间生殖隔离的作用以及人工合成性信息素在种群监测及防治中的应用技术等研究。因此,如何利用性信息素对该虫进行防治,仍有待进一步深入研究。
