鸡源p53单克隆抗体的制备和鉴定
2018-07-26李雪琪陈鸿军鲍晨沂孙海伟JUNGYongSam钱莺娟
李雪琪,陈鸿军,连 雪,鲍晨沂,孙海伟,孙 雯,JUNG Yong-Sam,钱莺娟
(1.南京农业大学动物医学院,南京210095;2.中国农业科学院上海兽医研究所,上海200241)
p53是机体内重要的转录因子,参与调节机体内细胞分化、细胞衰老、细胞凋亡、新陈代谢、免疫应答、肿瘤发生及形成等生物过程。1979年p53由Lane等人发现[1],最初被误认为是原癌基因,后被证实为抑癌基因。近年来p53被发现参与机体内多种调节过程[2-4],其重要性日益突出。正常情况下,p53蛋白保持在低水平状态。当机体受到多种刺激时,例如:DNA损伤、原癌基因激活、缺氧、病毒感染等,p53被激活[2]。活化后的p53可以通过与多种靶蛋白相互作用,参与多种机体内调控过程,从而发挥其生物学作用[3,4]。
p53功能非常多,参与调控体内多种应答途径。例如在缺失p53的细胞中过表达p53,能诱导细胞过早衰老[4,5],而用病毒蛋白(如HPV-16 E6蛋白等)抑制p53活性,则可以延缓细胞衰老[6]。缺失p53的小鼠往往在幼龄时期易形成多种肿瘤[7],而在患有恶性肿瘤的小鼠体内重新表达p53,则可以使肿瘤衰退[8]。p53通过与mTOR相互作用参与细胞自噬,当敲除或抑制细胞质中的p53,可以激活自噬,而恢复缺失p53细胞中的p53蛋白,则可以降低自噬[9,10];p53还可以通过促进BCL-2家族促凋亡基因Bax转录,以此促使线粒体释放细胞色素C,激活线粒体途径的细胞凋亡[11-13]。
虽然p53如此重要,但目前对p53的研究主要集中于人和哺乳动物,对鸡源p53的研究甚少。商品化p53单克隆抗体主要识别人源p53,对鸡源p53特异性不强。本实验室曾用商品化p53抗体检测鸡源p53,效果并不理想。本研究通过构建鸡源p53原核表达载体,利用杂交瘤细胞筛选技术,制备出特异性较高的抗p53单克隆抗体,为研究p53在鸡体内的功能奠定基础。
1 材料和方法
1.1 材料及试剂 BL21(DE3)感受态细胞、DH5α、pET-30a、pcDNA4、pGEX-4T-1、pcDNA3-2×FLAG载体以及人胚肾细胞株293T由本实验室保存;骨髓瘤细胞株SP2/0由上海兽医研究所实验室提供;SPF鸡胚和BALB/c雌性小鼠购自北京维通利华有限公司;Phanta® Max Super-Fidelity DNA聚合酶购自南京诺唯赞生物科技有限公司;T4 DNA连接酶购自美国Promega公司;Bam H I及Xho I限制性内切酶购自英国NEB公司;化学发光(ECL)试剂盒购自南京西腾生物科技有限公司;蛋白印记半干转印仪器以及iScriptTMcDNA合成试剂盒购自美国BioRad公司;Alexa Fluor 594标记的羊抗鼠二抗、预染蛋白Marker购自Thermo Scientific(USA)公司;Biospin质粒小量提取试剂盒以及Biospin胶回收试剂盒购自博日科技有限公司;FITC标记的山羊抗鼠二抗、辣根过氧化物酶(HRP)标记的山羊抗鼠二抗购自美国Sigma公司。
1.2 鸡p53基因的克隆
1.2.1 提取RNA并扩增鸡p53片段 根据GenBank上的p53序列(序列号:NM_205264),用Primer Premier 5.0设计引物。上游引物为p53-BamHI-F:5'-CTG GGATCCATGGCGGAGGAGATGGAAC-3';下游引物为p53-Xho I-R:5'-GACCTCGAGTCAGTCC GAGCCTTTTTGC-3'。从鸡胚成纤维细胞(chicken embryo fibroblast,CEF)中提取p53 mRNA,在聚合酶的催化下,利用Oligo(dT)18引物反转录获得cDNA。以cDNA为模板,采用50 µL体系进行扩增。PCR条件:95℃预变性4 min;95℃变性30 s,58℃退火45 s,72℃延伸1 min,33个循环。
1.2.2 鸡p53重组质粒的构建 将PCR产物在110 V电压下进行凝胶电泳鉴定,并切下目的片段回收;将PCR回收产物酶切后,与酶切过的pcDNA3-2×Flag载体、pcDNA4载体4℃过夜连接。取连接产物pcDNA3-2×Flag-p53、pcDNA4-p53分别转化DH5α感受态菌株,并涂布于LB/Amp (100 µg/mL)平板。挑取阳性菌落,接种于LB/Amp(100 µg/mL)培养液中,摇菌培养约13 h后,按照质粒小提试剂盒说明书提取质粒,并进行酶切鉴定和DNA序列测定。将鉴定正确的重组质粒分别命名为pcDNA4-p53和pcDNA3-2×Flag-p53。
在限制性内切酶BamH I和Xho I的催化下,对pcDNA3-p53、pET-30a、pGEX-4T-1质粒分别进行酶切,酶切产物经电泳分离后,分别回收目的片段。在T4 DNA连接酶的催化下,过夜连接。将连接所得质粒进行转化、挑菌、酶切鉴定正确后,命名为pET-30a-p53和pGEX-4T-1-p53。
1.3 鸡p53蛋白的诱导表达及鉴定 将构建好的pET-30a-p53、pGEX-4T-1-p53原核表达质粒分别转入BL21(DE3)感受态细胞中,并分别涂布于带有相应抗性的平板上,温箱培养过夜后,各挑取3株单克隆,接种到5 mL LB培养液中,37℃振荡培养过夜。取过夜培养的菌液进行二次活化,加入到新鲜LB培养液中振荡培养至OD值达0.4~0.6时,其中2管加入IPTG进行诱导,另1管不加IPTG作为阴性对照。37℃摇床中培养6 h,1500×g 离心10min,取菌体,经超声破碎,离心分别收集沉淀和上清[14]。利用SDS-PAGE鉴定重组蛋白的表达形式。pET-30a-p53表达产物主要存在于包涵体中,收集该蛋白,命名为his-p53。pGEX-4T-1-p53表达产物同时存在于包涵体与上清中,按照GST纯化柱操作步骤纯化pGEX-4T-1-p53表达产物上清,将收集的纯化产物命名为GST-p53。
1.4 ELISA及间接免疫荧光(indirect immunoinfluscent assay,IFA)检测板的制备 ELISA检测板的制备:将用包被液稀释过的纯化GST-p53蛋白加入到ELISA板中,每孔100 μL。37℃孵育2 h后,用1×TBST洗涤3次,再用封闭液于4℃封闭过夜,然后弃掉封闭液,用1×TBST洗涤3次,待洗涤干净后,放于4℃保存备用。
IFA检测板的制备:在转染试剂TranslT-293的作用下,将pc3-2×Flag-p53转入96孔板中的293T细胞,质粒转染量为4 μg/板。细胞培养箱中培养48 h后,弃掉培养液,室温条件下,用多聚甲醛对96孔板进行固定约10 min,1×PBST洗涤3次,每次约10 min。用0.2% Triton-X 100进行透化后,再次用1×PBST洗涤,4℃保存备用。
1.5 小鼠抗鸡p53多抗血清及单抗制备 在收集的his-p53蛋白中加入2×SDS-PAGE上样缓冲液,加热变性后,利用SDS-PAGE电泳分离,考马斯亮蓝染色,并洗涤脱色。切下带有his标签的p53蛋白条带,加入1×PBS及双抗,在研磨仪中进行研磨,研磨好后,放于-20℃保存待用。取研磨好的p53蛋白凝胶,腹腔注射雌性BALB/c小鼠,每隔10 d进行加强免疫,共免疫4次。最后1次免疫完后d6,眼球取血,离心收集多抗血清。
最后1次免疫后d3,取小鼠脾脏分离出的脾脏淋巴细胞与骨髓瘤细胞SP2/0,在融合剂的作用下进行融合。在含有HAT的选择性培养基中培养融合细胞4~5 d,利用IFA及ELISA方法筛选融合细胞。选取IFA及ELISA阳性细胞克隆株,经有限稀释法稀释,铺于96孔板进行亚克隆。将亚克隆中IFA及ELISA检测结果较强的细胞株不断筛选并扩大培养,选取阳性最强的细胞株,腹腔注射经石蜡处理10 d的BALB/c雌性小鼠。10 d后,取小鼠腹水离心后,-20℃保存。
1.6 抗体效价检测 分别用ELISA、Western blot以及IFA检测方法对获得的多抗血清及单抗进行检测。
ELISA检测:将稀释过的p53多抗血清或细胞上清加入制备好的ELISA板中,每孔100 μL,37℃孵育1 h;1×TBST洗涤3次,加入1∶2000稀释的HRP标记的羊抗鼠二抗,每孔100 μL,37℃孵育1 h;1×PBST洗涤3次,加入TMB显色,并用2 mol/L硫酸终止显色,于酶标仪中450 nm波长下检测。
IFA检测:将稀释过的p53多抗血清或细胞上清加入制备好的IFA板中,37℃孵育30 min;1×PBST洗涤3次,加入1∶500稀释的Alexa Fluor 594标记的羊抗鼠二抗,37℃避光孵育30 min;1×PBST洗涤3次,加入1∶500稀释的DAPI避光孵育10 min,1×PBST洗3次,于倒置荧光显微镜下观察。
Western blot:将真核表达的p53融合蛋白经SDS-PAGE电泳分离,并转至硝酸纤维素薄膜上,脱脂奶粉4℃封闭过夜;PBST洗涤3次,用稀释过的多抗血清或细胞上清孵育过夜;PBST洗涤3次,用1∶2000稀释的二抗孵育4 h;PBST洗涤3次,加入化学发光试剂盒(ECL)进行显色。
2 结果
2.1 鸡p53重组质粒的构建及鉴定 以反转录产生的CEF细胞cDNA为模板,经PCR成功扩增出预期大小(1000 bp左右)的目的条带(图1)。PCR产物回收后,经BamH I/Xho I酶切,与酶切好的pcDNA4连接,经鉴定正确后,命名为pcDNA4-p53。用BamH I/Xho I对此重组质粒进行酶切,收集p53片段与pGEX-4T-1及pET-30a载体相连,鉴定正确后用于原核表达。

图1 鸡p53基因PCR扩增结果Fig. 1 PCR amplif i cation of chicken p53 geneM: DNA ladder Mix; 1: 鸡p53基因M: DNA ladder Mix; 1: PCR product of p53 gene
2.2 鸡p53原核表达及鉴定 将构建好的pGEX-4T-1-p53及pET-30a-p53分别转入BL21(DE3)感受态细胞中,经常规诱导表达步骤,收集表达产物。将两种表达质粒的表达产物分别超声破碎,分别收集上清和沉淀。pGEX-4T-1-p53表达上清用GST纯化柱纯化,经SDS-PAGE分离,考马斯亮蓝染色。结果显示,经过纯化的上清中可分离出较纯的GST-p53蛋白,条带大小约70 kDa(图2A)。pET-30a-p53表达产物的上清和沉淀分别经SDS-PAGE电泳,结果显示,his-p53主要存在于包涵体中,少量存在于上清中,条带约50 kDa(图2B)。
2.3 鸡p53多抗血清ELISA检测结果 将pET-30a-p53原核表达产物的包涵体经SDS-PAGE电泳,切下his-p53蛋白条带,研磨后腹腔注射雌性BALB/c小鼠,4免后d 6眼球取血,分离获得多抗血清。用制备好的ELISA板进行检测,结果显示小鼠p53多抗血清ELISA效价达到1∶105。
2.4 鸡p53多抗血清Western blot检测结果 制备CEF细胞,并用DNA损伤药物Doxorubicin(Dox)处理细胞,收集对照组和实验组细胞裂解液。将pcDNA3-p53及pcDNA3-2×Flag-p53质粒分别转染293T或H1299细胞,收集细胞裂解液。Western blot结果显示,p53小鼠多抗血清能检测到CEF中的内源性p53条带,在用Dox处理CEF细胞后,能检测到细胞中p53的表达水平升高。在293T细胞及H1299细胞中,可检测到外源性表达蛋白;用Flag抗体作为对照,可在相同位置检测到Flag-p53(图3)。
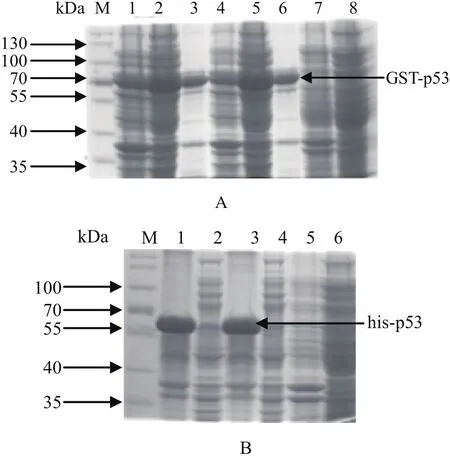
图2 鸡p53的原核表达及可溶性分析Fig. 2 Prokaryotic expression of chicken p53A: M: 预染蛋白质分子量标准; 1~6: pGEX-4T-1-p53诱导表达产物(1、4为沉淀; 2、5为上清; 3、6为纯化后蛋白); 7~8:pGEX-4T-1-p53未诱导表达产物(7为沉淀, 8为上清)B: M: 预染蛋白质分子量标准; 1~4: pET-30a-p53诱导表达产物(1、3为沉淀;2、4为上清); 5、6: pET-30a-p53未诱导表达产物(5为沉淀, 6为上清)A: M: Prestained Protein Ladder; 1-6: pGEX-4T-1-p53 induced by IPTG(1,4 as inclusion bodies; 2,5 as supernatant; 3,6 as purified GSTp53); 7-8: pGEX-4T-1-p53 negative control(7 as inclusion bodies; 8 as supernatant)B: M: Prestained Protein Ladder; 1-4: pET-30a-p53 induced by IPTG(1,3 as inclusion bodies; 2,4 as supernatant); 5-6: pET-30a-p53 negative control(5 as inclusion bodies; 6 as supernatant)
2.5 鸡p53单抗筛选结果 将杂交瘤细胞进行筛选、扩大培养,利用IFA和ELISA检测细胞上清,筛选出6株能稳定分泌抗鸡p53 抗体的杂交瘤细胞,即1D7、3C4、4D4、4F6、4F7和4H2,经亚型鉴定,均为IgG型抗体。
2.6 鸡p53单抗IFA结果 将收集的1D7细胞株培养上清加入制备好的IFA检测板孔中,孵育30 min,洗涤干净后,加入二抗孵育30 min并洗涤干净,于倒置荧光显微镜下观察。结果显示,小鼠p53单抗IFA检测为阳性(图4)。

图3 p53多抗血清检测结果Fig.3 Western blot result of p53 over expressed by p53 anti-sera1: 未用药物处理的CEF;2: 用Doxorubicin (Dox)处理后的CEF细胞裂解液; 3~5: 不同质粒转染293T细胞(3: pcDNA3;4: pcDNA3-p53; 5: pcDNA3-2×Flag-p53); 6~8: 不同质粒转染H1299细胞(6: pcDNA3; 7: pcDNA3-p53; 8: pcDNA3-2×Flag-p53)1: Untreated CEF; 2: CEF treated by Doxorubicin; 3-5: 293T cells transfected with different plasmids (3: pcDNA3; 4: pcDNA3-p53;5: pcDNA3-2×Flag-p53); 6-8: H1299 cells transfected with different plasmids (6: pcDNA3; 7: pcDNA3-p53; 8: pcDNA3-2×Flag-p53)
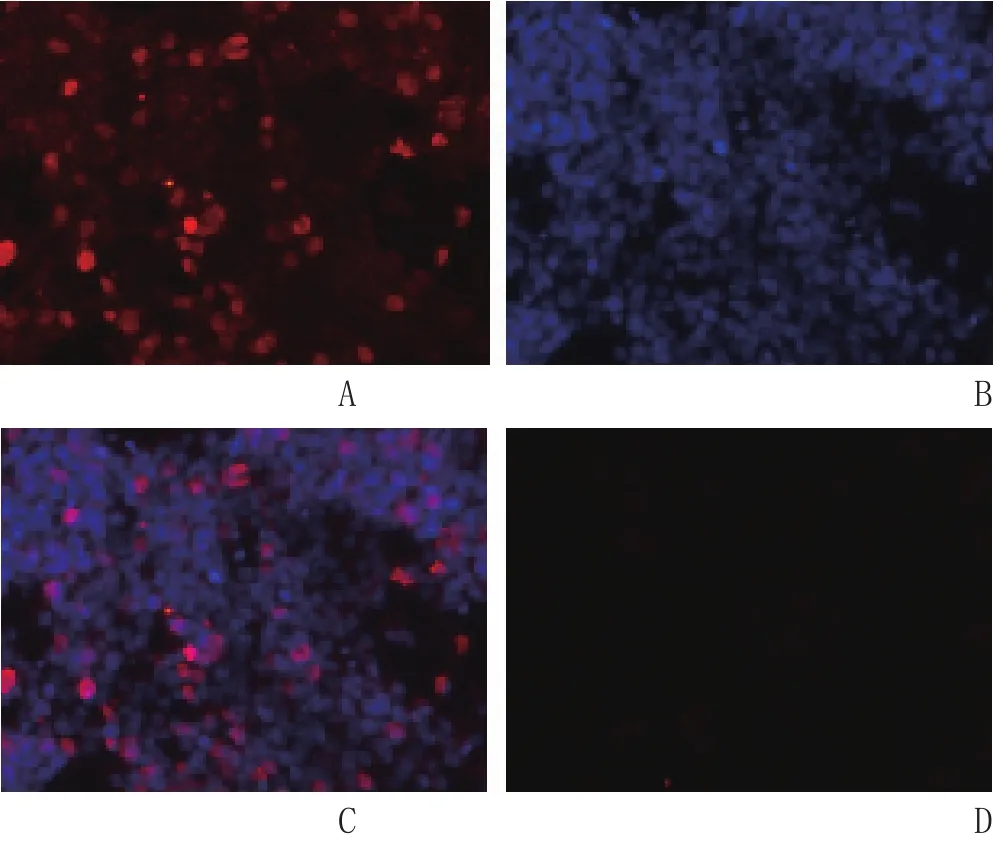
图4 p53单抗的间接免疫荧光检测结果Fig. 4 Identif i cation of chicken p53 monoclonal antibody by IFAA: p53单抗检测结果; B: DAPI染核; C: 合并结果; D: 阴性对照A: IFA result; B: DAPI staining; C: Merger of A and B; D:Negative control
2.7 鸡p53单抗Western blot检测结果 收集1D7细胞株的细胞培养上清,利用Western blot检测转染293T细胞的外源性p53的表达。结果显示,1D7单抗可以检测到外源性p53蛋白(图5)。

图5 p53单抗1D7的Western bolt检测结果Fig. 5 Western blot result of p53 over expressed by p53 monoclonal antibody1: 未用药物处理的CEF; 2: 用Doxorubicin (Dox)处理后的CEF细胞裂解液; 3: 用ETP处理后的CEF细胞裂解液; 4:pcDNA4-p53转染293T细胞1: Untreated CEF; 2: CEF treated by Doxorubicin; 3: CEF treated by ETP; 4: 293T cells transfected with pcDNA4-p53
3 讨论
人源p53基因主要包含3个结构区。N端酸性区,参与转录激活,并可以与p53的调控蛋白结合;中间疏水区可与DNA结合,是p53的主要突变区;C端碱性区,可促使活化的p53形成四聚体[14,15]。除此之外,还含有核定位信号(nuclear localization signal,NLS)传递p53入核信号[16]。两个核输出信号(nuclear export signal,NES)传递p53的出核信号[17,18]。对人类疾病、小鼠模型和体外哺乳动物传代细胞的大量研究表明,p53能参与体内细胞应答、生长发育、新陈代谢、肿瘤的形成等过程。基于p53的重要性及其在不同物种中的高度保守性,推测其在禽类疾病病毒感染中发挥着作用,对禽类p53功能的研究不仅能深入了解疾病过程,而且能够比较p53在不同物种中功能的异同。
本研究表达的是鸡源p53全长蛋白,这有利于获得针对鸡源p53蛋白特异性较强的单克隆抗体。通过筛选,共获得6株单克隆细胞株,分别是1D7、3C4、4D4、4F6、4F7和4H2。Western blot结果显示,获得的p53多抗血清,能较好的识别内源性及外源性p53条带,但同时杂带也较明显,表示其虽然亲和性较好,但是特异性较差;获得的p53单克隆抗体能识别内源性及外源性p53条带,且杂带较少,表明特异性较好。IFA结果显示,p53多抗血清能较好地识别外源性p53,显示出强荧光。ELISA结果也表明获得的p53单抗和多抗都显示出强阳性。本研究通过腹腔免疫小鼠及细胞融合技术获得的多抗血清及单克隆抗体,为研究p53在鸡体内的生物功能提供了基础。
