幼虫芽孢杆菌和蜂房蜜蜂球菌双重TaqMan荧光定量PCR检测方法的建立
2018-07-26何晓杰王科珂叶尔保勒阿斯喀张婕妤季新成王振宝
何晓杰,王科珂,叶尔保勒,阿斯喀,张婕妤,哈 森,季新成,王振宝,,
(1.伊犁职业技术学院,伊宁835000;2.新疆出入境检验检疫局,乌鲁木齐830063;3.伊犁出入境检验检疫局,伊宁 835000;4.重庆工商大学,重庆400067)
蜜蜂美洲幼虫腐臭病(American foulbrood,AFB)和欧洲幼虫腐臭病(European foulbrood,EFB)是蜜蜂幼虫两种重要的细菌性疾病,病原体分别为幼虫芽孢杆菌(Paenibacillus larvae,P.larvae)和蜂房蜜蜂球菌(Melissococcus pluton,M.pluton),呈世界性分布,世界动物卫生组织(Office International Des Epizooties,OIE)将其列为法定报告动物疫病,我国将其列为二类动物疫病和进境动物检疫疫病。AFB和EFB是我国转地养蜂和世界各国在进境蜂及蜂产品中重点检疫的两种蜜蜂疫病。P.larvae在一定条件下能产生芽孢,具有特别强的生存能力,病原很难控制和净化。M.pluton虽不产生芽孢,但对外界不良环境的抵抗力强,能在蜂尸上存活数年,在蜂蜜里也能保持长久的毒性,传染性极强[1]。AFB和EFB均感染和危害蜜蜂幼虫且病症相似,易发生误诊,因此开展对AFB和EFB的同步鉴别及早期诊断研究具有重要意义。
目前,AFB和EFB的实验室诊断方法主要包括细菌涂片镜检、分离培养、核酸检测和凝集试验等。已有方法全部是基于病原分离培养鉴定基础之上的,由于P.larvae和M.pluton对培养条件要求极其苛刻,因此这些方法很难对AFB和EFB做出准确诊断。已报道的AFB和EFB多重PCR诊断方法为普通PCR,流程较复杂;荧光定量PCR均为单重PCR方法,无法实现在同一反应管中同时检测两种病原的目的[2-8]。本研究建立AFB和EFB病原双重TaqMan荧光定量PCR检测方法,可为AFB和EFB的早期同步诊断、蜂及蜂产品中P.larvae和M.pluton的检验检疫提供技术保障。
1 材料与方法
1.1 菌/毒/虫株 P.larvae、M.pluton、蜜蜂微孢子虫(Nosema apis)、蜜蜂球囊菌(Asosphaera apis)、囊状幼虫病毒(Sacbrood bee virus)、慢性蜜蜂麻痹病病毒(Chronic bee paralysis virus)由伊犁出入境检验检疫局技术中心实验室保存。
1.2 主要试剂和仪器 基因组DNA提取试剂盒、RNA提取试剂盒购自QIAGEN公司;Premix Ex Taq(Probe qPCR)、pXT19-T vector、胶回收试剂盒、质粒小量提取试剂盒等购自宝生物工程(大连)有限公司;ABI 7500 Real Time PCR System购自美国应用生物系统公司。
1.3 引物和探针的设计与合成 根据GenBank登录的P.larvae和M.pluton 16S rRNA基因保守序列(X60619.1)和(X75752),使用Primer Premier 5和Primer Express 3.0软件分别设计1对引物和1条探针(表1)。引物和探针由北京鼎国昌盛生物技术有限公司合成。

表1 引物和探针序列Table1 Primers and probe sequences
1.4 标准品的制备 提取P.larvae和M.pluton基因组作为模板,应用特异性引物分别进行普通PCR扩增,分别将PCR产物克隆至pXT19-T Vector,构建重组质粒pXT-P和pXT-M,转化至E.coli DH5α感受态细胞,37℃过夜摇菌后提取质粒进行普通PCR和测序验证,鉴定正确的重组质粒测定其浓度后,作为双重荧光定量PCR的标准品。
1.5 反应体系和条件优化 单重、双重荧光定量PCR均采用Premix Ex Taq(Probe qPCR)试剂,在ABI 7500型荧光定量PCR仪上进行试验。双重荧光定量PCR反应体系中引物、探针浓度和反应条件中退火、延伸温度和时间在单重荧光定量PCR反应体系和反应条件的基础上优化获得。
1.6 标准曲线的建立 将P.larvae和M.pluton标准品做10倍系列稀释,用不同稀释梯度的标准品作为模板,按优化好的体系及条件进行双重荧光定量PCR,绘制标准曲线。
1.7 特异性试验 分别提取P.larvae、M.pluton、Nosema apis、Asosphaera apis、Sacbrood bee virus、Chronic bee paralysis virus、健康蜜蜂幼虫核酸,进行单一及双重荧光定量PCR,检测该方法的特异性。
1.8 敏感性试验 用已知浓度的P.larvae和M.pluton标准品进行10倍系列稀释为8个梯度(107copies/μL~100copies/μL),分别作为模板,按优化好的体系条件进行双重荧光定量PCR,确定反应的最小检出量。同时进行普通PCR反应,比较两种检测方法的敏感性。
1.9 重复性试验 选取5个经10倍系列稀释的P.larvae和M.pluton标准品分别作为模板,每个浓度进行3次重复检测,根据Ct值计算批内变异系数;以这5个不同浓度的标准品分别作为模板,在3个不同时间进行荧光定量PCR检测,根据Ct值计算批间变异系数,评价该方法的重复性和稳定性。
1.10 实验室模拟样品和临床样品检测 将定量的不同稀释度的P.larvae和M.pluton标准品掺入幼虫、蜂蛹、成蜂、蜂蜜、蜂胶、蜂王浆和花粉样品中制成200份实验室模拟样品;采自新疆的200份蜜蜂幼虫及蜂产品作为临床样品,应用建立的双重荧光定量PCR方法进行检测。
2 结果
2.1 标准品的制备 将P.larvae DNA和M.pluton DNA进行普通PCR扩增,获得长度约为130 bp和160 bp的目的片段(图1),PCR产物经测序分析,与GenBank中登录序列的同源性达到100%。将目的片段克隆于pXT19-T Vector中构建pXT-P和pXT-M重组质粒标准品,经普通PCR和测序鉴定正确。

图1 P.larvae(A)与M.pluton(B)阳性模板的扩增Fig.1 Amplif i cation of P.larvae and M.pluton positive templateM: DNA分子量标准(DL2000); 1: PCR 产物; 2: 阴性对照M: DNA Marker(DL2000); 1: PCR product; 2: Negative control
2.2 反应体系和反应条件优化 采用矩阵法优选引物、探针最佳浓度配比及退火、延伸温度和时间。优化后的双重荧光定量PCR反应体系和反应条件为(25 μL):Premix Ex Taq 12.5 μL、P.larvae F 1 μL、P.larvae R 1 μL、P.larvae P 1 μL、M. pluton F 1 μL、M. pluton R 1 μL、M. pluton P 1 μL、模板DNA(104copies/μL)1 μL,加灭菌ddH2O 5.5 μL,使反应总体积为25.0 μL。最佳反应条件:94℃预变性2 min;94℃变性15 s、59℃退火延伸50 s,共40个循环,退火延伸时收集荧光信号。
2.3 标准曲线的建立 将P.larvae和M.pluton标准品10倍系列稀释后,进行双重荧光定量PCR,制备标准曲线,结果表明标准品浓度在107~10 copies/μL具有良好的线性关性,两条标准曲线的相关系数均为R2=0.999。线性方程分别为Ct=3.381×log CO+36.56(P.larvae)(图2)和Ct=3.495×log CO+41.24(M.pluton)(图3)。
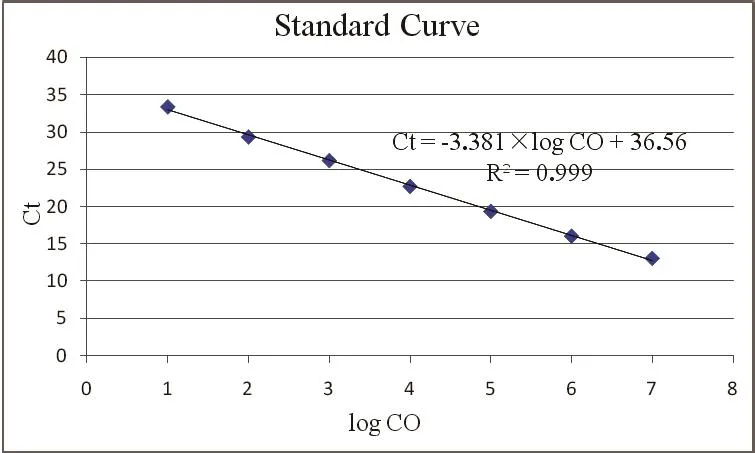
图2 双重荧光定量PCR检测P.larvae标准品的标准曲线Fig.2 Standard curve of P.larvae by duplex real-time PCR
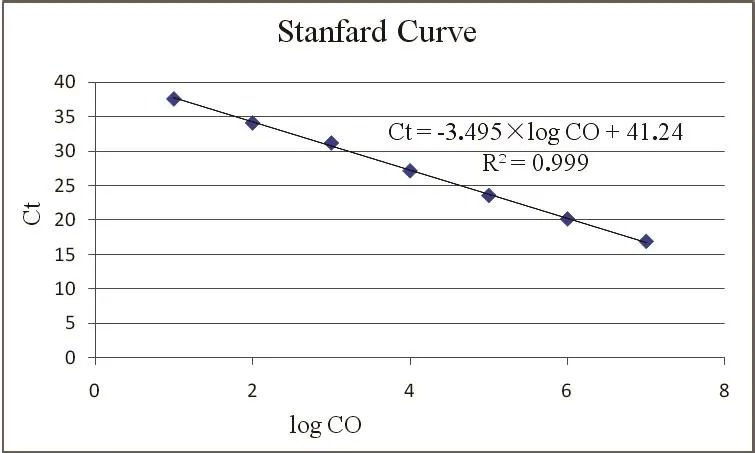
图3 双重荧光定量PCR检测M.pluton标准品的标准曲线Fig.3 Standard curve of M.pluton by duplex real-time PCR
2.4 特异性试验 双重荧光定量PCR特异性检测结果显示,P.larvae及M.pluton均产生扩增曲线,且循环阈值均小于35,而其他病原、健康蜜蜂幼虫均未产生扩增曲线(图4)。
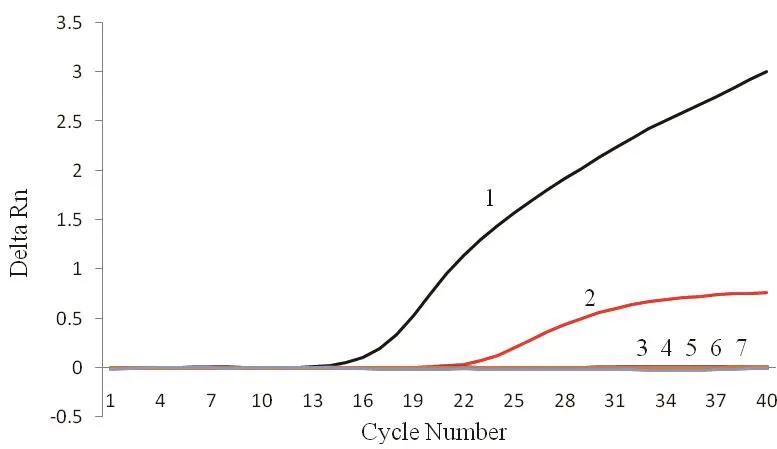
图4 双重荧光定量PCR特异性试验Fig.4 Specif i city test of duplex real-time PCR1: 蜂房蜜蜂球菌; 2: 幼虫芽孢杆菌; 3: 蜜蜂微孢子虫; 4: 蜜蜂球囊菌; 5: 囊状幼虫病毒; 6: 慢性蜜蜂麻痹病病毒; 7: 健康蜜蜂幼虫1: M.pluton; 2: P.larvae; 3: Nosema apis; 4: Asosphaera apis;5: Sacbrood bee virus; 6: Chronic bee paralysis virus; 7:Honeybee larve
2.5 敏感性试验 选择P.larvae和M.pluton标准品进行10倍系列稀释后的8个梯度(107copies/μL~100copies/μL),分别作为模板进行双重荧光定量PCR和普通PCR检测。结果显示双重荧光定量PCR最小检出量为10 copies/μL(图5),普通PCR最小检出量为103copies/μL(图6),表明荧光定量PCR的敏感性比普通PCR提高了约100倍。
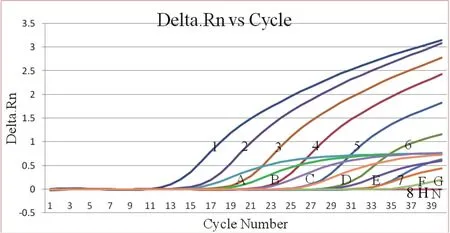
图5 双重荧光定量PCR敏感性试验Fig.5 Sensitivity test of duplex real-time PCR1~8: P.larvae模板拷贝数依次为: 1.3×107、1.3×106、1.3×105、1.3×104、1.3×103、1.3×102、1.3×101、1.3×100 copies/µL; A-H: M.pluton模板拷贝数依次为:1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101、1.0×100 copies/µL; N: 阴性对照1-8: The number of copies for P.larvae were 1.3×107, 1.3×106,1.3×105, 1.3×104, 1.3×103, 1.3×102, 1.3×101,1.3×100 copies/μL, respectively; A-H: The number of copies for M.pluton were 1.0×107, 1.0×106, 1.0×105, 1.0×104,1.0×103, 1.0×102, 1.0×101, 1.0×100 copies/μL, respectively;N: Negative control

图6 普通PCR P.larvae(A)和M.pluton(B)敏感性试验Fig.6 Sensitivity test of traditional PCR for P.larvae(A)and M.pluton(B)1~8: P.larvae(A)和M.pluton(B)模板拷贝数依次为: 107、106、105、104、103、102、101、100 copies/µL; N: 阴性对照1-8: The number of copies for P.larvae(A) and M.pluton(B) were 107, 106, 105, 104, 103, 102, 101, 100 copies/μL, respectively;N: Negative control
2.6 重复性试验 选取5个10倍系列稀释的P.larvae和M.pluton标准品进行批内和批间重复性试验,根据扩增反应的Ct值,计算变异系数(CV),结果显示变异系数均小于2%(表2),表明所建立的方法具有较好的重复性。
2.7 样品检测 应用建立的双重荧光定量PCR方法和普通PCR方法对200份实验室模拟样品和采自新疆的200份蜜蜂幼虫及蜂产品临床样品进行检测。结果显示,双重荧光定量PCR能检出加入P.larvae和M.pluton标准品浓度为10 copies/μL以上的模拟样品,普通PCR能检出的标准品浓度为103copies/μL以上,蜜蜂幼虫及蜂产品临床样品两种检测方法结果均为阴性,表明该双重荧光定量PCR具有良好的临床灵敏性和应用性。
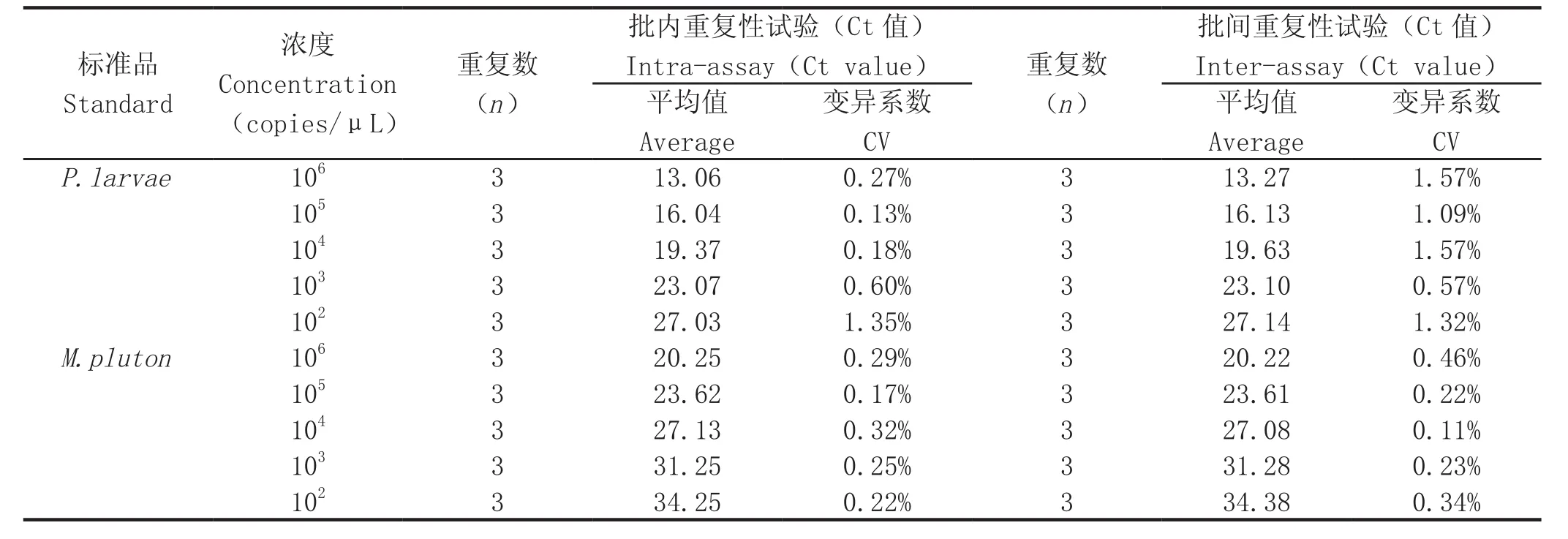
表2 双重荧光定量PCR重复性试验Table 2 The reproducibility test of duplex real-time PCR
3 讨论
AFB和EFB病原可以广泛分布在病蜂接触过的花粉、糖液、饲槽、巢脾等,这些都可以作为主要传染源,P.larvae及M.pluton对外界都有着较强的抵抗力,同时盗蜂和迷巢蜂等使该病在蜂群中传播,所以要彻底清除这些病原是相当困难的,这也很大程度上影响着蜜蜂群势及蜂产品的产量与质量。两种疫病临床症状相似,易误诊,因此开展对AFB和EFB的同步鉴别及早期诊断研究具有重要意义。
多重荧光定量PCR方法是在单重荧光定量PCR基础上发展的技术,在同一个反应体系中加入多套引物和探针,探针的5'端标记不同波长的发光基团,可同时对多种目标基因进行检测,具有快速、灵敏、高通量等特点,已成为实验室检测病原体及病理分析的主要手段之一[9-11]。已报道的AFB和EFB多重PCR诊断方法为普通PCR,仅能对终产物进行分析,无法对起始模板准确定量以及对扩增反应进行实时监测,必须在扩增反应结束后借助电泳方法分析,流程较复杂,并且需要使用EB等有毒物质[12]。本研究建立了P.larvae及M.pluton的双重TaqMan探针荧光定量PCR检测方法,试验过程全封闭,仪器自动分析和获取试验结果,无后续试验操作,可对起始模板准确定量和扩增反应进行实时监测,方法特异性、灵敏度、自控化程度等均高于普通PCR。同时,通过反应体系和条件优化解决了两对引物和探针之间相互干扰问题。设计探针时,P.larvae和M.pluton探针5'端分别标记荧光发射波长处于不同光谱范围的FAM和VIC报告基团,不易互相干扰,3'端标记BHQ1作为荧光淬灭基团,该修饰基团本身不产生荧光且淬灭效率更高,大大降低了本底信号的强度,提高了方法灵敏度。结果表明本研究建立的双重荧光定量PCR方法具有良好的特异性,与P.larvae、M.pluton、Nosema apis、Asosphaera apis、Sacbrood bee virus、Chronic bee paralysis virus等蜜蜂疫病病原和健康蜜蜂幼虫无交叉反应;灵敏度高,可同时检出最低10 copies/μL的目的基因,与普通PCR相比,灵敏度提高了100倍;重复性好,批内和批间变异系数均小于2%;适用范围广,检测幼虫、蜂蛹、成蜂、蜂蜜、蜂胶、蜂王浆和花粉等200份实验室模拟样品和200份临床样品与预期结果一致。因此,本研究建立的TaqMan探针双重荧光定量PCR方法可用于AFB和EFB的快速鉴别诊断、早期监测、流行病学调查及蜂产品中P.larvae和M.pluton的定量分析。
