感染日本血吸虫小鼠肝脏miR-17-92簇表达变化的研究
2018-07-26刘军涛陈永军朱丽慧夏天奇王立辉程国锋
刘军涛,陈永军,朱丽慧,夏天奇,王立辉,2,程国锋
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海200241;2.天津农学院,天津300384)
MicroRNAs(miRNAs)是一类长度约22 nt的非编码小RNAs,可在转录后水平上对靶mRNAs进行负调控,进而调控蛋白质的翻译[1],在发育、生理、病理过程包括细胞增殖、凋亡、分化、代谢以及肿瘤发生等环节中起着重要的调节作用。miR-17-92 簇是一类被多数学者认为的强效原癌基因,包括miR-17(miR-17-3p和miR-17-5p)、miR-18a、 miR-19a、 miR-19b、miR-20a和miR-92a五种miRNAs。近年来,越来越多的研究表明miR-17-92 簇在生命过程和疾病发生中扮演着重要的角色,如细胞发育、免疫应答、心血管疾病及神经退行性疾病等[2]。例如,miR-17-92 簇在小鼠的生长发育中发挥着重要作用[3];miR-17-92 簇在先天性及获得性免疫疾病中起着重要的作用,不仅能增强CD4+T细胞的存活率,还能增加CD34+造血干细胞分化成单核细胞[4,5];过表达的miR-92a能够抑制局部缺血的环境下血管内皮细胞的活性[6]。另外,miR-17-92簇在肺脏、胸腺、直肠、胰腺、淋巴、甲状腺、前列腺等多种肿瘤中呈上调表达[7-10],提示miR-17-92 簇在肿瘤发生过程中发挥着重要的作用。
血吸虫病在全球超过74个国家和地区流行,主要分布在热带地区及南美的亚热带地区,亚洲和非洲等发展中国家[11]。血吸虫病主要病理损害是由于成虫在终末宿主体内产生大量虫卵,虫卵在宿主肝脏中累积,引起宿主肝脏的肉芽肿、纤维化等[11]。有研究表明miRNAs在血吸虫病引起的肝脏的病理损害过程中发挥着重要角色。Cai等[12]研究表明在感染日本血吸虫的哺乳动物的肝脏中,有超过130个miRNAs的表达发生变化。最近研究表明,抑制血吸虫感染高表达的肝脏miR-21能够减轻肝脏的纤维化[13]。为此,我们分析了miR-17-92簇及其靶基因在感染日本血吸虫不同阶段的小鼠肝脏中的差异变化,结果表明miR-17-92簇可能在血吸虫病肝脏的病理损害中扮演着重要角色。
1 材料与方法
1.1 生物材料 日本血吸虫尾蚴购自中国疾病预防控制中心寄生虫病预防控制所;8周龄清洁级雄性BALB/c小鼠购自上海斯莱克实验动物有限公司;BALB/c小鼠经由腹部皮肤贴片感染,每只感染(60±5)条尾蚴,分别于感染后d0、7、14、25、35、55收取小鼠的血浆及肝脏组织,液氮冻存备用。
1.2 主要试剂 TRIzol Regent购自Invitrogen公司;Prime ScriptTMRT Reagent Kit(Perfect Real Time)、SYBR® Premix Ex TaqTMII(Tli RNaseH Plus)均购自TaKaRa生物工程(大连)有限公司;抗鼠STAT3、TGFBR2及MAPK14多克隆抗体购自药明康德新药开发有限公司;山羊抗鼠二抗购自北京康为生物科技有限公司;BCA蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司;蛋白酶抑制剂购自默克公司;Immobilon Western Chemiluminescent HRP Substrate购自Milipore公司。
1.3 引物的设计与合成 根据鼠miR-17-92 簇的miRNA序列设计反转录及荧光定量引物(表1),根据已发表的文献并结合生物信息学选择miR-17-92 簇的靶基因STAT3(GenBank:AF332507.1)、MAPK14(GenBank:NM_001168508.1)、TGF-β(GenBank:NM_001087861.1)、ABCA1(GenBank:NM_013454.3)、PTEN(G e n B a n k:N M_0 0 8 9 6 0.2)、S M A D 2(GenBank:NM_001311070.1)、SMAD4(GenBank:NC_000084.6)、UBL3(GenBank:NM_011908.2)设计引物[14],用GAPDH作为内参引物,引物由上海桑尼生物科技有限公司合成。
1.4 RNA提取及qRT-PCR分析 利用TRIzol提取感染日本血吸虫后d0、7、14、25、35、55小鼠肝脏及血浆组织的total RNA。提取的RNA用NANO Drop 2000/2000c 分光光度计进行浓度测定。根据测得的RNA浓度值,使用相同量RNA进行反转录。反转录体系(10 μL):5 × Prime Script Buffer 2 μL、PrimeScript RT Enzyme Mix I 0.5 μL、RNase inhibitor 1 μL、特异性反转录引物0.5 μL(10 nmol/L),RNA 500 ng,加RNase free water至10 μL。反转录按照以下条件进行:42℃ 30 min,85℃ 5 s。然后进行qPCR,反应体系如下:SYBR® Premix Ex Taq™ II 10 μL、上下游引物各1 μL(10 nmol/L)、cDNA1μL,加水至20 μL。PCR反应程序:94 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,70 ℃延伸 20 s,循环 40 次;72 ℃延伸 10 min。荧光定量得出的数据均采用2-Δct的计算方式计算。

表1 qRT-PCR引物Table 1 Primers used for qRT-PCR analysis
1.5 蛋白免疫印迹分析 制备感染日本血吸虫不同时期BALB/c小鼠肝脏蛋白裂解液,然后用BCA方法测定蛋白浓度。取同样浓度的蛋白进行10%SDA-PAGE 凝胶电泳分析。结束后,将蛋白转移到PVDF膜上。转膜结束后,用含5%(W/V)脱脂乳的PBST封闭液在室温条件下摇床中封闭2 h,然后用PBST洗3次,每次5 min。结束后,用抗鼠的STAT3(1∶2000稀释)、TGFBR2(1∶2000稀释)、MAPK14(1∶2000稀释)多克隆抗体及抗鼠的α-Tubulin单克隆抗体(1∶5000稀释)分别在4℃冰箱中孵育过夜,孵育结束后用PBST漂洗膜3次,每次5 min,洗去未结合的抗体。加入HRP标记的羊抗鼠IgG二抗(1∶5000稀释),在含1%牛奶的PBST溶液中室温孵育1 h。仔细清洗后,用Immobilon Western Chemiluminescent HRP Substrate室温孵育1 min,然后用Image Quant Las4000 Mini(GE Healthcare Limited)观察。
1.6 感染日本血吸虫小鼠血浆中miR-17-92簇丰度分析 利用Trizol LS Reagent(Life Technologies)提取感染血吸虫小鼠血浆中总RNA。反转录和qRT-PCR分析参照1.4的qRT-PCR分析方法。
2 结果
2.1 感染血吸虫小鼠肝脏的miR-17-92簇表达分析 实时荧光定量PCR分析表明,miR-17-92簇在感染日本血吸虫小鼠不同时期的肝脏中呈现差异表达。感染后7、14、25 d与未感染肝脏相比,差异不具备显著统计学意义,而在感染后35 d和55 d则呈现明显升高(图1)。
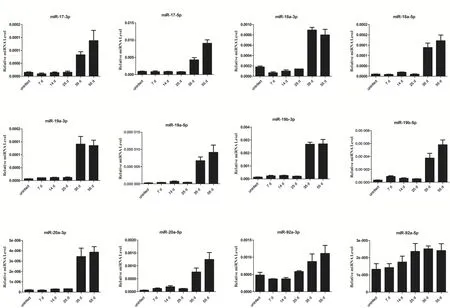
图1 miR-17-92 簇在感染血吸虫不同阶段小鼠肝脏中表达变化Fig.1 The relative expression levels of miR-17-92 cluster in the liver of mice at different stages of schistosome infection
2.2 感染血吸虫小鼠肝脏的miR-17-92簇靶基因的表达分析 荧光定量PCR结果显示,在感染日本血吸虫不同时期的小鼠肝脏中,miR-17-92簇靶基因的表达也发生了变化(图2)。感染后早期(7、14、25 d)与未感染肝脏相比,其表达水平呈现一定的升高趋势,随后在感染后35 d和55 d呈现下降趋势。免疫印迹分析表明在日本血吸虫感染的不同时间阶段靶基因STAT3、TGFBR2及MAPK14的表达也发生变化,与转录水平变化一致(图3)。
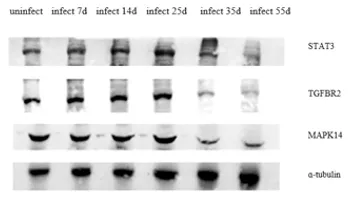
图3 miR-17-92 簇靶基因的蛋白水平变化Fig.3 Protein levels of miR-17-92 cluster targets
2.3 感染日本血吸虫小鼠血浆中miR-17-92簇丰度分析 为了进一步验证miR-17-92簇在宿主病理中的变化,我们又利用qRT-PCR分析了在感染日本血吸虫不同时期小鼠血浆中miR-17-92簇丰度情况。结果表明感染后7、14、25 d组与未感染组相比,miRNA丰度差异不明显,在感染后35 d和55 d则呈现明显升高(图4)。
3 讨论
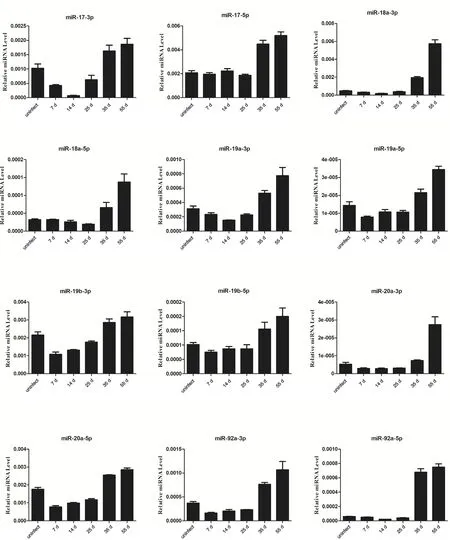
图4 miR-17-92簇在感染血吸虫不同阶段小鼠血浆中的相对表达水平Fig.4 The relative expression levels of miR-17-92 cluster in plasma of mice infected with Schistosoma japonicum
miRNAs通过转录后调节其相应的靶mRNAs表达,在多种生命进程中发挥重要作用。miR-17-92基因簇[14,15]被多数学者认为是一种强效的原癌基因,也是原癌基因miRNA的典型代表[16,17],在胚胎发育、免疫系统、肾脏和心脏发育、衰老以及肿瘤发生中起着作用[18]。近年来,越来越多的研究表明miR-17-92 簇及其旁系同源体在不同肿瘤中表现原癌基因特性,例如B细胞淋巴瘤、急性骨髓性白血病、成视网膜细胞瘤、胰腺癌、乳腺癌等。
为了研究miR-17-92 簇在感染日本血吸虫宿主肝脏中的功能,本研究利用qRT-PCR方法分析感染日本血吸虫后不同时期小鼠肝脏及血浆中miR-17-92 簇的表达情况。结果发现与未感染组相比,感染后7、14、25 d小鼠肝脏中miR-17-92 簇的表达水平变化不大,但在感染后35 d及55 d其表达水平显著升高,说明miR-17-92 簇有可能在血吸虫感染引起宿主肝脏病理损害中发挥重要作用,miR-17-92簇在血浆中的差异表达,使其有可能作为一种血吸虫感染宿主肝脏发生病理损伤的标识物。另一方面为进一步揭示miR-17-92 簇在血吸虫感染引起宿主肝脏病理过程中潜在的分子调控作用,根据已发表的文献并结合生物信息学选择miR-17-92 簇的靶基因[19],利用qRT-PCR和免疫印迹技术,分析感染血吸虫后,不同时期小鼠肝脏中的这些miRNA靶基因在转录水平和蛋白水平表达差异。研究结果显示这些靶基因的转录水平及蛋白水平在肝脏发生病变前都有不同程度升高,而发生病变后下降。说明miR-17-92簇的miRNAs有可能通过调控这些靶基因,进而参与肝脏病理损害的调节,而这些靶基因也有成为吸虫感染宿主肝脏发生病理损伤的标识物的潜力。
本研究实时荧光定量PCR结果中,这些miRNA靶点的表达水平随着日本血吸虫感染小鼠肝脏的不同时期而改变。一般来说,这些靶标的表达都与相对应的miRNA有关。如miR-17-92簇的miRNA靶基因TGF-β,已有研究表明TGF-β是一个主要的促纤维化因子,在炎症的发展和肝脏纤维化过程中起着关键作用[20,21]。活性TGF-β1激发其下游信号通路,引起Smad3、Smad4的活动,调节参与肝脏纤维化过程中大量纤维化基因的表达[22]。研究表明,miRNAs (miR-17-92 cluster 的成员:miR-146a[23]和miR-20[24])参与靶信号分子TGF-β的信号通路。miR-17-5p[25]是miR-17-92 簇的一个成员,与STAT3共同参与调控细胞自噬作用、肿瘤转移、细胞增殖。在血吸虫病中,TGF-β已被证明与血吸虫感染在肝脏中的损伤有关[26]。
本研究对感染日本血吸虫小鼠肝脏miR-17-92簇的表达变化进行了分析,并初步探究了其可能在感染血吸虫肝脏病理变化中的角色,为进一步阐述miR-17-92 簇在血吸虫感染引起的宿主肝脏病变中的调控功能,筛选有效的抗血吸虫候选疫苗和药物靶标奠定了基础。
