宰后成熟过程中羊肉食用品质及蛋白稳定性的变化研究
2018-07-18魏燕超刘满顺刘永峰
魏燕超,刘满顺,刘永峰
(陕西师范大学 食品工程与营养科学学院,陕西 西安,710062)
近年来,陕北横山羊肉产业迅速发展,横山羊肉因其有营养丰富、蛋白质含量高、脂肪含量适中、胆固醇含量低、肌纤维细嫩、柔软、味美多汁、无膻味、香味浓郁等特点被誉为“肉中之人参”,深受广大消费者青睐[1]。食用品质是决定肉类商品价值的最重要因素,而食用品质中嫩度、持水性等指标对肉的品质影响较大[2]。剪切力是衡量肌肉嫩度的一个重要指标,羊肉肩部肌肉、背最长肌、臀部肌肉等不同部位肉块的剪切力值之间有极显著差异[3]。肉的持水性是肉品保持自身水分的能力,也是评价肉品质的重要指标,常用汁液流失率(drip loss)和蒸煮损失率(cooking loss)2个指标进行评价。正常情况下,宰后肌肉汁液流失是不可避免的,然而大量汁液流失不但降低肉的营养价值,而且使肉品重量减少,肉色和嫩度劣变[4]。巴吐尔等研究发现,羊肉的嫩度、持水性在不同分割部位间、不同成熟期间差异显著[2]。除此之外,羊宰后胴体分割部位和肌肉中蛋白质的结构与功能特性对肉与肉制品的品质影响也较显著,宰后羊肉在成熟期间,发生的一系列生化变化,使肌肉蛋白结构和组成发生变化,从而对肉品质产生影响[5]。LI等[6-7]研究结果说明肌原纤维蛋白结构的破坏和肌肉蛋白质的水解能提高肉的嫩度,且随着宰后成熟时间的延长以及胴体pH变化,肌肉蛋白逐渐降解;而蛋白溶解度也能反映肌肉蛋白降解情况[8]。
鉴于不同部位羊肉在嫩度、持水性、蛋白结构等方面具有显著差异,且具有地方特色的横山羊肉品质鲜有研究。因此,本研究以剪切力、汁液流失率、蒸煮损失、肌浆蛋白和肌原纤维蛋白溶解性变化和肌原纤维蛋白的降解情况来探讨宰后横山羊肉品质的变化,以期为横山羊肉的宰后适时选择提供理论依据。
1 材料与方法
1.1 试验原料与试剂
1.1.1 试验原料
本试验所用羊肉采自榆林洋洸农牧业有限公司。屠宰选取体重相近、饲养方式相同的10月龄的陕北白绒山羊10只(公羊,未去势,体重(23.12±1.62) kg)。分别在宰后4、8、12、24、48 h取10只山羊的背最长肌(HQ)和腹部肌肉(LQ)作为样品,并置于50 mL离心管中,于干冰中运回实验室后,储存于-80 ℃冰箱中。
1.1.2 主要仪器
Multiskan Go全波长酶标仪,美国热电公司;TA.XT.Plus质构仪,英国Stable Micro System公司;TS-1脱色摇床,海门市其林贝尔仪器制造有限公司;Mini-PROTEAN Tetra System蛋白电泳仪,美国Bio-Rad公司; JA2003N电子天平,上海精密仪器有限公司;BIO-BEST200E凝胶成像仪,美国西盟;TGL-16gR高速冷冻离心机,上海安亭科学仪器厂;DW-HL398S超低温冰箱,中科美菱低温科技股份有限公司;HH-4数显恒温水浴锅,金坛市岸头仪都仪器厂。
1.1.3 主要试剂
BCA试剂盒、上样缓冲溶液,北京康为试剂公司;蛋白Marker,北京康润生物技术有限公司;乙醇、乙酸、KH2PO4,天津科密欧化学试剂有限公司;二硫苏糖醇(DTT)、三羟甲基氨基甲烷(Tris Base)、十二烷基硫酸钠(SDS)、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵(APS)、四甲基乙二胺(TEMED),美国Sigma公司;SYPRO Ruby染色液,美国Invitrogen 公司。
1.2 试验方法
1.2.1 羊肉剪切力的测定
参照农业行业标准NY/T1180—2006测定[9]。从冰箱中取出羊肉样品,剔除筋膜,并沿肌纤维方向修整成均匀的肉块(6 cm×6 cm×3 cm),放入80 ℃恒温水浴锅中加热至肉样中心温度达到70 ℃时,将肉样取出冷却至室温,切成较为规则的小块(1 cm×1 cm×3 cm),用质构仪垂直于肌肉纤维方向剪切测定其剪切力。探头距离为25 mm,速度为60 mm/min。每个样品测定5次。
1.2.2 汁液流失率和蒸煮损失的测定
参照夏安琪等[10]方法测定汁液流失率。肉样称重并记质量为W1,用S型钩钩住肉样的一端,将肉置于一个已吹气膨胀的保鲜袋中,确保羊肉不与袋子接触,用细线将口扎紧,放在4 ℃恒温箱静置24 h后,取出肉样,再次称重并记质量为W2。肉的汁液流失率计算公式:
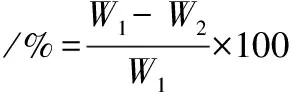
(1)
蒸煮损失测定方法参照HONIKEL等[11]的方法。肉样称重并记质量为W1,放入蒸煮袋中封口包装,于80 ℃水浴45 min后,冷却至室温并置于4 ℃过夜。将肉块取出,用滤纸轻轻吸干表面汁液,再次称重记质量为W2。羊肉蒸煮损失计算方法如下:
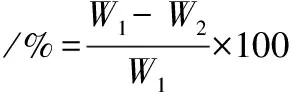
(2)
1.2.3 蛋白质溶解度的测定
参照BOWKER等[12]的方法测定。肌浆蛋白溶解度测定:取约1 g样品置于10 mL预冷的磷酸缓冲液中(0.25 mol/L,pH 7.2),冰上匀浆,然后置于摇床上4 ℃过夜。次日2 500 r/min离心20 min后,取上清,用BCA(bicinchoninic acid)法测定蛋白浓度,得到肌浆蛋白溶解度。全蛋白溶解度测定:取约1 g肉样,置于10 mL预冷的含1.1 mol/L KI的磷酸缓冲液中(0.1 mol/L,pH 7.2),冰上匀浆,然后置于摇床上4 ℃放置过夜,之后2 500 r/min离心20 min,取上清用BCA法测定蛋白浓度,即为全蛋白溶解度。肌原纤维蛋白溶解度测定:为全蛋白溶解度和肌浆蛋白溶解度的差值。
1.2.4 蛋白质的SDS-PAGE电泳
蛋白提取:参照HUANG等[13]的方法,称取约1 g肉样置于离心管中,加入6 mL预冷的缓冲溶液(0.1 mol/L Tris pH 8.3、0.01 mol/L DTT),均质后于4 ℃条件下10 000 r/min离心20 min,收集上清液用作肌浆蛋白分析,剩余沉淀主要是肌原纤维蛋白;在沉淀中加入25 mL 5% SDS缓冲溶液,涡旋混匀后,使沉淀溶解后,于80 ℃水浴30 min,分装后置于-80 ℃保存,用于后续分析。采用BCA法测定蛋白浓度,用全波长酶标仪检测吸光度。
SDS-PAGE电泳:SDS-PAGE电泳用12%分离胶和4%的浓缩胶。提取得到的肌原纤维蛋白样品与一定量的上样缓冲液混合后,沸水水浴3 min,之后冷却至室温,于3 000 r/min离心2 min,取上清,上样。上样量为8 μg。电泳初始电压为70 V,待溴酚蓝进入分离胶后,将电压上调到120 V,待溴酚蓝泳动至离凝胶底部约0.5 cm处停止电泳即可。
SYPRO Ruby染色:将胶浸入到约100 mL固定溶液(含40%甲醇和10%乙酸)中,置于脱色摇床上固定2 h后,弃去浸泡凝胶的固定液,并以100 mL双蒸水洗胶2~3次,每次10 min;洗胶结束后加入适量SYPRO Ruby染色没过凝胶,避光染色过夜。染色完成后,弃去上述染色液,加入已配好的100 mL脱色液(含10%乙醇和7%乙酸)浸没凝胶,置于脱色摇床上避光脱色30 min。
凝胶成像:脱色完后,用BIO-BEST200E凝胶成像仪采集图像。光源波长设置为254 nm。
1.3 数据处理
数据统计分析采用SPSS 17.0软件,多重比较方法采用Duncan法,结果以“平均值±标准差”表示。
2 结果与分析
2.1 剪切力变化的结果分析
宰后48 h的HQ、LQ组横山羊肉剪切力的变化结果见图1。
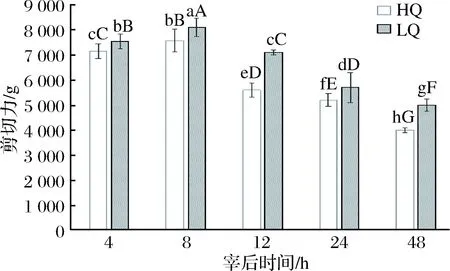
图1 宰后48 h HQ、LQ组横山羊肉剪切力的变化Fig.1 Changes of shearing force of Hengshan mutton with HQ and LQ group after slaughter 48 h注:所有柱子上不同小写字母表示任意2组间差异显著(p<0.05),不同大写字母表示差异极显著(p<0.01)。
宰后早期(4~8 h)2组羊肉的剪切力均极显著增加(p<0.01),在宰后12 h时羊肉剪切力较早期极显著减小(p<0.01),并且在12 h之后羊肉剪切力持续减小;宰后48 h时,HQ、LQ组剪切力分别减小至最高剪切力时的52%和60%。同一时间段,HQ组羊肉的剪切力极显著小于LQ组(p<0.01)。说明了随着宰后时间的延长,宰后早期2组肉嫩度较差,从宰后12 h开始,肉质又逐渐变嫩且最终嫩度优于宰后早期;在同一时间段,HQ组的肉质均嫩于LQ组,且剪切力随时间变化程度较大。
2.2 持水性变化的结果分析
宰后48 h的HQ、LQ组横山羊肉持水性的变化结果见表1。随着宰后时间的延长,羊肉的汁液流失率和蒸煮损失率均显著增加(p<0.05),而且2组的汁液流失率和蒸煮损失率变化程度基本一致;在同一时间段,除了宰后24 h的汁液流失率外,HQ组羊肉的汁液流失率和蒸煮损失均显著小于LQ组(p<0.05)。汁液流失率和蒸煮损失率与肉的持水性紧密相关,说明了随着宰后时间延长HQ组的持水性较好。

表1 宰后48 h HQ、LQ组质横山羊肉持水性的变化Table 1 Changes of swater-holding capacity of Hengshan mutton with HQ and LQ group after slaughter 48 h
注:同一指标中不同小写字母表示任意2组间差异显著(p<0.05),不同大写字母表示差异极显著(p<0.01)。
2.3 蛋白溶解度变化的结果分析
2.3.1 肌浆蛋白溶解度
宰后48 h的HQ、LQ组横山羊肉肌浆蛋白溶解度的变化结果见图2。2组羊肉肌浆蛋白溶解度均随着宰后时间延长逐渐增大(p<0.01),且两组的增加速率较一致;同一时间段,HQ组羊肉的肌浆蛋白溶解度始终极显著高于LQ组羊肉(p<0.01)。蛋白的溶解度反映了蛋白的降解程度,结果说明HQ组羊肉的肌浆蛋白降解程度较大。
2.3.2 肌原纤维蛋白溶解度
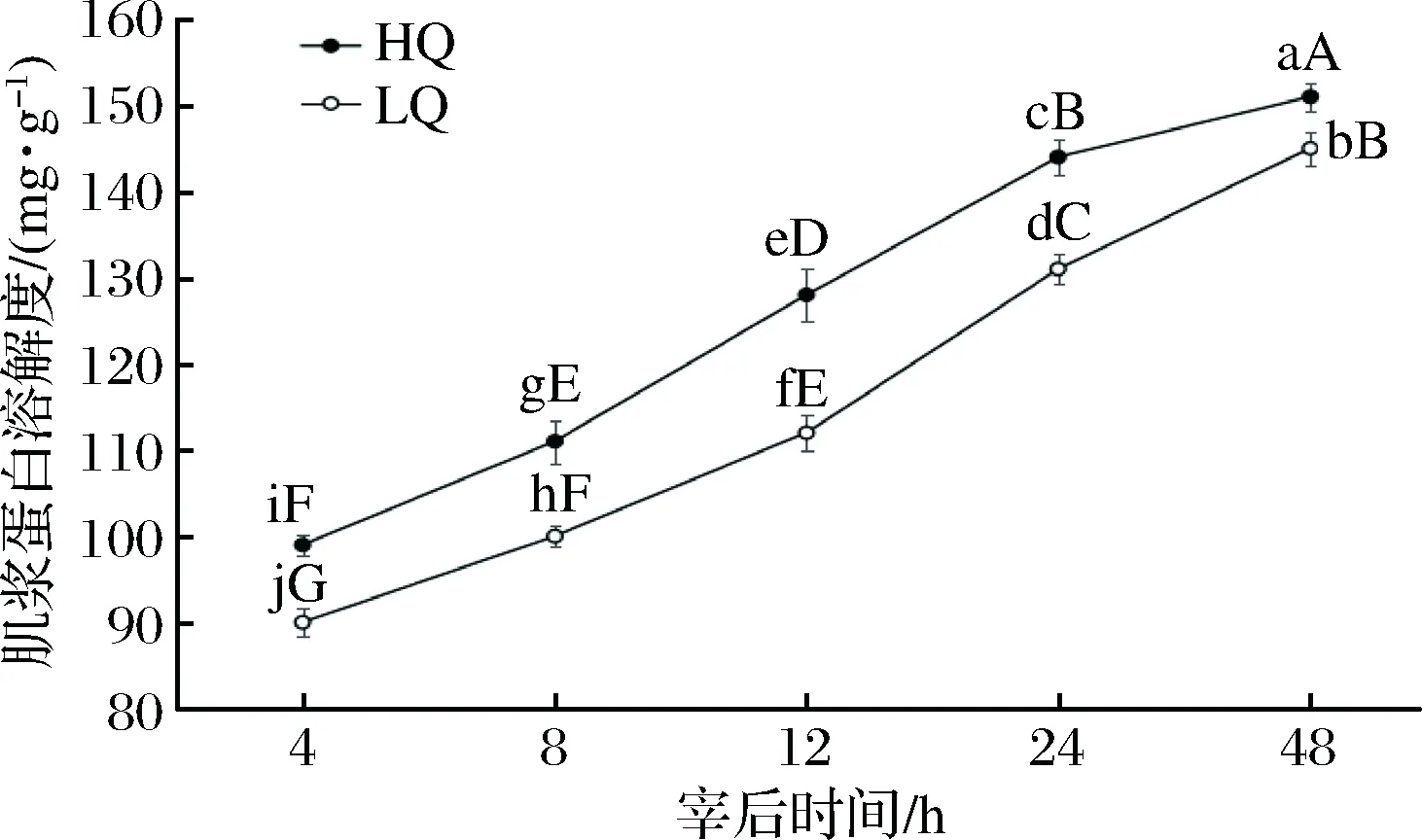
图2 宰后48 h HQ、LQ组横山羊肉肌浆蛋白溶解度的变化Fig.2 Changes of sarcoplasmic protein solubility of Hengshan mutton with HQ and LQ group quality after slaughter 48 h注:2条折线上不同小写字母表示任意2组间差异显著(p<0.05),不同大写字母表示差异极显著(p<0.01)。
宰后48 h的HQ、LQ组横山羊肉肌原纤维蛋白溶解度的变化结果见图3。在宰后12 h内两组肉样肌原纤维蛋白溶解度均显著下降(p<0.05), 12 h后,溶解度逐渐增加,但在48 h时两组肌原纤维蛋白的溶解度均显著小于最初的溶解度(p<0.05)。说明了2组肉样的肌原纤维蛋白在宰后前12 h无降解或降解程度较小,在12 h之后降解程度持续增加,肉质嫩度增加,所以宰后12 h是肉质变化的关键点。此外,2组肉样的肌原纤维蛋白溶解度差异显著(p<0.05),宰后4、8和12 h内,LQ组羊肉的蛋白溶解度显著大于HQ组(p<0.05),而在宰后24 h和48 h时LQ组羊肉的蛋白溶解度显著小于HQ组(p<0.05)。说明在宰后肉质成熟过程中,24 h之前LQ组肌原纤维蛋白溶解较大,在24 h左右被HQ组反超。
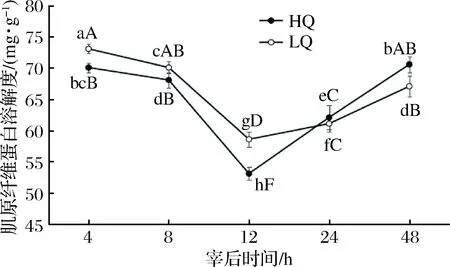
图3 宰后48 h HQ、LQ组横山羊肉肌原纤维蛋白溶解的变化Fig.3 Changes of myofibrillar protein solubility of Hengshan mutton with HQ and LQ group after slaughter 48 h注:2条折线上不同小写字母表示任意两组间差异显著(p<0.05),不同大写字母表示差异极显著(p<0.01)。
2.4 肌原纤维蛋白降解的结果分析
为了更详细分析肌原纤维蛋白降解的复杂情况,我们又采用了SDS-PAGE电泳分析法,宰后48 h的HQ、LQ组横山羊肉肌原纤维蛋白降解的变化结果见图4。
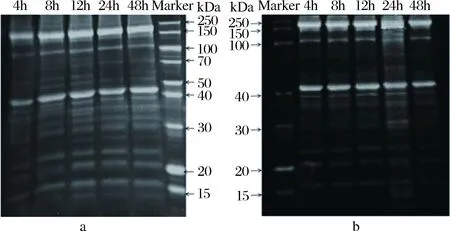
a-HQ组羊肉;b-LQ组羊肉图4 宰后48 h HQ、LQ组横山羊肉肌原纤维蛋白SDS-PAGE图谱Fig.4 Changes of DS-PAGE spectrum of myofibrillar protein of Hengshan mutton with HQ and LQ group after slaughter 48 h
肌肉中主要的肌原纤维蛋白从上到下依次是肌球蛋白重链(220 kDa)、α-辅肌动蛋白(100 kDa)、肌动蛋白(43 kDa)及的肌球蛋白轻链1(23 kDa)。由图4-a可知HQ组羊肉肌原纤维蛋白在成熟4~12 h新条带产生增多,尤其表现在40~30 kDa的肽段,24~48 h新产生条带又逐渐消失且恢复原状,与图3的走势基本一致。由图4-b可知,LQ组羊肉肌原纤维蛋白与HQ组的表现时间也基本一致;与图4-a相比,LQ组12 h前条带更弥散一些,而24 h和48 h弥散程度又弱于HQ组。因此,本电泳图基本与肌原纤维蛋白降解图的现象保持一致。
3 讨论
羊肉的嫩度不仅反映肉的质地,而且是消费者最重视的肉品质之一,也是评判肉质优劣的最常用指标,对肉的商业价值影响较大[14]。本研究发现2组肉样在宰后过程中剪切力先增大后减小的趋势与刘汉丽的研究结果相似[15]。该变化趋势可能由于宰后胴体进入了僵直期,且胴体进行无氧反应产生ATP含量不足以使得肌动蛋白与肌球蛋白结合后再分开,进而导致肌原纤维收缩,剪切力逐渐变大[16];但宰后12 h开始,胴体开始解僵,剪切力又逐渐减小,肉质又逐渐变嫩,且最终嫩度优于宰后早期。研究还发现,在同一时间段,背最长肌肉的剪切力始终小于腹部肌肉,且两者之间的差值不稳定,这可能是由于不同部位肉样的肌原纤维、结缔组织、肌肉脂肪含量与分布,以及各种蛋白结构特性等存在差异所致[17]。
以汁液流失率和蒸煮损失率计算的肉持水性,也是肉食用品质优劣的重要体现[18]。本研究发现汁液流失率和蒸煮损失率随时间延长显著增加,其中蒸煮损失的增加一定范围内会增强肉的嫩度,但汁液流失会伴随水、可溶性蛋白质、无机盐类、维生素等物质流失,从而导致嫩度、风味、营养价值等品质的下降,且汁液流失率对肉品质的影响较蒸煮损失率更大;该结果可能是由于宰后肌原纤维蛋白和细胞膜链接在一起的蛋白的降解,为肌肉汁液的流失提供了通道[19-20];还可能因为肌肉成熟过程中产生的乳酸使pH值下降至主要蛋白质的等电点时,蛋白质的正负电荷相等,蛋白质开始相互吸引,肌原纤维之间间隔的减小使得对水分的吸引和滞留空间减小[21]。
肌浆蛋白溶解度变化受宰后短时间内肉样的温度和pH值改变而影响。本研究发现,羊肉肌浆蛋白溶解度随着时间延长而逐渐增大,可能是因为宰后短时间内肉样的温度和pH值改变,使得肌浆蛋白重链发生部分伸展和重新折叠,部分表面疏水基团暴露和伸展,导致其表面界面活力增加,乳化能力提高,溶解度增加[22]。此外,同一时间段,背最长肌肉的肌浆蛋白溶解度始终显著高于腹部肌肉,可能是不同部位羊肉的pH值、温度等下降速率不同导致溶解度存在差异,与肉的持水力也显著相关[23]。
肉成熟期间,肌原纤维蛋白降解及其降解形成的多肽与肉的嫩度、持水性等食品品质密切相关[24-26]。本研究发现,羊肉的肌原纤维蛋白溶解度在前12 h逐渐下降,12 h之后持续增加,这与魏秀丽等人的研究结果相一致[8],该结果原因可能是促使肌原纤维蛋白聚合和降解的钙蛋白酶(μ-calpain)在僵直期活性较低,而解僵后μ-calpain被肌浆网中释放的Ca2+活化,其活性迅速增加,而影响肌原纤维蛋白溶解度;也可能是肌原纤维蛋白中的肌动蛋白、肌球蛋白结合形成的肌动球蛋白易被解离生成小分子蛋白,增强与水分子相互作用而增加了溶解度[27]。本研究发现的宰后24 h之前背最长肌肉的溶解和降解更为严重,而在24 h之后腹部肌肉的溶解和降解更为严重,这可能是2组肉样pH值、温度等下降速率不同所致。SDS-PAGE电泳图检测结果进一步验证了肌原纤维蛋白溶解结果,在降解过程在产生的多肽条带可能是细胞凋亡酶Capases家族降解的肌肉细胞骨架蛋白[28-29];多肽条带也可能是胞浆Ca2+诱导Caspases家族级联反应而使Caspase-3活化,促使肌钙蛋白T降解并出现30 kDa特征性降解产物[30-31];多肽条带还可能是Caspase-6能降解肌间线蛋白(Desmin)生成的降解产物(33 kDa和50 kDa)[32]。
4 结论
宰后2 d内,横山羊肉的剪切力明显减少,嫩度优化;羊肉通过汁液流失率、蒸煮损失率指标反映出持水性逐渐减弱;其蛋白溶解性也反映了蛋白质稳定性逐渐减弱。经比较背最长肌、腹部肌肉的横山羊肉食用品质和蛋白质稳定性,背最长肌较腹部肌肉的嫩度和持水性较优、蛋白稳定性较差。
